Carbonato
 Anión carbonato | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Carbonato | |
| Nombre sistemático de la IUPAC Trioxidocarbonato [1] : 127 | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) |
|
| Araña química |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
| |
| |
| Propiedades | |
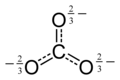
| CO2−3 | |
| Masa molar | 60,008 g·mol −1 |
| Ácido conjugado | Bicarbonato |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
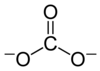
Un carbonato es una sal del ácido carbónico , H2CO3 , [ 2 ] caracterizado por la presencia del ion carbonato , un ion poliatómico con la fórmula CO2−3La palabra "carbonato" también puede referirse a un éster de carbonato , un compuesto orgánico que contiene el grupo carbonato O=C(−O−) 2 .
El término también se utiliza como verbo para describir la carbonatación : el proceso de aumentar las concentraciones de iones de carbonato y bicarbonato en el agua para producir agua carbonatada y otras bebidas carbonatadas, ya sea mediante la adición de gas de dióxido de carbono bajo presión o disolviendo sales de carbonato o bicarbonato en el agua.
En geología y mineralogía , el término "carbonato" puede referirse tanto a minerales carbonatados como a rocas carbonatadas (que están compuestas principalmente de minerales carbonatados), y ambos están dominados por el ion carbonato, CO.2−3Los minerales carbonatados son extremadamente variados y omnipresentes en las rocas sedimentarias precipitadas químicamente . Los más comunes son la calcita o carbonato de calcio , CaCO3 , el principal constituyente de la piedra caliza (así como el componente principal de las conchas de moluscos y esqueletos de coral ); la dolomita , un carbonato de calcio y magnesio CaMg(CO3 ) 2 ; y la siderita , o carbonato de hierro(II) , FeCO3 , un importante mineral de hierro . El carbonato de sodio ( "sosa" o "natrón"), Na2CO3 , y el carbonato de potasio ("potasa"), K2CO3 , se han utilizado desde la antigüedad para la limpieza y conservación, así como para la fabricación de vidrio . Los carbonatos se utilizan ampliamente en la industria, como en la fundición de hierro, como materia prima para la fabricación de cemento Portland y cal , en la composición de esmaltes cerámicos y más. Las nuevas aplicaciones de los carbonatos de metales alcalinos incluyen: almacenamiento de energía térmica, [3] [4] catálisis [5] y electrolitos tanto en tecnología de celdas de combustible [6] como en electrosíntesis de H 2 O 2 en medios acuosos. [7]
Estructura y unión
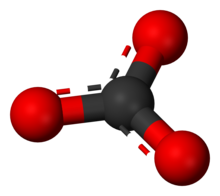
El ion carbonato es el anión oxocarbonado más simple . Consiste en un átomo de carbono rodeado por tres átomos de oxígeno , en una disposición plana trigonal , con simetría molecular D 3h . Tiene una masa molecular de 60,01 g/mol y lleva una carga formal total de −2. Es la base conjugada del ion hidrogenocarbonato (bicarbonato) [8] , HCO−3, que es la base conjugada del H 2 CO 3 , ácido carbónico .
La estructura de Lewis del ion carbonato tiene dos enlaces simples (largos) a átomos de oxígeno negativos y un enlace doble corto a un átomo de oxígeno neutro.
Esta estructura es incompatible con la simetría observada del ion, lo que implica que los tres enlaces tienen la misma longitud y que los tres átomos de oxígeno son equivalentes. Como en el caso del ion nitrato isoelectrónico , la simetría se puede lograr mediante una resonancia entre tres estructuras:
Esta resonancia se puede resumir mediante un modelo con enlaces fraccionarios y cargas deslocalizadas :
Propiedades químicas
.jpg/440px-Labeled_speleothems_(cropped).jpg)
Los carbonatos metálicos generalmente se descomponen al calentarlos, liberando dióxido de carbono y dejando un óxido del metal. [2] Este proceso se llama calcinación , por calx , el nombre latino de la cal viva u óxido de calcio , CaO, que se obtiene tostando piedra caliza en un horno de cal :
- CaCO3 → CaO + CO2
Como lo ilustra su afinidad por el Ca 2+ , el carbonato es un ligando para muchos cationes metálicos. Los complejos de carbonato y bicarbonato de metales de transición presentan iones metálicos unidos covalentemente al carbonato en una variedad de modos de enlace.
Los carbonatos de litio , sodio , potasio , rubidio , cesio y amonio son sales solubles en agua, pero los carbonatos de iones 2+ y 3+ suelen ser poco solubles en agua. De los carbonatos metálicos insolubles, el CaCO3 es importante porque, en forma de incrustaciones , se acumula en las tuberías e impide el flujo a través de ellas. El agua dura es rica en este material, lo que da lugar a la necesidad de ablandamiento de agua en las infraestructuras .
La acidificación de los carbonatos generalmente libera dióxido de carbono :
- CaCO 3 + 2 HCl → CaCl 2 + CO 2 + H 2 O
De esta manera, las incrustaciones se pueden eliminar con ácido.
En solución, el equilibrio entre carbonato, bicarbonato, dióxido de carbono y ácido carbónico es sensible al pH, la temperatura y la presión. Aunque los carbonatos divalentes y trivalentes tienen una solubilidad baja, las sales de bicarbonato son mucho más solubles. Esta diferencia está relacionada con las energías reticulares dispares de los sólidos compuestos por mono- y dianiones, así como por mono- y dicationes.
En solución acuosa , el carbonato, el bicarbonato, el dióxido de carbono y el ácido carbónico participan en un equilibrio dinámico . En condiciones fuertemente básicas, predomina el ion carbonato, mientras que en condiciones débilmente básicas, prevalece el ion bicarbonato . En condiciones más ácidas, el dióxido de carbono acuoso , CO2 (aq) , es la forma principal, que, con agua, H2O , está en equilibrio con el ácido carbónico ; el equilibrio se inclina fuertemente hacia el dióxido de carbono. Así, el carbonato de sodio es básico, el bicarbonato de sodio es débilmente básico, mientras que el dióxido de carbono en sí es un ácido débil.
Carbonatos orgánicos
En química orgánica, un carbonato también puede referirse a un grupo funcional dentro de una molécula más grande que contiene un átomo de carbono unido a tres átomos de oxígeno, uno de los cuales tiene un doble enlace. Estos compuestos también se conocen como organocarbonatos o ésteres de carbonato, y tienen la fórmula general R−O−C(=O)−O−R′ o RR′CO 3 . Los organocarbonatos importantes incluyen el carbonato de dimetilo , los compuestos cíclicos carbonato de etileno y carbonato de propileno , y el sustituto del fosgeno, el trifosgeno .
Buffer
Tres reacciones reversibles controlan el equilibrio del pH de la sangre y actúan como un amortiguador para estabilizarlo en el rango de 7,37 a 7,43: [9] [10]
- H ++ HCO3−3⇌ H2CO3
- H 2 CO 3 ⇌ CO 2 (acuoso) + H 2 O
- CO2 ( ac ) ⇌ CO2 ( g)
El CO 2 (g) exhalado agota el CO 2 (aq) , que a su vez consume H 2 CO 3 , lo que provoca el equilibrio de la primera reacción para intentar restablecer el nivel de ácido carbónico mediante la reacción del bicarbonato con un ion hidrógeno, un ejemplo del principio de Le Châtelier . El resultado es hacer que la sangre sea más alcalina (elevar el pH). Por el mismo principio, cuando el pH es demasiado alto, los riñones excretan bicarbonato ( HCO−3) en la orina como urea a través del ciclo de la urea (o ciclo de la ornitina de Krebs-Henseleit). Al eliminar el bicarbonato, se genera más H + a partir del ácido carbónico ( H 2 CO 3 ), que proviene del CO 2 (g) producido por la respiración celular . [11]
Un amortiguador similar funciona de manera crucial en los océanos. Es un factor importante en el cambio climático y el ciclo del carbono a largo plazo, debido a la gran cantidad de organismos marinos (especialmente corales) que están hechos de carbonato de calcio. La mayor solubilidad del carbonato a través del aumento de las temperaturas da como resultado una menor producción de calcita marina y una mayor concentración de dióxido de carbono atmosférico. Esto, a su vez, aumenta la temperatura de la Tierra. La cantidad de CO2−3El CO2 disponible es de escala geológica y cantidades sustanciales pueden eventualmente ser redisueltas en el mar y liberadas a la atmósfera, aumentando aún más los niveles de CO2 . [12]
Sales de carbonato
- Descripción general del carbonato:
Presencia fuera de la Tierra
En general, se cree que la presencia de carbonatos en las rocas es una prueba contundente de la presencia de agua líquida. Observaciones recientes de la nebulosa planetaria NGC 6302 muestran evidencia de carbonatos en el espacio [13] , donde es poco probable que se produzca una alteración acuosa similar a la de la Tierra. Se han propuesto otros minerales que encajarían con las observaciones.
Se han encontrado pequeñas cantidades de depósitos de carbonato en Marte mediante imágenes espectrales [14] y los meteoritos marcianos también contienen pequeñas cantidades. Es posible que haya existido agua subterránea en Gusev [15] y Meridiani Planum . [16]
Véase también
- Carbonatos de capuchón
- Ácido ortocarbónico , H 4 CO 4 o C(OH) 4 , una molécula hipotéticamente inestable
- Oxalato
- Peroxocarbonato
- Percarbonato de sodio
Referencias
- ^ Unión Internacional de Química Pura y Aplicada (2005). Nomenclatura de la química inorgánica (Recomendaciones de la IUPAC 2005). Cambridge (Reino Unido): RSC – IUPAC . ISBN 0-85404-438-8 . Versión electrónica.
- ^ ab Chisholm, Hugh , ed. (1911). . Encyclopædia Britannica (11.ª ed.). Cambridge University Press.
- ^ Navarrete, N.; Nithiyanantham, U.; Hernández, L.; Mondragón, R. (1 de marzo de 2022). "Mezclas de carbonatos fundidos de K2CO3–Li2CO3 y sus nanofluidos para almacenamiento de energía térmica: una visión general de la literatura". Materiales de energía solar y células solares . 236 : 111525. doi :10.1016/j.solmat.2021.111525. hdl : 10234/196651 . ISSN 0927-0248. S2CID 245455194.
- ^ Lambrecht, Mickaël; García-Martín, Gustavo; de Miguel, María Teresa; Lasanta, María Isabel; Pérez, Francisco Javier (01-08-2023). "Dependencia de la temperatura de la corrosión a alta temperatura en aleaciones a base de níquel en carbonatos fundidos para aplicaciones de energía solar concentrada". Ciencia de la corrosión . 220 : 111262. Código Bib : 2023Corro.22011262L. doi : 10.1016/j.corsci.2023.111262 . ISSN 0010-938X.
- ^ Hayakawa, Mamiko; Tashiro, Kenshiro; Sumiya, Daiki; Aoyama, Tadashi (18 de junio de 2023). "Métodos simples para la síntesis de acrilamidas N-sustituidas utilizando Na2CO3/SiO2 o NaHSO4/SiO2". Synthetic Communications . 53 (12): 883–892. doi :10.1080/00397911.2023.2201454. ISSN 0039-7911. S2CID 258197818.
- ^ Milewski, Jarosław; Wejrzanowski, Tomasz; Fung, Kuan-Zong; Szczśniak, Arkadiusz; Ćwieka, Karol; Tsai, Shu-Yi; Dybiński, Olaf; Skibiński, Jakub; Tang, Jhih-Yu; Szabłowski, Łukasz (21 de abril de 2021). "Respaldo de la conductividad iónica del electrolito de carbonato fundido Li2CO3 / K2CO3 mediante el uso de una matriz de circonio estabilizada con itria". Revista Internacional de Energía del Hidrógeno . Taller internacional de carbonatos fundidos y temas relacionados 2019 (IWMC2019). 46 (28): 14977–14987. doi :10.1016/j.ijhydene.2020.12.073. Revista de Ciencias de la Computación .
- ^ Generación anódica de peróxido de hidrógeno en flujo continuo, DOI: 10.1039/D2GC02575B (Artículo) Green Chem., 2022, 24 , 7931-7940
- ^ Nomenclatura de la química inorgánica Recomendaciones de la IUPAC 2005 (PDF) , IUPAC, p. 137, archivado (PDF) desde el original el 18 de mayo de 2017
- ^ "Químico de la semana: tampones biológicos". Archivado desde el original el 21 de julio de 2011. Consultado el 5 de septiembre de 2010 .
- ^ Regulación ácido-base y trastornos en el Manual Merck de diagnóstico y tratamiento, edición profesional
- ^ Silverthorn, Dee Unglaub (2016). Fisiología humana. Un enfoque integrado (Séptima edición global). Harlow, Inglaterra: Pearson. pp. 607–608, 666–673. ISBN 978-1-292-09493-9.
- ^ IPCC (2019). "Resumen para responsables de políticas" (PDF) . Informe especial del IPCC sobre el océano y la criosfera en un clima cambiante . pp. 3–35.
- ^ Kemper, F., Molster, FJ, Jager, C. y Waters, LBFM (2001) La composición mineral y la distribución espacial de los eyectados de polvo de NGC 6302. Astronomía y Astrofísica 394 , 679–690.
- ^ Fairén, Alberto G.; Fernández-Remolar, David; Dohm, James M.; Baker, Victor R.; Amils, Ricardo (septiembre de 2004). "Inhibición de la síntesis de carbonatos en océanos ácidos en el Marte primitivo". Nature . 431 (7007): 423–426. Bibcode :2004Natur.431..423F. doi :10.1038/nature02911. ISSN 1476-4687. PMID 15386004.
- ^ Squyres, SW; et al. (2007). "Actividad piroclástica en Home Plate en el cráter Gusev, Marte" (PDF) . Science . 316 (5825): 738–742. Bibcode :2007Sci...316..738S. doi :10.1126/science.1139045. hdl : 2060/20070016011 . PMID 17478719. S2CID 9687521. Archivado (PDF) desde el original el 22 de septiembre de 2017.
- ^ Squyres, SW; et al. (2006). "Descripción general de la misión del rover de exploración marciano Opportunity a Meridiani Planum: del cráter Eagle al Purgatory Ripple" (PDF) . Journal of Geophysical Research: Planets . 111 (E12): n/a. Bibcode :2006JGRE..11112S12S. doi : 10.1029/2006JE002771 . hdl :1893/17165. Archivado (PDF) desde el original el 2017-08-08.
Enlaces externos
- Equilibrio de carbonato/bicarbonato/ácido carbónico en agua: pH de soluciones, capacidad tampón, titulación y distribución de especies vs. pH calculado con una hoja de cálculo gratuita
- "Carbonato". Dictionary.com . Consultado el 5 de abril de 2014 .