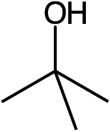
alcohol terc-butílico
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido 2-Metilpropan-2-ol | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 906698 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.000.809 | ||
| Número CE |
| ||
| 1833 | |||
| Malla | Alcohol terc-butílico + | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1120 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| Propiedades | |||
| C4H10O | |||
| Masa molar | 74,123 g·mol −1 | ||
| Apariencia | Sólido incoloro | ||
| Olor | Alcanforado | ||
| Densidad | 0,775 g/ml | ||
| Punto de fusión | 25 a 26 °C; 77 a 79 °F; 298 a 299 K | ||
| Punto de ebullición | 82 a 83 °C; 179 a 181 °F; 355 a 356 K | ||
| miscible [2] | |||
| registro P | 0,584 | ||
| Presión de vapor | 4,1 kPa (a 20 °C) | ||
| Acidez (p K a ) | 16.54 [3] | ||
| 5,742 × 10 −5 cm3 / mol | |||
Índice de refracción ( n D ) | 1.387 | ||
| 1,31 D | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 215,37 J·K −1 mol −1 | ||
Entropía molar estándar ( S ⦵ 298 ) | 189,5 J·K −1 mol −1 | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −360,04 a −358,36 kJ mol −1 | ||
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | −2,64479 a −2,64321 MJ mol −1 | ||
| Peligros | |||
| Etiquetado SGA : | |||
  | |||
| Peligro | |||
| H225 , H319 , H332 , H335 | |||
| P210 , P261 , P305+P351+P338 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | 11 °C (52 °F; 284 K) | ||
| 480 °C (896 °F; 753 K) | |||
| Límites de explosividad | 2,4–8,0% | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 3559 mg/kg (conejo, oral) 3500 mg/kg (rata, oral) [4] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 100 ppm (300 mg/m3 ) [ 1] | ||
REL (recomendado) | TWA 100 ppm (300 mg/m3 ) TWA 150 ppm (450 mg/m3 ) [ 1] | ||
IDLH (Peligro inmediato) | 1600 ppm [1] | ||
| Ficha de datos de seguridad (FDS) | es.inchem.org | ||
| Compuestos relacionados | |||
Butanoles relacionados | 2-butanol | ||
Compuestos relacionados | 2-Metil-2-butanol Trimetilsilanol | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El alcohol terc -butílico es el alcohol terciario más simple , con una fórmula de (CH3 ) 3COH ( a veces representado como t -BuOH). Sus isómeros son 1-butanol , isobutanol y butan-2-ol . El alcohol terc -butílico es un sólido incoloro, que se funde cerca de la temperatura ambiente y tiene un olor parecido al del alcanfor . Es miscible con agua , etanol y éter dietílico .
Ocurrencia natural
El alcohol terc -butílico se ha identificado en la cerveza y los garbanzos . [5] También se encuentra en la yuca , [6] que se utiliza como ingrediente de fermentación en ciertas bebidas alcohólicas .
Preparación
El alcohol terc -butílico se obtiene comercialmente a partir del isobutano como coproducto de la producción de óxido de propileno . También se puede producir mediante la hidratación catalítica del isobutileno o mediante una reacción de Grignard entre acetona y cloruro de metilmagnesio .
La purificación no se puede realizar por destilación simple debido a la formación de un azeótropo con agua, aunque el secado inicial del disolvente que contiene grandes cantidades de agua se realiza añadiendo benceno para formar un azeótropo terciario y destilando el agua. Se eliminan cantidades más pequeñas de agua secando con óxido de calcio (CaO), carbonato de potasio (K 2 CO 3 ), sulfato de calcio (CaSO 4 ) o sulfato de magnesio (MgSO 4 ), seguido de destilación fraccionada. El alcohol terc -butílico anhidro se obtiene mediante reflujo adicional y destilación a partir de magnesio activado con yodo o metales alcalinos como sodio o potasio. Otros métodos incluyen el uso de tamices moleculares de 4 Å , terc-butilato de aluminio, hidruro de calcio (CaH 2 ) o cristalización fraccionada en atmósfera inerte. [7]
Aplicaciones
El alcohol terc -butílico se utiliza como disolvente, desnaturalizante de etanol , ingrediente de decapado de pintura y potenciador del octanaje y oxigenante de la gasolina . Es un intermedio químico utilizado para producir metil terc -butil éter (MTBE) y etil terc -butil éter (ETBE) mediante la reacción con metanol y etanol , respectivamente, e hidroperóxido de terc -butilo (TBHP) mediante la reacción con peróxido de hidrógeno .
Reacciones
A diferencia de otros isómeros del butanol, el alcohol terc -butílico, como alcohol terciario, no tiene ningún átomo de hidrógeno junto al grupo hidroxi, lo que lo hace resistente a la oxidación a compuestos carbonílicos.
El alcohol terc -butílico se desprotona con una base fuerte para dar lugar al alcóxido . El terc -butóxido de potasio es particularmente común y se prepara tratando el terc -butanol con potasio metálico. [8]
- K + t -BuOH → t -BuO − K + + 1/2 H2
El terc -butóxido es una base fuerte y no nucleófila en la química orgánica. Extrae fácilmente protones ácidos de los sustratos, pero su volumen estérico impide que el grupo participe en la sustitución nucleofílica , como en una síntesis de éter de Williamson o una reacción S N 2 .
El alcohol terc -butílico reacciona con cloruro de hidrógeno para formar cloruro de terc -butilo .
O-Cloración de alcohol terc-butílico con ácido hipocloroso para dar hipoclorito de terc-butilo : [9]
- (CH 3 ) 3 COH + HOCl → (CH 3 ) 3 COCl + H 2 O
Farmacología y toxicología
Existen datos limitados sobre la farmacología y toxicología del terc-butanol en humanos y otros animales. [10] La exposición humana puede ocurrir debido al metabolismo de los oxigenados del combustible. El terc-butanol se absorbe mal a través de la piel, pero se absorbe rápidamente si se inhala o se ingiere. El terc-butanol es irritante para la piel y los ojos. La toxicidad de dosis únicas suele ser baja, pero las dosis altas pueden producir un efecto sedante o anestésico.
Referencias
- ^ abcd Guía de bolsillo del NIOSH sobre peligros químicos. "#0078". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "ICSC 0114 – tert-Butanol". Inchem.org . Consultado el 29 de marzo de 2018 .
- ^ Reeve, W.; Erikson, CM; Aluotto, PF (1979). "Alcohol terc-butílico". Can. J. Chem . 57 : 2747. doi : 10.1139/v79-444 .
- ^ "alcohol terc-butílico". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "Alcohol t-butílico". Base de datos HSDB de la Biblioteca Nacional de Medicina . Instituto Nacional de Salud . Consultado el 29 de marzo de 2018 .
- ^ "Copia archivada" (PDF) . Archivado desde el original (PDF) el 4 de marzo de 2016. Consultado el 5 de marzo de 2013 .
{{cite web}}: CS1 maint: copia archivada como título ( enlace ) - ^ Perrin, DD; Armarego, WLF (1988). Purificación de productos químicos de laboratorio (3.ª ed.). Pergamon Press. ISBN 9780080347141.
- ^ Johnson, WS; Schneider, WP (1950). "Ácido β-carbetoxi-γ,γ-difenilvinilacético". Organic Syntheses . 30 : 18. doi :10.15227/orgsyn.030.0018.
- ^ Mintz, HM; Walling, C. (1969). "Hipoclorito de t-butilo". Org. Synth . 49 : 9. doi :10.15227/orgsyn.049.0009.
- ^ Douglas McGregor (2010). "Tertiary-Butanol: una revisión toxicológica". Critical Reviews in Toxicology . 40 (8): 697–727. doi :10.3109/10408444.2010.494249. PMID 20722584. S2CID 26041562.
Enlaces externos
- Ficha internacional de seguridad química 0114
- Guía de bolsillo del NIOSH sobre peligros químicos. "#0078". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- Criterios de salud ambiental del IPCS 65: Butanoles: cuatro isómeros
- Guía de salud y seguridad del IPCS 7: terc-butanol