Terbutóxido de potasio
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Tert -butóxido de potasio | |||
| Otros nombres KOt-Bu, t -butóxido de potasio. | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.011.583 | ||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C 4 H 9 KO | |||
| Masa molar | 112,21 g mol −1 | ||
| Apariencia | sólido | ||
| Punto de fusión | 256 °C (493 °F; 529 K) | ||
| Punto de ebullición | sublima a 220 °C (1 mmHg) o a 140 °C (0,01 hPa) | ||
| Reacciona con el agua | |||
| Solubilidad en éter dietílico | 4,34 g/100 g (25-26 °C) [1] | ||
| Solubilidad en hexano | 0,27 g/100 g (25-26 °C) [1] | ||
| Solubilidad en tolueno | 2,27 g/100 g (25-26 °C) [1] | ||
| Solubilidad en THF | 25,00 g/100 g (25-26 °C) [1] | ||
| Peligros | |||
| Etiquetado SGA : [2] | |||
  | |||
| Peligro | |||
| H228 , H252 , H314 | |||
| P405 | |||
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad de Oxford | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El terc -butóxido de potasio (o t -butóxido de potasio ) es un compuesto químico con la fórmula [(CH3 ) 3COK ] n ( abr. KOtBu). Este sólido incoloro es una base fuerte (pKa de ácido conjugado alrededor de 17), que es útil en la síntesis orgánica . El compuesto a menudo se representa como una sal, y a menudo se comporta como tal, pero su ionización depende del disolvente. [1]
Preparación
El t -butóxido de potasio se encuentra disponible comercialmente como solución y como sólido, pero a menudo se genera in situ para su uso en el laboratorio porque las muestras son muy sensibles a la humedad y las muestras más antiguas suelen tener una pureza baja. Se prepara mediante la reacción de alcohol terc -butílico seco con potasio metálico. [3] El sólido se obtiene evaporando estas soluciones y calentándolo. El sólido se puede purificar por sublimación.
Estructura
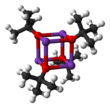
Cristaliza como un grupo tetramérico de tipo cubano . Cristaliza a partir de tetrahidrofurano / pentano a −20 °C como [tBuOK·tBuOH] ∞ , que consiste en cadenas lineales unidas por enlaces de hidrógeno . La sublimación de [tBuOK·tBuOH] ∞ produce el tetrámero [tBuOK] 4 , que adopta una estructura similar a la del cubano. Los disolventes básicos de Lewis suaves , como el THF y el éter dietílico, no rompen la estructura tetramérica, que persiste en el sólido, en solución e incluso en la fase gaseosa. [4]
Reacciones
Como base
Se han descrito muchas modificaciones que influyen en la reactividad de este reactivo. El compuesto adopta una estructura de racimo compleja (la imagen adyacente es una caricatura simplificada), y los aditivos que modifican el racimo afectan la reactividad del reactivo. Por ejemplo, DMF , DMSO , hexametilfosforamida (HMPA) y 18-corona-6 interactúan con el centro de potasio, produciendo pares de iones separados por disolventes como K(DMSO) x + y terc -BuO − . Mientras que en el benceno, por otro lado, el compuesto permanece como una estructura de racimo, que es menos básica. [1] Incluso en disolventes polares, no es tan fuerte como las bases de amida, por ejemplo, diisopropilamida de litio , pero más fuerte que el hidróxido de potasio. Su volumen estérico inhibe al grupo de participar en la adición nucleofílica, como en una síntesis de éter de Williamson o reacciones S N 2 relacionadas. [ cita requerida ]
Los sustratos que se desprotonan mediante t -butóxido de potasio incluyen acetilenos terminales y compuestos de metileno activos . Es útil en reacciones de deshidrohalogenación . Para ilustrar este último comportamiento, el tert -butóxido de potasio reacciona con cloroformo produciendo diclorocarbeno , que es útil para las ciclopropanaciones de dicloro . [5] [6] El tert -butóxido de potasio puede abstraer un beta-protón de los cationes de alquilamonio, lo que conduce al producto de Hofmann a través de una reacción de eliminación .
Otras reacciones
El terc -butóxido de potasio cataliza la reacción de hidrosilanos y compuestos heterocíclicos para dar los derivados de sililo, con liberación de H 2 . [7]
Seguridad
El terc -butóxido de potasio es una base muy fuerte que ataca rápidamente al tejido vivo.
El terc -butóxido de potasio forma mezclas explosivas cuando se trata con diclorometano. [8] [9]
Compuestos relacionados
Referencias
- ^ abcdef Caine D. (2006). "Potassiumtert-Butoxide". Potasio tert-Butoxide . Enciclopedia e-EROS de reactivos para síntesis orgánica . doi :10.1002/047084289X.rp198.pub2. ISBN 0471936235.
- ^ Registro de terc-butóxido de potasio en la base de datos de sustancias GESTIS del Instituto de Seguridad y Salud Ocupacional , consultado el 22 de diciembre de 2021.
- ^ William S. Johnson y William P. Schneider (1963). "Ácido β-carbetoxi-γ,γ-difenilvinilacético". Síntesis orgánicas; Volúmenes recopilados , vol. 4, pág. 132.
- ^ Chisholm, Malcolm H.; Drake, Simon R.; Naiini, Ahmad A.; Streib, William E. (1991). "Síntesis y estructuras cristalinas de rayos X de las cadenas de cinta unidimensionales [MOBu t ·Bu t OH] ∞ y la especie cubana [MOBu t ] 4 (M = K y Rb)". Poliedro . 10 (3): 337–345. doi :10.1016/S0277-5387(00)80154-0.
- ^ Brown, William; Foote, Christopher; Iverson, Brent; Anslyn, Eric (10 de enero de 2008). Química orgánica. Cengage Learning. ISBN 978-0495388579.
- ^ Margaret-Ann Armour (19 de abril de 2016). Guía de eliminación de sustancias químicas peligrosas de laboratorio, tercera edición. CRC Press. ISBN 9781420032383.
- ^ Anton A. Toutov, Wen-Bo Liu, Kerry N. Betz, Alexey Fedorov, Brian Stoltz , Robert H. Grubbs (2015). "Sililación de enlaces C–H en heterociclos aromáticos mediante un catalizador metálico abundante en la Tierra" (PDF) . Nature . 518 (7537): 80–84. Bibcode :2015Natur.518...80T. doi :10.1038/nature14126. PMID 25652999. S2CID 3117834.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Foden, Charles R.; Weddell, Jack L. (29 de diciembre de 1991). Materiales peligrosos: datos de acción de emergencia. CRC Press. ISBN 9780873715980.
- ^ Bretherick, L. (1990). Manual de peligros químicos reactivos 4.ª ed. Diclorometano: reactividades/incompatibilidades en la Biblioteca Nacional de Medicina del NIH. pág. 475. ISBN 9781483284668.