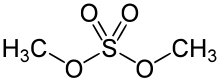
Sulfato de dimetilo
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Sulfato de dimetilo | |
| Otros nombres Sulfato de dimetilo; Éster dimetílico del ácido sulfúrico; Me2SO4 ; DMSO4 ; Éster dimetílico del ácido sulfúrico; Sulfato de metilo , di- | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.000.963 |
| BARRIL | |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C2H6O4S | |
| Masa molar | 126,13 g/mol |
| Apariencia | Líquido aceitoso e incoloro. |
| Olor | Débil, como una cebolla [1] |
| Densidad | 1,33 g/ml, líquido |
| Punto de fusión | -32 °C (-26 °F; 241 K) |
| Punto de ebullición | 188 °C (370 °F; 461 K) (se descompone) |
| Reacciona | |
| Solubilidad | Metanol , diclorometano , acetona |
| Presión de vapor | 0,1 mmHg (20 °C) [1] |
| −62,2 × 10 −6 cm3 / mol | |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Extremadamente tóxico, peligro de contacto, peligro de inhalación, corrosivo, peligro ambiental, cancerígeno, mutagénico |
| Etiquetado SGA : | |
   | |
| Peligro | |
| H301 , H314 , H317 , H330 , H335 , H341 , H350 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | 83 °C; 182 °F; 356 K [1] |
| Dosis o concentración letal (LD, LC): | |
LC 50 ( concentración media ) | 8,6 ppm (rata, 4 h) 75 ppm (conejillo de indias, 20 min) 53 ppm (ratón) 32 ppm (conejillo de indias, 1 h) [2] |
LC Lo ( valor más bajo publicado ) | 97 ppm (humano, 10 min) [2] |
| NIOSH (límites de exposición a la salud en EE. UU.): | |
PEL (Permisible) | TWA 1 ppm (5 mg/m 3 ) [piel] [1] |
REL (recomendado) | Ca TWA 0,1 ppm (0,5 mg/m 3 ) [piel] [1] |
IDLH (Peligro inmediato) | Ca [7 ppm] [1] |
| Compuestos relacionados | |
Compuestos relacionados | Sulfato de dietilo , triflato de metilo , carbonato de dimetilo |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El sulfato de dimetilo ( DMS ) es un compuesto químico con la fórmula (CH3O ) 2SO2 . Como diéster de metanol y ácido sulfúrico , su fórmula a menudo se escribe como ( CH3 ) 2SO4 o Me2SO4 , donde CH3 o Me es metilo . El Me2SO4 se utiliza principalmente como agente metilante en síntesis orgánica . El Me2SO4 es un líquido aceitoso incoloro con un ligero olor a cebolla. Como todos los agentes alquilantes fuertes , el Me2SO4 es tóxico . [ 3] Su uso como reactivo de laboratorio ha sido reemplazado en cierta medida por el triflato de metilo , CF3SO3CH3 , el éster metílico del ácido trifluorometanosulfónico .
Historia
El sulfato de dimetilo impuro se preparó a principios del siglo XIX. [4] Posteriormente, JP Claesson estudió en profundidad su preparación. [5] [6]
Se investigó su posible uso en la guerra química durante la Primera Guerra Mundial [7] [8] en una mezcla del 75% al 25% con clorosulfonato de metilo (CH3ClO3S ) llamado "C-stoff" en Alemania, o con ácido clorosulfónico llamado "Rationite" en Francia. [9]
La esterificación del ácido sulfúrico con metanol fue descrita en 1835: [10]
- 2CH3OH + H2SO4 → ( CH3 ) 2SO4 + 2H2O
Producción
El sulfato de dimetilo se produce comercialmente mediante la reacción continua de éter dimetílico con trióxido de azufre : [3]
- CH 3 OCH 3 + SO 3 → (CH 3 ) 2 SO 4
El sulfato de dimetilo se puede sintetizar en el laboratorio mediante varios métodos. [11] La reacción del nitrito de metilo y el clorosulfonato de metilo también da como resultado sulfato de dimetilo: [6]
- CH 3 ONO + (CH 3 )OSO 2 Cl → (CH 3 ) 2 SO 4 + NOCl
Reacciones y usos
El sulfato de dimetilo es un reactivo para la metilación de fenoles , aminas y tioles . Un grupo metilo se transfiere más rápidamente que el segundo. Se supone que la transferencia de metilo ocurre a través de una reacción S N 2 . En comparación con otros agentes metilantes, el sulfato de dimetilo es el preferido por la industria debido a su bajo costo y alta reactividad.
Metilación en oxígeno
Comúnmente se emplea el sulfato de dimetilo para metilar fenoles . [12] [13]
- C 6 H 5 ONa + (CH 3 O) 2 SO 2 → C 6 H 5 OCH 3 + Na (CH 3 O) SO 3 Na
En algunos casos, los alcoholes simples también se metilan, como lo ilustra la conversión de terc -butanol en t -butil metil éter :
- (CH 3 ) 3 COH + (CH 3 O) 2 SO 2 →(CH 3 ) 3 COH + Na(CH 3 O)SO 3 H
La metilación de azúcares se denomina metilación de Haworth . [14] La metilación de cetonas se denomina reacción de Lavergne.
Metilación en nitrógeno amínico
El Me2SO4 se utiliza para preparar tanto sales de amonio cuaternario como aminas terciarias :
- C 6 H 5 CH = NC 4 H 9 + (CH 3 O) 2 SO 2 → C 6 H 5 CH = N + (CH 3 )C 4 H 9 [CH 3 OSO 3 ] −
Los compuestos de amonio graso cuaternizado se utilizan como surfactante o suavizante de telas. La metilación para crear una amina terciaria se ilustra como: [13]
- CH 3 (C 6 H 4 )NH 2 + (CH 3 O) 2 SO 2 (en NaHCO 3 acuoso) → CH 3 (C 6 H 4 )N(CH 3 ) 2 + Na(CH 3 )SO 4
Metilación en azufre
Las sales de tiolato se metilan fácilmente con Me2SO4 para dar metiltioéteres : [ 13 ]
- RSNa + (CH 3 O) 2 SO 2 →CH 3 SR + Na (CH 3 O) SO 3 Na
En un ejemplo relacionado: [15]
- p - CH3C6H4SO2Na + ( CH3O ) 2SO2 → p - CH3C6H4SO2CH3 + Na ( CH3 ) SO4
Este método se ha utilizado para preparar tioésteres a partir de ácidos tiocarboxílicos :
- RC(O)SH + (CH 3 O) 2 SO 2 → RC(O)S(CH 3 ) + HOSO 3 CH 3
Reacciones con ácidos nucleicos
El sulfato de dimetilo (DMS) se utiliza para determinar la estructura secundaria del ARN . A pH neutro, el DMS metila los residuos de adenina y citosina desapareados en sus caras Watson-Crick canónicas, pero no puede metilar los nucleótidos con pares de bases. Utilizando el método conocido como DMS-MaPseq , [16] el ARN se incuba con DMS para metilar las bases desapareadas. Luego, el ARN se transcribe de forma inversa; la transcriptasa inversa con frecuencia agrega una base de ADN incorrecta cuando encuentra una base de ARN metilada. Estas mutaciones se pueden detectar mediante secuenciación , y se infiere que el ARN es monocatenario en bases con tasas de mutación superiores a las de fondo.
El sulfato de dimetilo puede efectuar la escisión específica de bases del ADN al atacar los anillos de imidazol presentes en la guanina. [17] El sulfato de dimetilo también metila la adenina en porciones monocatenarias del ADN (por ejemplo, aquellas con proteínas como la ARN polimerasa que se funden progresivamente y vuelven a hibridar el ADN). Al volver a hibridar, estos grupos metilo interfieren con el apareamiento de bases adenina-guanina. La nucleasa S1 puede entonces utilizarse para cortar el ADN en regiones monocatenarias (en cualquier lugar con una adenina metilada). Esta es una técnica importante para analizar las interacciones proteína-ADN.
Alternativas
Aunque el sulfato de dimetilo es muy eficaz y asequible, su toxicidad ha fomentado el uso de otros reactivos de metilación. El yoduro de metilo es un reactivo utilizado para la O-metilación, como el sulfato de dimetilo, pero es menos peligroso y más caro. [15] El carbonato de dimetilo , que es mucho menos reactivo, tiene una toxicidad mucho menor en comparación con el sulfato de dimetilo y el yoduro de metilo. [18] Se puede utilizar alta presión para acelerar la metilación mediante carbonato de dimetilo. En general, la toxicidad de los agentes de metilación está correlacionada con su eficiencia como reactivos de transferencia de metilo.
Seguridad
El sulfato de dimetilo es cancerígeno [19] y mutagénico , altamente venenoso , corrosivo y peligroso para el medio ambiente . [20] Se absorbe a través de la piel, las membranas mucosas y el tracto gastrointestinal, y puede causar una reacción letal del tracto respiratorio retardado. También es común una reacción ocular. No hay un olor fuerte ni irritación inmediata que advierta de una concentración letal en el aire. La LD 50 (aguda, oral) es de 205 mg/kg (rata) y 140 mg/kg (ratón), y la LC 50 (aguda) es de 45 ppm por 4 horas (rata). [21] La presión de vapor de 65 Pa [22] es suficientemente grande para producir una concentración letal en el aire por evaporación a 20 °C. La toxicidad retardada permite que se produzcan exposiciones potencialmente fatales antes del desarrollo de cualquier síntoma de advertencia. [20] Los síntomas pueden retrasarse de 6 a 24 h. Se pueden utilizar soluciones concentradas de bases (amoniaco, álcalis) para hidrolizar derrames y residuos menores en equipos contaminados, pero la reacción puede volverse violenta con cantidades mayores de sulfato de dimetilo (véase ICSC). Aunque el compuesto se hidroliza, no se puede suponer que el tratamiento con agua lo descontaminará.
Una hipótesis sobre el aparentemente misterioso incidente de la "dama tóxica" de 1994 es que la persona en el centro del incidente había acumulado cristales de dimetilsulfona en su sangre, que se convirtieron por un mecanismo desconocido en vapor de dimetilsulfato que envenenó al personal médico que lo atendió. [23] [24]
Referencias
- ^ abcdef Guía de bolsillo del NIOSH sobre peligros químicos. "#0229". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab "Sulfato de dimetilo". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab Weisenberger, Karl; Mayer, Dieter; Sandler, Stanley R. (2000). "Sulfatos de dialquilo y ácidos alquilsulfúricos". Ullmann's Encyclopedia of Industrial Chemistry . doi :10.1002/14356007.a08_493. ISBN 978-3-527-30385-4.
- ^ Dumas, J.; Péligot, E. (1835). "Mémoire sur l'esprit de bois et sur les divers composés ethérés qui en proviennent" [Memoria sobre el alcohol de madera [es decir, el metanol] y sobre diversos compuestos etéreos que se derivan de él]. Annales de Chimie et de Physique . 2da serie (en francés). 58 : 5–74.
- ^ Claesson, Pedro (1879). "Ueber die neutralen und sauren Sulfate des Mmethyl- und Aethylalkohols" [Sobre los sulfatos neutros y ácidos del alcohol metílico y etílico]. Revista para la química práctica . 2da serie (en alemán). 19 : 231–265. doi :10.1002/prac.18790190123.
- ^ ab Suter, CM (1944). La química orgánica del azufre: sustancias azufradas tetracovalentes . John Wiley & Sons. págs. 49–53. LCCN 44001248.
- ^ "Sulfato de dimetilo 77-78-1". EPA.
- ^ "Datos sobre venenos: Sustancias químicas de bajo nivel: sulfato de dimetilo". Hospital de la Universidad de Kansas.
- ^ Sartori, Mario (1939). Los gases de guerra . D. Van Nostrand. pp. 262, 266.
- ^ Dumas, J.; Péligot, E. (1835). "Mémoire sur l'esprit de bois et sur les divers composés ethérés qui en proviennent" [Memoria sobre el alcohol de madera [es decir, el metanol] y sobre diversos compuestos etéreos que se derivan de él]. Annales de Chimie et de Physique . 2da serie (en francés). 58 : 5–74.
- ^ Shirley, DA (1966). Química orgánica . Holt, Rinehart y Winston. pág. 253. LCCN 64010030.
- ^ GS Hiers, FD Hager (1929). "Anisol". Síntesis orgánicas . 9 : 12. doi : 10.15227/orgsyn.009.0012.
- ^ abc «Información sobre productos Dupont». Archivado desde el original el 19 de noviembre de 2008. Consultado el 8 de mayo de 2006 .
- ^ WN Haworth (1915). "III. Un nuevo método para preparar azúcares alquilados". Journal of the Chemical Society, Transactions . 107 : 8–16. doi :10.1039/CT9150700008.
- ^ ab Fieser, LF; Fieser, M. (1967). Reactivos para Síntesis Orgánica . John Wiley e hijos. pag. 295.ISBN 9780471258759.
- ^ Zubradt, Meghan; Gupta, Paromita; Persad, Sitara; Lambowitz, Alan; Weissman, Jonathan; Rouskin, Silvi (2017). "DMS-MaPseq para el sondeo in vivo de la estructura del ARN en todo el genoma o dirigido". Nature Methods . 14 (1): 75–82. doi :10.1038/nmeth.4057. PMC 5508988 . PMID 27819661.
- ^ Streitwieser, A.; Heathcock, CH ; Kosower, EM (1992). Introducción a la química orgánica (4.ª ed.). Macmillan. pág. 1169. ISBN 978-0024181701.
- ^ Shieh, WC; Dell, S.; Repic, O. (2001). "1,8-Diazabiciclo[5.4.0]undec-7-eno (DBU) y química verde acelerada por microondas en la metilación de fenoles, indoles y benzimidazoles con carbonato de dimetilo". Organic Letters . 3 (26): 4279–4281. doi :10.1021/ol016949n. PMID 11784197.
- ^ "Dimetilsulfato CAS No. 77-78-1" (PDF) . 12.º Informe sobre carcinógenos (RoC). Departamento de Salud y Servicios Humanos de los Estados Unidos . 2011.
- ^ ab Rippey, JCR; Stallwood, MI (2005). "Nueve casos de exposición accidental al sulfato de dimetilo: un arma química potencial". Emergency Medicine Journal . 22 (12): 878–879. doi :10.1136/emj.2004.015800. PMC 1726642 . PMID 16299199.
- ^ "Hoja de datos de seguridad del material - Sulfato de dimetilo MSDS". ScienceLab. Archivado desde el original el 2012-04-06 . Consultado el 2011-10-02 .
- ^ CAPI
- ^ "¿Cuál es la historia de la "dama tóxica"?". The Straight Dope . 1996-03-22 . Consultado el 2024-01-15 .
- ^ Grant, PM; Haas, JS; Whipple, RE; Andresen, BD (23 de junio de 1997). "Una posible explicación química de los eventos asociados con la muerte de Gloria Ramírez en el Riverside General Hospital". Forensic Science International . 87 (3): 219–237. doi :10.1016/s0379-0738(97)00076-5. ISSN 0379-0738. PMID 9248041.
Enlaces externos
- Página web del libro C2H6SO4
- Química internacional



