Iridio
El iridio es un elemento químico ; su símbolo es Ir y su número atómico es 77. Es un metal de transición muy duro, quebradizo y de color blanco plateado del grupo del platino , considerado el segundo metal más denso que se encuentra en la naturaleza (después del osmio ) con una densidad de 22,56 g/cm 3 (0,815 lb/cu in) [9] según lo definido por cristalografía experimental de rayos X. [a] 191 Ir y 193 Ir son los únicos dos isótopos naturales del iridio, así como los únicos isótopos estables ; este último es el más abundante. Es uno de los metales más resistentes a la corrosión , [12] incluso a temperaturas de hasta 2000 °C (3630 °F).
El iridio fue descubierto en 1803 en los residuos insolubles en ácido de los minerales de platino por el químico inglés Smithson Tennant . El nombre iridio , derivado de la palabra griega iris (arcoíris), se refiere a los diversos colores de sus compuestos. El iridio es uno de los elementos más raros de la corteza terrestre , con una producción anual estimada de solo 6.800 kilogramos (15.000 lb) en 2023. [13]
Los usos dominantes del iridio son el propio metal y sus aleaciones, como en bujías de alto rendimiento , crisoles para la recristalización de semiconductores a altas temperaturas y electrodos para la producción de cloro en el proceso cloro-álcali . Compuestos importantes del iridio son los cloruros y yoduros en la catálisis industrial . El iridio es un componente de algunos OLED .
El iridio se encuentra en meteoritos en una abundancia mucho mayor que en la corteza terrestre. [14] Por esta razón, la abundancia inusualmente alta de iridio en la capa de arcilla en el límite Cretácico-Paleógeno dio lugar a la hipótesis de Álvarez de que el impacto de un objeto extraterrestre masivo causó la extinción de los dinosaurios no aviares y muchas otras especies hace 66 millones de años , que ahora se sabe que se produjo por el impacto que formó el cráter de Chicxulub . De manera similar, una anomalía de iridio en muestras de núcleos del Océano Pacífico sugirió el impacto de Eltanin de hace unos 2,5 millones de años. [15]
Características
Propiedades físicas

El iridio, un metal perteneciente al grupo del platino , es blanco, parecido al platino, pero con un ligero tono amarillento. Debido a su dureza, fragilidad y punto de fusión muy alto , el iridio sólido es difícil de mecanizar, moldear o trabajar; por lo tanto, en su lugar se emplea comúnmente la pulvimetalurgia . [16] Es el único metal que mantiene buenas propiedades mecánicas en el aire a temperaturas superiores a 1600 °C (2910 °F). [17] Tiene el décimo punto de ebullición más alto entre todos los elementos y se convierte en un superconductor a temperaturas inferiores a 0,14 K (−273,010 °C; −459,418 °F). [18]
El módulo de elasticidad del iridio es el segundo más alto entre los metales, superado únicamente por el osmio . [17] Esto, junto con un alto módulo de corte y una cifra muy baja para el coeficiente de Poisson (la relación entre la deformación longitudinal y lateral ), indican el alto grado de rigidez y resistencia a la deformación que han hecho que su fabricación en componentes útiles sea una cuestión de gran dificultad. A pesar de estas limitaciones y del alto coste del iridio, se han desarrollado varias aplicaciones en las que la resistencia mecánica es un factor esencial en algunas de las condiciones extremadamente severas que se encuentran en la tecnología moderna. [17]
La densidad medida del iridio es sólo ligeramente inferior (en alrededor de 0,12%) a la del osmio, el metal más denso conocido. [19] [20] Se produjo cierta ambigüedad con respecto a cuál de los dos elementos era más denso, debido al pequeño tamaño de la diferencia de densidad y las dificultades para medirla con precisión, [21] pero, con una mayor precisión en los factores utilizados para calcular la densidad, los datos cristalográficos de rayos X arrojaron densidades de 22,56 g/cm 3 (0,815 lb/cu in) para el iridio y 22,59 g/cm 3 (0,816 lb/cu in) para el osmio. [22]
El iridio es extremadamente frágil, hasta el punto de ser difícil de soldar porque la zona afectada por el calor se agrieta, pero se puede hacer más dúctil mediante la adición de pequeñas cantidades de titanio y circonio (el 0,2% de cada uno aparentemente funciona bien). [23]
La dureza Vickers del platino puro es de 56 HV, mientras que el platino con un 50% de iridio puede alcanzar más de 500 HV. [24] [25]
Propiedades químicas
El iridio es el metal más resistente a la corrosión conocido. [26] No es atacado por ácidos , incluyendo el agua regia , pero puede disolverse en ácido clorhídrico concentrado en presencia de perclorato de sodio. [13] En presencia de oxígeno , reacciona con sales de cianuro . [27] Los oxidantes tradicionales también reaccionan, incluyendo los halógenos y el oxígeno [28] a temperaturas más altas. [29] El iridio también reacciona directamente con azufre a presión atmosférica para producir disulfuro de iridio . [30]
Isótopos
El iridio tiene dos isótopos estables naturales , 191 Ir y 193 Ir, con abundancias naturales de 37,3% y 62,7%, respectivamente. [31] También se han sintetizado al menos 37 radioisótopos , cuyo número másico varía de 164 a 202. 192 Ir , que se encuentra entre los dos isótopos estables, es el radioisótopo más estable , con una vida media de 73,827 días, y encuentra aplicación en braquiterapia [32] y en radiografía industrial , particularmente para pruebas no destructivas de soldaduras en acero en las industrias del petróleo y el gas; las fuentes de iridio-192 han estado involucradas en varios accidentes radiológicos. Otros tres isótopos tienen vidas medias de al menos un día: 188 Ir, 189 Ir y 190 Ir. [31] Los isótopos con masas inferiores a 191 se desintegran mediante una combinación de desintegración β + , desintegración α y (rara) emisión de protones , con la excepción del 189 Ir, que se desintegra por captura de electrones . Los isótopos sintéticos más pesados que el 191 se desintegran mediante desintegración β- , aunque el 192 Ir también tiene una ruta de desintegración por captura de electrones menor. [31] Todos los isótopos conocidos del iridio se descubrieron entre 1934 y 2008, siendo los descubrimientos más recientes el 200-202 Ir. [33]
Se han caracterizado al menos 32 isómeros metaestables , cuyo número de masa oscila entre 164 y 197. El más estable de ellos es el 192m2 Ir, que se desintegra por transición isomérica con una vida media de 241 años, [31] lo que lo hace más estable que cualquiera de los isótopos sintéticos del iridio en sus estados fundamentales. El isómero menos estable es el 190m3 Ir con una vida media de solo 2 μs. [31] El isótopo 191 Ir fue el primero de cualquier elemento en el que se demostró que presentaba un efecto Mössbauer . Esto lo hace útil para la espectroscopia Mössbauer para la investigación en física, química, bioquímica , metalurgia y mineralogía . [34]
Química
| Estados de oxidación [b] | |
|---|---|
| -3 | [Ir(CO2)] 3]3− |
| -1 | [Ir(CO) 3 (PPh3 ) ] 1− |
| 0 | Ir 4 (CO) 12 |
| +1 | [IrCl(CO)( PPh3 ) 2 ] |
| +2 | Ir ( C5H5 ) 2 |
| +3 | IrCl3 |
| +4 | IrO2 |
| +5 | Ir 4 F 20 |
| +6 | IRF 6 |
| +7 | [Ir( O2 ) O2 ] + |
| +8 | IrO4 |
| +9 | [IrO 4 ] + [5] |
Estados de oxidación
El iridio forma compuestos en estados de oxidación entre −3 y +9, pero los estados de oxidación más comunes son +1, +2, +3 y +4. [16] Los compuestos bien caracterizados que contienen iridio en el estado de oxidación +6 incluyen IrF 6 y los óxidos Sr 2 MgIrO 6 y Sr 2 CaIrO 6 . [16] [35] El óxido de iridio (VIII) ( IrO 4 ) se generó en condiciones de aislamiento de matriz a 6 K en argón . [36] El estado de oxidación más alto (+9), que también es el más alto registrado para cualquier elemento, se encuentra en [IrO 4 ] + gaseoso . [5]
Compuestos binarios
El iridio no forma hidruros binarios . Sólo un óxido binario está bien caracterizado: el dióxido de iridio , IrO
2Es un sólido negro azulado que adopta la estructura de fluorita . [16] Un sesquióxido , Ir
2Oh
3, se ha descrito como un polvo azul-negro, que se oxida a IrO
2por HNO
3. [28] Se conocen los disulfuros , diselenuros , sesquisulfuros y sesquiselenuros correspondientes , así como IrS
3. [16]
Trihaluros binarios, IrX
3, son conocidos para todos los halógenos. [16] Para los estados de oxidación +4 y superiores, solo se conocen el tetrafluoruro , el pentafluoruro y el hexafluoruro . [16] Hexafluoruro de iridio, IrF
6, es un sólido volátil de color amarillo, compuesto de moléculas octaédricas. Se descompone en agua y se reduce a IrF
4. [16] El pentafluoruro de iridio también es un oxidante fuerte, pero es un tetrámero , Ir
4F
20, formado por cuatro octaedros que comparten vértices. [16]
Complejos
x.jpg/440px-IrCl3(aq)x.jpg)
El iridio tiene una química de coordinación extensa .
El iridio en sus complejos siempre tiene espín bajo . Ir(III) e Ir(IV) generalmente forman complejos octaédricos . [16] Los complejos de polihidruro son conocidos por los estados de oxidación +5 y +3. [37] Un ejemplo es IrH 5 (P i Pr 3 ) 2 ( i Pr = isopropilo ). [38] El hidruro ternario Mg
6Ir
2yo
11Se cree que contiene tanto IrH4−
5y el IrH de 18 electrones5−
4anión. [39]
El iridio también forma oxianiones con estados de oxidación +4 y +5 .
2IrO
3y KIrO
3Se pueden preparar a partir de la reacción de óxido de potasio o superóxido de potasio con iridio a altas temperaturas. Estos sólidos no son solubles en disolventes convencionales. [40]
Al igual que muchos elementos, el iridio forma importantes complejos de cloruro. Ácido hexacloroiridínico (IV), H
2IrCl
6, y su sal de amonio son compuestos de iridio comunes tanto desde una perspectiva industrial como preparativa. [41] Son intermediarios en la purificación del iridio y se utilizan como precursores de la mayoría de los demás compuestos de iridio, así como en la preparación de revestimientos de ánodos . El IrCl2−
6El ion tiene un color marrón oscuro intenso y se puede reducir fácilmente al IrCl de color más claro.3−
6y viceversa. [41] Tricloruro de iridio , IrCl
3, que se puede obtener en forma anhidra a partir de la oxidación directa del polvo de iridio con cloro a 650 °C, [41] o en forma hidratada disolviendo Ir
2Oh
3En ácido clorhídrico , se utiliza a menudo como material de partida para la síntesis de otros compuestos de Ir(III). [16] Otro compuesto utilizado como material de partida es el hexacloroiridato de potasio (III), K 3 IrCl 6 . [42]
Química del organoiridio

Los compuestos de organoiridio contienen enlaces iridio- carbono . Los primeros estudios identificaron el tetrairidio dodecacarbonilo , muy estable , Ir
4(CO)
12. [16] En este compuesto, cada uno de los átomos de iridio está unido a los otros tres, formando un grupo tetraédrico . El descubrimiento del complejo de Vaska ( IrCl(CO)[P(C
6yo
5)
3]
2) abrió la puerta a las reacciones de adición oxidativa , un proceso fundamental para reacciones útiles. Por ejemplo, el catalizador de Crabtree , un catalizador homogéneo para reacciones de hidrogenación . [43] [44]

Los complejos de iridio desempeñaron un papel fundamental en el desarrollo de la activación del enlace carbono-hidrógeno (activación C–H), que promete permitir la funcionalización de hidrocarburos , que tradicionalmente se consideran no reactivos . [47]
Historia
Grupo platino

El descubrimiento del iridio está entrelazado con el del platino y los demás metales del grupo del platino . La primera referencia europea al platino aparece en 1557 en los escritos del humanista italiano Julio César Scaliger como descripción de un metal noble desconocido encontrado entre Darién y México, "que ningún fuego ni ningún artificio español ha podido licuar todavía ". [48] Desde sus primeros encuentros con el platino, los españoles generalmente vieron al metal como una especie de impureza en el oro, y lo trataron como tal. A menudo simplemente se tiraba a la basura, y había un decreto oficial que prohibía la adulteración del oro con impurezas de platino. [49]


En 1735, Antonio de Ulloa y Jorge Juan y Santacilia vieron a los nativos americanos extrayendo platino mientras los españoles viajaban por Colombia y Perú durante ocho años. Ulloa y Juan encontraron minas con pepitas de metal blanquecino y las llevaron a España. Ulloa regresó a España y estableció el primer laboratorio de mineralogía en España y fue el primero en estudiar sistemáticamente el platino, lo que fue en 1748. Su relato histórico de la expedición incluyó una descripción del platino como no separable ni calcinable . Ulloa también anticipó el descubrimiento de minas de platino. Después de publicar el informe en 1748, Ulloa no continuó investigando el nuevo metal. En 1758, fue enviado a supervisar las operaciones de extracción de mercurio en Huancavelica . [48]
En 1741, Charles Wood, [50] un metalúrgico británico , encontró varias muestras de platino colombiano en Jamaica, que envió a William Brownrigg para una mayor investigación.
En 1750, después de estudiar el platino que le envió Wood, Brownrigg presentó un relato detallado del metal a la Royal Society , afirmando que no había visto mención de él en ningún relato previo de minerales conocidos. [51] Brownrigg también tomó nota del punto de fusión extremadamente alto del platino y su comportamiento refractario similar al de un metal frente al bórax . Otros químicos de toda Europa pronto comenzaron a estudiar el platino, incluidos Andreas Sigismund Marggraf , [52] Torbern Bergman , Jöns Jakob Berzelius , William Lewis y Pierre Macquer . En 1752, Henrik Scheffer publicó una descripción científica detallada del metal, al que se refirió como "oro blanco", incluyendo un relato de cómo logró fusionar el mineral de platino con la ayuda de arsénico . Scheffer describió el platino como menos flexible que el oro, pero con una resistencia similar a la corrosión . [48]
Descubrimiento
Los químicos que estudiaron el platino lo disolvieron en agua regia (una mezcla de ácidos clorhídrico y nítrico ) para crear sales solubles . Siempre observaron una pequeña cantidad de un residuo oscuro e insoluble . [17] Joseph Louis Proust pensó que el residuo era grafito . [17] Los químicos franceses Victor Collet-Descotils , Antoine François, conde de Fourcroy , y Louis Nicolas Vauquelin también observaron el residuo negro en 1803, pero no obtuvieron suficiente para realizar experimentos posteriores. [17]
En 1803, el científico británico Smithson Tennant (1761-1815) analizó el residuo insoluble y concluyó que debía contener un nuevo metal. Vauquelin trató el polvo alternativamente con álcali y ácidos [26] y obtuvo un nuevo óxido volátil, que creyó que era de este nuevo metal, al que llamó pteno , de la palabra griega πτηνός ptēnós , " alado ". [53] [54] Tennant, que tenía la ventaja de una cantidad mucho mayor de residuo, continuó su investigación e identificó los dos elementos previamente no descubiertos en el residuo negro, iridio y osmio . [17] [26] Obtuvo cristales de color rojo oscuro (probablemente de Na
2[IrCl
6]· n H
2O ) mediante una secuencia de reacciones con hidróxido de sodio y ácido clorhídrico . [54] Nombró al iridio en honor a Iris ( Ἶρις ), la diosa griega alada del arco iris y mensajera de los dioses olímpicos , porque muchas de las sales que obtuvo estaban fuertemente coloreadas. [c] [55] El descubrimiento de los nuevos elementos fue documentado en una carta a la Royal Society el 21 de junio de 1804. [17] [56]
Metalmecánica y aplicaciones
El científico británico John George Children fue el primero en fundir una muestra de iridio en 1813 con la ayuda de "la batería galvánica más grande que jamás se haya construido" (en ese momento). [17] El primero en obtener iridio de alta pureza fue Robert Hare en 1842. Encontró que tenía una densidad de alrededor de 21,8 g/cm 3 (0,79 lb/cu in) y observó que el metal es casi inmaleable y muy duro. La primera fusión en cantidad apreciable fue realizada por Henri Sainte-Claire Deville y Jules Henri Debray en 1860. Necesitaron quemar más de 300 litros (79 galones estadounidenses) de O puro.
2y H
2gas por cada kilogramo (2,2 libras) de iridio. [17]
Estas dificultades extremas para fundir el metal limitaron las posibilidades de manipulación del iridio. John Isaac Hawkins buscaba obtener una punta fina y dura para las plumillas de las estilográficas , y en 1834 logró crear una pluma de oro con punta de iridio. En 1880, John Holland y William Lofland Dudley lograron fundir el iridio añadiendo fósforo y patentaron el proceso en los Estados Unidos; la empresa británica Johnson Matthey declaró más tarde que habían estado utilizando un proceso similar desde 1837 y que ya habían presentado iridio fundido en varias ferias mundiales . [17] El primer uso de una aleación de iridio con rutenio en termopares lo realizó Otto Feussner en 1933. Estos permitieron la medición de altas temperaturas en el aire de hasta 2000 °C (3630 °F). [17]
En Munich , Alemania, en 1957, Rudolf Mössbauer , en lo que se ha llamado uno de los "experimentos históricos en la física del siglo XX", [57] descubrió la emisión y absorción resonante y sin retroceso de rayos gamma por átomos en una muestra de metal sólido que contenía solo 191 Ir. [58] Este fenómeno, conocido como el efecto Mössbauer, resultó en la concesión del Premio Nobel de Física en 1961, a la edad de 32 años, solo tres años después de que publicara su descubrimiento. [59]
Aparición
Junto con muchos elementos que tienen pesos atómicos superiores al del hierro, el iridio solo se forma naturalmente mediante el proceso r (captura rápida de neutrones ) en fusiones de estrellas de neutrones y posiblemente en tipos raros de supernovas. [60] [61] [62]
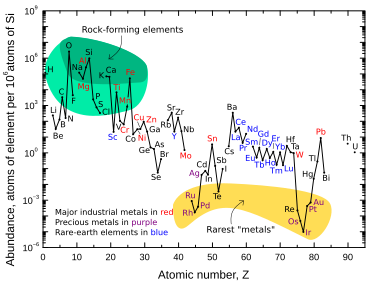

El iridio es uno de los nueve elementos estables menos abundantes en la corteza terrestre , con una fracción de masa promedio de 0,001 ppm en la roca de la corteza; el oro es 4 veces más abundante, el platino es 10 veces más abundante, la plata y el mercurio son 80 veces más abundantes. [16] El osmio , el telurio , el rutenio , el rodio y el renio son casi tan abundantes como el iridio. [64] En contraste con su baja abundancia en la roca de la corteza, el iridio es relativamente común en los meteoritos , con concentraciones de 0,5 ppm o más. [65] Se cree que la concentración general de iridio en la Tierra es mucho mayor que la observada en las rocas de la corteza, pero debido a la densidad y al carácter siderófilo ("amante del hierro") del iridio, descendió por debajo de la corteza y hacia el núcleo de la Tierra cuando el planeta todavía estaba fundido . [41]
El iridio se encuentra en la naturaleza como un elemento no combinado o en aleaciones naturales , especialmente las aleaciones de iridio- osmio osmiridio (rico en osmio) e iridosmio (rico en iridio). [26] En los depósitos de níquel y cobre, los metales del grupo del platino se presentan como sulfuros , telururos , antimonuros y arseniuros . En todos estos compuestos, el platino se puede intercambiar con una pequeña cantidad de iridio u osmio. Al igual que con todos los metales del grupo del platino, el iridio se puede encontrar de forma natural en aleaciones con níquel en bruto o cobre en bruto . [66] Se conocen varios minerales dominantes de iridio , con iridio como elemento formador de especies. Son extremadamente raros y a menudo representan los análogos de iridio de los mencionados anteriormente. Los ejemplos son la irarsita y la cuproiridsita, por mencionar algunos. [67] [68] [69] Dentro de la corteza terrestre, el iridio se encuentra en concentraciones más altas en tres tipos de estructuras geológicas : depósitos ígneos (intrusiones de la corteza desde abajo), cráteres de impacto y depósitos reelaborados de una de las estructuras anteriores. Las mayores reservas primarias conocidas se encuentran en el complejo ígneo Bushveld en Sudáfrica, [70] (cerca de la estructura de impacto más grande conocida, la estructura de impacto de Vredefort ) aunque los grandes depósitos de cobre y níquel cerca de Norilsk en Rusia y la cuenca de Sudbury (también un cráter de impacto) en Canadá también son fuentes importantes de iridio. Se encuentran reservas más pequeñas en los Estados Unidos. [70] El iridio también se encuentra en depósitos secundarios, combinado con platino y otros metales del grupo del platino en depósitos aluviales . Los depósitos aluviales utilizados por los pueblos precolombinos en el departamento del Chocó de Colombia siguen siendo una fuente de metales del grupo del platino. A partir de 2003, las reservas mundiales no se han estimado. [26]
Oceanografía marina
El iridio se encuentra en organismos marinos, sedimentos y la columna de agua. La abundancia de iridio en el agua de mar [71] y en organismos [72] es relativamente baja, ya que no forma fácilmente complejos de cloruro . [72] La abundancia en organismos es de aproximadamente 20 partes por billón, o aproximadamente cinco órdenes de magnitud menos que en rocas sedimentarias en el límite Cretácico-Paleógeno (K-T) . [72] La concentración de iridio en el agua de mar y en los sedimentos marinos es sensible a la oxigenación marina , la temperatura del agua de mar y varios procesos geológicos y biológicos. [73]
El iridio en sedimentos puede provenir de polvo cósmico , volcanes, precipitación de agua de mar, procesos microbianos o respiraderos hidrotermales , [73] y su abundancia puede ser fuertemente indicativa de la fuente. [74] [73] Tiende a asociarse con otros metales ferrosos en nódulos de manganeso . [71] El iridio es uno de los elementos característicos de las rocas extraterrestres y, junto con el osmio, puede usarse como elemento trazador de material meteorítico en sedimentos. [75] [76] Por ejemplo, muestras de núcleos del Océano Pacífico con niveles elevados de iridio sugirieron el impacto de Eltanin de hace unos 2,5 millones de años. [15]
Algunas de las extinciones masivas , como la del Cretácico , pueden identificarse por concentraciones anómalamente altas de iridio en los sedimentos, y estas pueden vincularse a grandes impactos de asteroides . [77]
Presencia en el límite Cretácico-Paleógeno

El límite Cretácico-Paleógeno de hace 66 millones de años, que marca la frontera temporal entre los períodos Cretácico y Paleógeno del tiempo geológico , fue identificado por un estrato delgado de arcilla rica en iridio . [78] Un equipo dirigido por Luis Álvarez propuso en 1980 un origen extraterrestre para este iridio, atribuyéndolo a un impacto de asteroide o cometa . [78] Su teoría, conocida como la hipótesis de Álvarez , ahora es ampliamente aceptada para explicar la extinción de los dinosaurios no aviares. Una gran estructura de cráter de impacto enterrada con una edad estimada de unos 66 millones de años fue identificada más tarde bajo lo que ahora es la península de Yucatán (el cráter de Chicxulub ). [79] [80] Dewey M. McLean y otros sostienen que el iridio puede haber sido de origen volcánico , porque el núcleo de la Tierra es rico en iridio y los volcanes activos como el Piton de la Fournaise , en la isla de Reunión , todavía están liberando iridio. [81] [82]
Producción
| Año | Consumo (toneladas) | Precio (US$) [83] |
|---|---|---|
| 2001 | 2.6 | $415,25/ ozt ($13,351/g) |
| 2002 | 2.5 | $294,62/ ozt ($9,472/g) |
| 2003 | 3.3 | 93,02 dólares la onza (2,991 dólares el gramo) |
| 2004 | 3.60 | $185,33/ ozt ($5,958/g) |
| 2005 | 3.86 | $169,51/ ozt ($5,450/g) |
| 2006 | 4.08 | $349,45/ ozt ($11,235/g) |
| 2007 | 3.70 | $444,43/ ozt ($14,289/g) |
| 2008 | 3.10 | $448,34/ ozt ($14,414/g) |
| 2009 | 2.52 | $420,4/ ozt ($13,52/g) |
| 2010 | 10.40 | $642,15/ ozt ($20,646/g) |
| 2011 | 9.36 | $1,035.87/ ozt ($33.304/g) |
| 2012 | 5.54 | $1,066.23/ ozt ($34.280/g) |
| 2013 | 6.16 | $826,45/ ozt ($26,571/g) |
| 2014 | 6.1 | $556,19/ ozt ($17,882/g) |
| 2015 | 7.81 | $544/ ozt ($17,5/g) |
| 2016 | 7.71 | $586,90/ ozt ($18,869/g) |
| 2017 | Dakota del Norte | 908,35 dólares la onza (29,204 dólares el gramo) |
| 2018 | Dakota del Norte | $1,293.27/ ozt ($41.580/g) |
| 2019 | Dakota del Norte | $1,485.80/ ozt ($47.770/g) |
| 2020 | Dakota del Norte | $1,633.51/ ozt ($52.519/g) |
| 2021 | Dakota del Norte | $5,400.00/ ozt ($173.614/g) |
| 2022 | Dakota del Norte | $3,980.00/ ozt ($127.960/g) |
| 2023 | Dakota del Norte | $4,652.38/ ozt ($149.577/g) |
| 2024 | Dakota del Norte | $5,000.00/ ozt ($160.754/g) |
La producción mundial de iridio fue de aproximadamente 7300 kilogramos (16 100 lb) en 2018. [84] El precio es alto y variable (ver tabla). Los factores ilustrativos que afectan el precio incluyen el exceso de oferta de crisoles de iridio [83] [85] y los cambios en la tecnología LED . [86]
Los metales de platino se presentan juntos como minerales diluidos. El iridio es uno de los metales de platino más raros: por cada 190 toneladas de platino obtenidas de los minerales, solo se aíslan 7,5 toneladas de iridio. [87] Para separar los metales, primero deben disolverse . Dos métodos para hacer solubles los minerales que contienen Ir son (i) fusión del sólido con peróxido de sodio seguida de extracción del vidrio resultante en agua regia y (ii) extracción del sólido con una mezcla de cloro con ácido clorhídrico . [41] [70] A partir de extractos solubles, el iridio se separa precipitando hexacloroiridato de amonio sólido ( (NH
4)
2IrCl
6) o extrayendo IrCl2−
6con aminas orgánicas. [88] El primer método es similar al procedimiento que Tennant y Wollaston usaron para su separación original. El segundo método puede planificarse como extracción líquido-líquido continua y, por lo tanto, es más adecuado para la producción a escala industrial. En cualquier caso, el producto, una sal de cloruro de iridio, se reduce con hidrógeno, produciendo el metal como un polvo o esponja , que es susceptible a las técnicas de pulvimetalurgia . [89] [90] El iridio también se obtiene comercialmente como un subproducto de la minería y el procesamiento de níquel y cobre. Durante la electrorrefinación de cobre y níquel, los metales nobles como la plata, el oro y los metales del grupo del platino , así como el selenio y el telurio, se depositan en el fondo de la celda como lodo anódico , que forma el punto de partida para su extracción. [83]
| País | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Mundo | 7.720 | 7,180 | 7,540 | 7.910 | 8,170 |
 Sudáfrica* Sudáfrica* | 6.624 | 6.057 | 6.357 | 6.464 | 6.786 |
 Zimbabue Zimbabue | 598 | 619 | 586 | 845 | 836 |
 Canadá* Canadá* | 300 | 200 | 400 | 300 | 300 |
 Rusia * Rusia * | 200 | 300 | 200 | 300 | 250 |
Aplicaciones
Debido a su resistencia a la corrosión, el iridio tiene aplicaciones industriales. Las principales áreas de uso son electrodos para producir cloro y otros productos corrosivos, OLED , crisoles, catalizadores (por ejemplo, ácido acético ) y puntas de encendido para bujías. [87]
Metales y aleaciones
La resistencia al calor y a la corrosión son las bases de varios usos del iridio y sus aleaciones.
Debido a su alto punto de fusión, dureza y resistencia a la corrosión , el iridio se utiliza para fabricar crisoles. Dichos crisoles se utilizan en el proceso Czochralski para producir monocristales de óxido (como zafiros ) para su uso en dispositivos de memoria de ordenador y en láseres de estado sólido. [92] [93] Los cristales, como el granate de gadolinio y galio y el granate de itrio y galio, se cultivan fundiendo cargas presinterizadas de óxidos mixtos en condiciones oxidantes a temperaturas de hasta 2100 °C (3810 °F). [17]
Algunas piezas de motores de aviones de larga duración están hechas de una aleación de iridio, y se utiliza una aleación de iridio y titanio para tuberías de aguas profundas debido a su resistencia a la corrosión. [26] El iridio se utiliza para hileras multiporosas , a través de las cuales se extruye un polímero plástico fundido para formar fibras, como el rayón . [94] El osmio-iridio se utiliza para rumbos de brújula y para balanzas. [17]
Debido a su resistencia a la erosión del arco, algunos fabricantes utilizan aleaciones de iridio para los electrodos centrales de las bujías , [92] [95] y las bujías a base de iridio se utilizan particularmente en la aviación.
Catálisis
Los compuestos de iridio se utilizan como catalizadores en el proceso Cativa para la carbonilación de metanol para producir ácido acético . [96] [97]
Los complejos de iridio suelen ser activos para la hidrogenación asimétrica tanto por hidrogenación tradicional [98] como por hidrogenación por transferencia [ 99] Esta propiedad es la base de la ruta industrial hacia el herbicida quiral (S)-metolaclor. Tal como lo practica Syngenta en una escala de 10 000 toneladas/año, el complejo [Ir(COD)Cl] 2 en presencia de ligandos de Josiphos [100] .
Imágenes médicas
El radioisótopo iridio-192 es una de las dos fuentes de energía más importantes para su uso en la radiografía γ industrial para pruebas no destructivas de metales. [101] [102] Además,192
Ir
Se utiliza como fuente de radiación gamma para el tratamiento del cáncer mediante braquiterapia , una forma de radioterapia en la que se coloca una fuente radiactiva sellada dentro o al lado del área que requiere tratamiento. Los tratamientos específicos incluyen braquiterapia de próstata de alta tasa de dosis, braquiterapia de los conductos biliares y braquiterapia intracavitaria del cuello uterino. [26] El iridio-192 se produce normalmente por activación neutrónica del isótopo iridio-191 en el metal iridio en abundancia natural. [103]
Fotocatálisis y OLED
Los complejos de iridio son componentes clave de los OLED blancos . Se utilizan complejos similares en la fotocatálisis . [104]
Científico

En 1889 se utilizó una aleación de 90% platino y 10% iridio para construir el Prototipo Internacional del Metro y la masa del kilogramo , conservados por la Oficina Internacional de Pesas y Medidas cerca de París. [26] La barra del metro fue reemplazada como definición de la unidad fundamental de longitud en 1960 por una línea en el espectro atómico del criptón , [d] [105] pero el prototipo del kilogramo siguió siendo el estándar internacional de masa hasta el 20 de mayo de 2019 , cuando el kilogramo se redefinió en términos de la constante de Planck . [106]
Histórico

Las aleaciones de iridio y osmio se utilizaron en las puntas de las plumas estilográficas . El primer uso importante del iridio fue en 1834 en las puntas montadas sobre oro. [17] A partir de 1944, la famosa pluma estilográfica Parker 51 se equipó con una punta con una aleación de rutenio e iridio (con un 3,8 % de iridio). El material de la punta de las plumas estilográficas modernas todavía se llama convencionalmente "iridio", aunque rara vez hay iridio en él; otros metales como el rutenio , el osmio y el tungsteno han ocupado su lugar. [107]
Se utilizó una aleación de iridio y platino para los orificios de ventilación de los cañones . Según un informe de la Exposición de París de 1867 , una de las piezas que Johnson y Matthey exhibieron "se ha utilizado en un cañón Whitworth durante más de 3000 disparos y apenas muestra signos de desgaste. Aquellos que conocen los problemas y gastos constantes que ocasiona el desgaste de las piezas de ventilación de los cañones cuando están en servicio activo, apreciarán esta importante adaptación". [108]
El pigmento negro de iridio , que consiste en iridio muy finamente dividido, se utiliza para pintar porcelana de un negro intenso; se decía que "todos los demás colores de negro de porcelana parecen grises a su lado". [109]
Precauciones y peligros
El iridio en forma metálica a granel no es biológicamente importante ni peligroso para la salud debido a su falta de reactividad con los tejidos; solo hay alrededor de 20 partes por billón de iridio en el tejido humano. [26] Como la mayoría de los metales, el polvo de iridio finamente dividido puede ser peligroso de manipular, ya que es irritante y puede encenderse en el aire. [70] El iridio es relativamente inocuo de otro modo, y el único efecto de la ingestión de iridio es la irritación del tracto digestivo . [110] Sin embargo, las sales solubles, como los haluros de iridio, podrían ser peligrosas debido a elementos distintos del iridio o debido al propio iridio. [32] Al mismo tiempo, la mayoría de los compuestos de iridio son insolubles, lo que dificulta la absorción en el cuerpo. [26]
Un radioisótopo del iridio,192
El iridio es peligroso, al igual que otros isótopos radiactivos. Las únicas lesiones notificadas relacionadas con el iridio se refieren a la exposición accidental a la radiación de192
Ir utilizado en braquiterapia . [32] Radiación gamma de alta energía de192
El Ir puede aumentar el riesgo de cáncer. La exposición externa puede causar quemaduras, envenenamiento por radiación y muerte. La ingestión de 192 Ir puede quemar los revestimientos del estómago y los intestinos. [111] El 192 Ir, el 192m Ir y el 194m Ir tienden a depositarse en el hígado y pueden representar riesgos para la salud tanto por la radiación gamma como por la beta . [65]
Notas
- ^ A temperatura ambiente y presión atmosférica estándar, se ha calculado que el iridio tiene una densidad de 22,65 g/cm 3 (0,818 lb/cu in), 0,04 g/cm 3 (0,0014 lb/cu in) más alta que el osmio medido de la misma manera. [10] Aun así, el valor de cristalografía de rayos X experimental se considera el más preciso y, como tal, se considera que el iridio es el segundo elemento más denso. [11]
- ^ Los estados de oxidación más comunes del iridio están en negrita. La columna de la derecha enumera un compuesto representativo para cada estado de oxidación.
- ^ Iridium significa literalmente "de arco iris".
- ^ La definición del metro fue cambiada nuevamente en 1983. Actualmente el metro se define como la distancia recorrida por la luz en el vacío durante un intervalo de tiempo de 1 ⁄ 299,792,458 de segundo.
Referencias
- ^ "Pesos atómicos estándar: iridio". CIAAW . 2017.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ abc Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ abcde Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 28. ISBN 978-0-08-037941-8.
- ^ abc Wang, Guanjun; Zhou, Mingfei; Goettel, James T.; Schrobilgen, Gary G.; Su, Jing; Li, Jun; Schlöder, Tobias; Riedel, Sebastian (2014). "Identificación de un compuesto que contiene iridio con un estado de oxidación formal de IX". Nature . 514 (7523): 475–477. Bibcode :2014Natur.514..475W. doi :10.1038/nature13795. PMID 25341786. S2CID 4463905.
- ^ Lide, DR, ed. (2005). "Susceptibilidad magnética de los elementos y compuestos inorgánicos". Manual de química y física del CRC (PDF) (86.ª ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Manual de química y física . Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN. 0-8493-0464-4.
- ^ Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ "Iridio: información, propiedades y usos del elemento | Tabla periódica". www.rsc.org . Consultado el 26 de octubre de 2023 .
- ^ Helmenstine, Anne Marie (6 de mayo de 2022). "¿Cuál es el elemento más denso de la tabla periódica?". Thoughtco.com . Consultado el 9 de octubre de 2022 .
- ^ Arblaster, JW (1989). "Recálculos de densidades de osmio e iridio basados en una revisión de los últimos datos cristalográficos". Platinum Metals Rev. 33 ( 1): 14–16. doi :10.1595/003214089X3311416. S2CID 267570193.
- ^ "Iridio (Ir) | AMERICAN ELEMENTS". American Elements: The Materials Science Company . Consultado el 22 de noviembre de 2023 .
- ^ ab "Suministro mundial de iridio en 2023". Statista . Consultado el 23 de mayo de 2024 .
- ^ Becker, Luann (2002). "Golpes repetidos" (PDF) . Scientific American . 286 (3): 77–83. Bibcode :2002SciAm.286c..76B. doi :10.1038/scientificamerican0302-76. PMID 11857903 . Consultado el 19 de enero de 2016 .
- ^ ab Kyte, Frank T.; Zhiming Zhou; John T. Wasson (1981). "Concentraciones elevadas de metales nobles en un sedimento del Plioceno tardío". Nature . 292 (5822): 417–420. Bibcode :1981Natur.292..417K. doi :10.1038/292417a0. ISSN 0028-0836. S2CID 4362591.
- ^ abcdefghijklm Greenwood, NN; Earnshaw, A. (1997). Química de los elementos (2.ª ed.). Oxford: Butterworth–Heinemann. págs. 1113–1143, 1294. ISBN 978-0-7506-3365-9.OCLC 213025882 .
- ^ abcdefghijklmno Hunt, LB (1987). "Una historia del iridio". Platinum Metals Review . 31 (1): 32–41. doi :10.1595/003214087X3113241. S2CID 267552692. Archivado desde el original el 29 de septiembre de 2022 . Consultado el 29 de septiembre de 2022 .
- ^ Kittel, C. (2004). Introducción a la física del estado sólido (7.ª ed.). Wiley-India. ISBN 978-81-265-1045-0.
- ^ Arblaster, JW (1995). "Osmio, el metal más denso conocido". Platinum Metals Review . 39 (4): 164. doi :10.1595/003214095X394164164. S2CID 267393021. Archivado desde el original el 27 de septiembre de 2011. Consultado el 2 de octubre de 2008 .
- ^ Cotton, Simon (1997). Química de los metales preciosos . Springer-Verlag New York, LLC. pág. 78. ISBN 978-0-7514-0413-5.
- ^ Lide, DR (1990). Manual de química y física del CRC (70.ª edición). Boca Raton (FL): CRC Press. ISBN 9780849304712.
- ^ Arblaster, JW (1989). "Densidades de osmio e iridio: nuevos cálculos basados en una revisión de los últimos datos cristalográficos" (PDF) . Platinum Metals Review . 33 (1): 14–16. doi :10.1595/003214089X3311416. S2CID 267570193. Archivado desde el original el 2012-02-07 . Consultado el 2008-09-17 .
- ^ US 3293031A, Cresswell, Peter y Rhys, David, publicado el 20/12/1966
- ^ Darling, AS (1960). "Aleaciones de iridio y platino: una revisión crítica de su constitución y propiedades". Platinum Metals Review . 4 (1): 18–26. doi :10.1595/003214060X411826. S2CID 267392937.Reseñado en "Aleaciones de iridio y platino". Nature . 186 (4720): 211. 1960. Bibcode :1960Natur.186Q.211.. doi : 10.1038/186211a0 . S2CID 4211238.
- ^ Biggs, T.; Taylor, SS; van der Lingen, E. (2005). "El endurecimiento de aleaciones de platino para aplicaciones potenciales en joyería". Platinum Metals Review . 49 (1): 2–15. doi : 10.1595/147106705X24409 .
- ^ abcdefghij Emsley, J. (2003). "Iridium". Los elementos básicos de la naturaleza: una guía de la A a la Z de los elementos . Oxford, Inglaterra, Reino Unido: Oxford University Press . pp. 201–204. ISBN 978-0-19-850340-8.
- ^ Emsley, John (2011). Los elementos básicos de la naturaleza: una guía de la A a la Z de los elementos (nueva edición). Nueva York: Oxford University Press. ISBN 978-0-19-960563-7.
- ^ ab Perry, DL (1995). Manual de compuestos inorgánicos . CRC Press. págs. 203-204. ISBN 978-1439814611.
- ^ Lagowski, JJ, ed. (2004). Fundamentos y aplicaciones de la química. Vol. 2. Thomson Gale. págs. 250–251. ISBN 978-0028657233.
- ^ Munson, Ronald A. (febrero de 1968). "La síntesis de disulfuro de iridio y diarseniuro de níquel con estructura de pirita" (PDF) . Química inorgánica . 7 (2): 389–390. doi :10.1021/ic50060a047. Archivado desde el original (PDF) el 2019-04-12 . Consultado el 2019-01-19 .
- ^ abcde Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "La evaluación NUBASE de las propiedades nucleares y de desintegración", Nuclear Physics A , 729 : 3–128, Bibcode :2003NuPhA.729....3A, doi :10.1016/j.nuclphysa.2003.11. 001
- ^ abc Mager Stellman, J. (1998). "Iridium". Enciclopedia de salud y seguridad en el trabajo. Organización Internacional del Trabajo. pp. 63.19. ISBN 978-92-2-109816-4.OCLC 35279504 .
- ^ Robinson, R.; Thoennessen, M. (2012). "Descubrimiento de isótopos de tantalio, renio, osmio e iridio". Tablas de datos atómicos y datos nucleares . 98 (5): 911–932. arXiv : 1109.0526 . Código Bibliográfico :2012ADNDT..98..911R. doi :10.1016/j.adt.2011.09.003. S2CID 53992437.
- ^ Chereminisoff, NP (1990). Manual de cerámica y materiales compuestos . CRC Press. pág. 424. ISBN 978-0-8247-8006-7.
- ^ Jung, D.; Demazeau, Gérard (1995). "Alta presión de oxígeno y preparación de nuevos óxidos de iridio (VI) con estructura de perovskita: Sr
2MirarO
6(M = Ca, Mg)". Revista de química del estado sólido . 115 (2): 447–455. Código Bibliográfico :1995JSSCh.115..447J. doi :10.1006/jssc.1995.1158. - ^ Gong, Y.; Zhou, M.; Kaupp, M.; Riedel, S. (2009). "Formación y caracterización de la molécula de tetróxido de iridio con iridio en el estado de oxidación +VIII". Angewandte Chemie International Edition . 48 (42): 7879–7883. doi :10.1002/anie.200902733. PMID 19593837.
- ^ Holleman, AF; Wiberg, E.; Wiberg, N. (2001). Química inorgánica (1.ª ed.). Academic Press. ISBN 978-0-12-352651-9.OCLC 47901436 .
- ^ Esteruelas, Miguel A.; López, Ana M.; Oliván, Montserrat (2016). "Polihidruros de metales del grupo del platino: interacciones no clásicas y reacciones de activación de enlaces σ". Chemical Reviews . 116 (15): 8770–8847. doi : 10.1021/acs.chemrev.6b00080 . hdl : 10261/136216 . PMID 27268136.
- ^ Černý, R.; Joubert, J.-M.; Kohlmann, H.; Yvon, K. (2002). " mg
6Ir
2yo
11, un nuevo hidruro metálico que contiene IrH en forma de silla de montar5−
4y piramidal cuadrado IrH4−
5complejos hidruro". Revista de aleaciones y compuestos . 340 (1–2): 180–188. doi :10.1016/S0925-8388(02)00050-6. - ^ Gulliver, DJ; Levason, W. (1982). "La química del rutenio, osmio, rodio, iridio, paladio y platino en los estados de oxidación superiores". Coordination Chemistry Reviews . 46 : 1–127. doi :10.1016/0010-8545(82)85001-7.
- ^ abcde Renner, H.; Schlamp, G.; Kleinwächter, I.; Drost, E.; Lüschow, HM; Tews, P.; Panster, P.; Diehl, M.; et al. (2002). "Metales y compuestos del grupo del platino". Ullmann's Encyclopedia of Industrial Chemistry . Wiley. doi :10.1002/14356007.a21_075. ISBN 978-3527306732.
- ^ Schmidtke, Hans-Herbert (1970). "Complejos de pentaaminoiridio (III)". Síntesis inorgánicas . vol. 12. págs. 243–247. doi :10.1002/9780470132432.ch42. ISBN 978-0-470-13171-8.
- ^ Crabtree, RH (1979). "Compuestos de iridio en catálisis". Accounts of Chemical Research . 12 (9): 331–337. doi :10.1021/ar50141a005.
- ^ Crabtree, RH (2005). La química organometálica de los metales de transición (PDF) . Wiley. ISBN 978-0471662563. OCLC 224478241. Archivado desde el original (PDF) el 19 de noviembre de 2012.
- ^ Janowicz, AH; Bergman, RG (1982). "Activación carbono-hidrógeno en hidrocarburos completamente saturados: observación directa de M + RH → M(R)(H)". Revista de la Sociedad Química Americana . 104 (1): 352–354. doi :10.1021/ja00365a091.
- ^ Hoyano, JK; Graham, WAG (1982). "Adición oxidativa de los enlaces carbono-hidrógeno de neopentano y ciclohexano a un complejo de iridio(I) generado fotoquímicamente". Journal of the American Chemical Society . 104 (13): 3723–3725. doi :10.1021/ja00377a032.
- ^ Hartwig, John F. (2011). "Regioselectividad de la borilación de alcanos y arenos". Chemical Society Reviews . 40 (4): 1992–2002. doi :10.1039/c0cs00156b. PMID 21336364.
- ^ abc Weeks, Mary Elvira (1932). "El descubrimiento de los elementos. VIII. Los metales del platino". Revista de Educación Química . 9 (6). Sociedad Química Americana (ACS): 1017–1034. Código Bibliográfico :1932JChEd...9.1017W. doi :10.1021/ed009p1017. ISSN 0021-9584.Weeks, ME (1968). Descubrimiento de los elementos (7.ª ed.). Revista de educación química. Págs. 385–407. ISBN 978-0-8486-8579-9.OCLC 23991202 .
- ^ Donald McDonald, Leslie B. Hunt (1982). Una historia del platino y sus metales afines . Johnson Matthey Plc. págs. 7-8. ISBN 978-0-905118-83-3.
- ^ Dixon, Joshua; Brownrigg, William (1801). La vida literaria de William Brownrigg. A la que se añade un relato de las minas de carbón cerca de Whitehaven: y Observaciones sobre los medios para prevenir las fiebres epidémicas. pág. 52. Archivado desde el original el 24 de marzo de 2017.
- ^ Watson, Wm; Brownrigg, William (1749). "Varios artículos sobre un nuevo semimetal, llamado platina; comunicados a la Royal Society por el Sr. Wm. Watson FR S". Philosophical Transactions . 46 (491–496): 584–596. Bibcode :1749RSPT...46..584W. doi : 10.1098/rstl.1749.0110 . S2CID 186213277.
- ^ Marggraf, Andreas Segismundo (1760). Versuche mit dem neuen mineralischen Körper Platina del pinto genannt. Archivado desde el original el 24 de marzo de 2017.
- ^ Thomson, T. (1831). Un sistema de química de cuerpos inorgánicos. Vol. 1. Baldwin & Cradock, Londres; y William Blackwood, Edimburgo. pág. 693.
- ^ ab Griffith, WP (2004). "Bicentenario de cuatro metales del grupo del platino. Parte II: Osmio e iridio: acontecimientos relacionados con sus descubrimientos". Platinum Metals Review . 48 (4): 182–189. doi : 10.1595/147106704x4844 .
- ^ Weeks, ME (1968). Descubrimiento de los elementos (7.ª ed.). Revista de educación química. pp. 414–418. ISBN 978-0-8486-8579-9.OCLC 23991202 .
- ^ Tennant, S. (1804). "Sobre dos metales que se encuentran en el polvo negro que queda después de la disolución de platino". Philosophical Transactions of the Royal Society of London . 94 : 411–418. doi : 10.1098/rstl.1804.0018 . JSTOR 107152.
- ^ Trigg, GL (1995). "Emisión y absorción de radiación sin retroceso". Experimentos emblemáticos en la física del siglo XX. Courier Dover Publications. págs. 179-190. ISBN 978-0-486-28526-9.OCLC 31409781 .
- ^ Mössbauer, RL (1958). "Gammastrahlung en Ir 191 ". Zeitschrift für Physik A (en alemán). 151 (2): 124-143. Código Bib : 1958ZPhy..151..124M. doi :10.1007/BF01344210. S2CID 121129342.
- ^ Waller, I. (1964). "El Premio Nobel de Física 1961: discurso de presentación". Nobel Lectures, Physics 1942–1962 . Elsevier.
- ^ "Historia/Origen de los productos químicos". NASA . Consultado el 1 de enero de 2013 .
- ^ Chen, Hsin-Yu; Vitale, Salvatore; Foucart, Francois (1 de octubre de 2021). "La contribución relativa a la producción de metales pesados de las fusiones de estrellas de neutrones binarias y las fusiones de estrellas de neutrones y agujeros negros". The Astrophysical Journal Letters . 920 (1). American Astronomical Society: L3. arXiv : 2107.02714 . Bibcode :2021ApJ...920L...3C. doi : 10.3847/2041-8213/ac26c6 . hdl :1721.1/142310. ISSN 2041-8205. S2CID 238198587.
- ^ Arlandini, Claudio; Kappeler, Franz; Wisshak, Klaus; Gallino, Roberto; Lugaro, Maria; Busso, Maurizio; Straniero, Oscar (1999-11-10). "Captura de neutrones en estrellas de baja masa de la rama gigante asintótica: secciones transversales y firmas de abundancia". The Astrophysical Journal . 525 (2): 886–900. arXiv : astro-ph/9906266 . Código Bibliográfico :1999ApJ...525..886A. doi :10.1086/307938. ISSN 0004-637X.
- ^ Scott, ERD; Wasson, JT; Buchwald, VF (1973). "La clasificación química de los meteoritos de hierro—VII. Una nueva investigación de los hierros con concentraciones de Ge entre 25 y 80 ppm". Geochimica et Cosmochimica Acta . 37 (8): 1957–1983. Bibcode :1973GeCoA..37.1957S. doi :10.1016/0016-7037(73)90151-8.
- ^ Haynes, WM; Lide, David R.; Bruno, Thomas J., eds. (2017). "Abundancia de elementos en la corteza terrestre y en el mar". CRC Handbook of Chemistry and Physics (97.ª ed.). CRC Press . pág. 14-17. ISBN 978-1-4987-5429-3.
- ^ ab "Iridium" (PDF) . Hoja informativa sobre la salud humana . Laboratorio Nacional Argonne. 2005. Archivado desde el original (PDF) el 4 de marzo de 2012 . Consultado el 20 de septiembre de 2008 .
- ^ Xiao, Z.; Laplante, AR (2004). "Caracterización y recuperación de los minerales del grupo del platino: una revisión". Ingeniería de minerales . 17 (9–10): 961–979. Código Bibliográfico :2004MiEng..17..961X. doi :10.1016/j.mineng.2004.04.001.
- ^ "Cuproiridsite CuIr2S4" (PDF) . Manual de mineralogía.org . Consultado el 3 de marzo de 2022 .
- ^ Vitaly A. Stepanov; Valentina E. Kungurova; Vitaly I. Gvozdev (2010). "Descubrimiento de irasita en minerales de cobre y níquel del depósito Shanuch (KAMCHATKA)" (PDF) . Nuevos datos sobre minerales . 45 : 23 . Consultado el 3 de marzo de 2022 .
- ^ Garuti, Giorgio; Gazzotti, Moreno; Torres-Ruiz, Jose (1995). "Sulfuros de iridio, rodio y platino en cromititas de los macizos ultramáficos de Finero, Italia, y Ojén, España" (PDF) . The Canadian Mineralogist . 33 : 509–520 . Consultado el 2 de noviembre de 2022 .
- ^ abcd Seymour, RJ; O'Farrelly, JI (2012). "Metales del grupo del platino". Kirk Othmer Encyclopedia of Chemical Technology . Wiley. doi :10.1002/0471238961.1612012019052513.a01.pub3. ISBN 978-0471238966.
- ^ ab Goldberg, Hodge; Kay, V; Stallard, M; Koide, M (1986). "Algunas químicas marinas comparativas del platino y el iridio". Geoquímica Aplicada . 1 (2): 227–232. Bibcode :1986ApGC....1..227G. doi :10.1016/0883-2927(86)90006-5.
- ^ abc Wells, Boothe (1988). "Iridio en organismos marinos". Geochimica et Cosmochimica Acta . 52 (6): 1737-1739. Código Bib : 1988GeCoA..52.1737W. doi :10.1016/0016-7037(88)90242-6.
- ^ abc Sawlowicz, Z (1993). "Iridio y otros elementos del grupo del platino como marcadores geoquímicos en ambientes sedimentarios". Paleogeografía, Paleoclimatología, Paleoecología . 104 (4): 253–270. Bibcode :1993PPP...104..253S. doi :10.1016/0031-0182(93)90136-7.
- ^ Crocket, Macdougall; Harriss, R (1973). "Oro, paladio e iridio en sedimentos marinos". Geochimica et Cosmochimica Acta . 37 (12): 2547–2556. Código Bibliográfico :1973GeCoA..37.2547C. doi :10.1016/0016-7037(73)90264-0.
- ^ Peucker-Ehrenbrink, B (2001). "Iridio y osmio como trazadores de materia extraterrestre en sedimentos marinos". Acreción de materia extraterrestre a lo largo de la historia de la Tierra . págs. 163–178. doi :10.1007/978-1-4419-8694-8_10. ISBN 978-1-4613-4668-5.
- ^ Barker, J; Edward, A (1968). "Tasa de acreción de materia cósmica a partir de contenidos de iridio y osmio en sedimentos de aguas profundas". Geochimica et Cosmochimica Acta . 32 (6): 627–645. Código Bibliográfico :1968GeCoA..32..627B. doi :10.1016/0016-7037(68)90053-7.
- ^ Colodner, D; Edmond, J (1992). "Movilidad postdeposicional de platino, iridio y renio en sedimentos marinos". Nature . 358 (6385): 402–404. Código Bibliográfico :1992Natur.358..402C. doi :10.1038/358402a0. S2CID 37386975.
- ^ ab Alvarez, LW ; Alvarez, W.; Asaro, F.; Michel, HV (1980). "Causa extraterrestre de la extinción del Cretácico-Terciario" (PDF) . Science . 208 (4448): 1095–1108. Bibcode :1980Sci...208.1095A. CiteSeerX 10.1.1.126.8496 . doi :10.1126/science.208.4448.1095. PMID 17783054. S2CID 16017767.
- ^ Hildebrand, AR; Penfield, Glen T.; Kring, David A.; Pilkington, Mark; Zanoguera, Antonio Camargo; Jacobsen, Stein B.; Boynton, William V. (1991). "Cráter Chicxulub; un posible cráter de impacto en el límite Cretácico/Terciario en la península de Yucatán, México". Geología . 19 ( 9 ): 867–871. doi :10.1130/0091-7613(1991)019<0867:CCAPCT>2.3.CO;2.
- ^ Frankel, C. (1999). El fin de los dinosaurios: el cráter de Chicxulub y las extinciones masivas . Cambridge University Press. ISBN 978-0-521-47447-4.OCLC 40298401 .
- ^ Ryder, G.; Fastovsky, DE; Gartner, S. (1996). El evento Cretácico-Terciario y otras catástrofes en la historia de la Tierra . Sociedad Geológica de América. p. 47. ISBN 978-0-8137-2307-5.
- ^ Toutain, J.-P.; Meyer, G. (1989). "Sublimados portadores de iridio en un volcán de punto caliente (Piton De La Fournaise, Océano Índico)". Geophysical Research Letters . 16 (12): 1391–1394. Código Bibliográfico :1989GeoRL..16.1391T. doi :10.1029/GL016i012p01391.
- ^ abc Metales del grupo del platino. Resúmenes de productos minerales del Servicio Geológico de Estados Unidos
- ^ Singerling, Sheryl A.; Schulte, Ruth F. (agosto de 2021). "Metales del grupo del platino". Anuario de minerales 2018 (PDF) . USGS. pág. 57.11.
- ^ Hagelüken, C. (2006). «Mercados de los metales catalizadores platino, paladio y rodio» (PDF) . Metall . 60 (1–2): 31–42. Archivado desde el original (PDF) el 4 de marzo de 2009.
- ^ "Revisión provisional de Platinum 2013" (PDF) . Platinum Today . Johnson Matthey . Consultado el 10 de enero de 2014 .
- ^ de Ryan, Marge (16 de noviembre de 2022). "Reciclaje y ahorro: la respuesta a la cuestión del iridio en el crecimiento del electrolizador".
- ^ Gilchrist, Raleigh (1943). "Los metales del platino". Chemical Reviews . 32 (3): 277–372. doi :10.1021/cr60103a002. S2CID 96640406.
- ^ Ohriner, EK (2008). "Procesamiento de iridio y aleaciones de iridio". Platinum Metals Review . 52 (3): 186–197. doi : 10.1595/147106708X333827 .
- ^ Hunt, LB; Lever, FM (1969). "Platinum Metals: A Survey of Productive Resources to Industrial Uses" (PDF) . Platinum Metals Review . 13 (4): 126–138. doi :10.1595/003214069X134126138. S2CID 267561907. Archivado desde el original (PDF) el 29 de octubre de 2008 . Consultado el 1 de octubre de 2008 .
- ^ "Publicación de solo tablas del Anuario de minerales 2020". USGS .
- ^ ab Handley, JR (1986). "Aumento de las aplicaciones del iridio". Platinum Metals Review . 30 (1): 12–13. doi :10.1595/003214086X3011213.
- ^ Crookes, W. (1908). "Sobre el uso de crisoles de iridio en operaciones químicas". Actas de la Royal Society de Londres. Serie A, que contiene artículos de carácter matemático y físico . 80 (541): 535–536. Bibcode :1908RSPSA..80..535C. doi : 10.1098/rspa.1908.0046 . JSTOR 93031.
- ^ Egorova, RV; Korotkov, BV; Yaroshchuk, EG; Mirkus, KA; Dorofeev NA; Serkov, AT (1979). "Hilanderas para hilo de cordón de rayón viscosa". Química de las fibras . 10 (4): 377–378. doi :10.1007/BF00543390. S2CID 135705244.
- ^ Graff, Muriel; Kempf, Bernd; Breme, Jürgen (23 de diciembre de 2005). "Aleación de iridio para electrodos de bujías". Materiales para la tecnología del transporte . Weinheim, Alemania: Wiley-VCH Verlag GmbH & Co. KGaA. págs. 1–8. doi :10.1002/3527606025.ch1. ISBN 9783527301249.
- ^ Cheung, H.; Tanke, RS; Torrence, GP (2000). "Ácido acético". Enciclopedia de química industrial de Ullmann . Wiley. doi :10.1002/14356007.a01_045. ISBN 978-3527306732.
- ^ Jones, Jane H. (2000). "El proceso cativa™ para la fabricación de ácido acético". Platinum Metals Review . 44 (3): 94–105. doi : 10.1595/003214000X44394105 .
- ^ Roseblade, SJ; Pfaltz, A. (2007). "Hidrogenación asimétrica de olefinas catalizada por iridio". Accounts of Chemical Research . 40 (12): 1402–1411. doi :10.1021/ar700113g. PMID 17672517.
- ^ Ikariya, Takao; Blacker, A. John (2007). "Hidrogenación por transferencia asimétrica de cetonas con catalizadores moleculares basados en metales de transición bifuncionales†". Accounts of Chemical Research . 40 (12): 1300–1308. doi :10.1021/ar700134q. PMID 17960897.
- ^ Matthias Beller, Hans-Ulrich Blaser, ed. (2012). Organometálicos como catalizadores en la industria química fina . Temas de química organometálica. Vol. 42. Berlín, Heidelberg: Springer. ISBN 978-3-642-32832-9.
- ^ Halmshaw, R. (1954). "El uso y alcance del iridio 192 para la radiografía del acero". British Journal of Applied Physics . 5 (7): 238–243. Bibcode :1954BJAP....5..238H. doi :10.1088/0508-3443/5/7/302.
- ^ Hellier, Chuck (2001). Manual de evaluación no destructiva . The McGraw-Hill Companies. ISBN 978-0-07-028121-9.
- ^ Jean Pouliot; Luc Beaulieu (2010). "13 – Principios modernos de la física de la braquiterapia: de 2-D a 3-D a la planificación y administración dinámicas". En Richard T. Hoppe; Theodore Locke Phillips; Mack Roach (eds.). Leibel and Phillips Textbook of Radiation Oncology (3.ª ed.). WB Saunders. págs. 224–244. doi :10.1016/B978-1-4160-5897-7.00013-5. ISBN 9781416058977.
- ^ Ulbricht, Christoph; Beyer, Beatrice; Friebe, Christian; Winter, Andreas; Schubert, Ulrich S. (2009). "Desarrollos recientes en la aplicación de sistemas complejos de iridio(III) fosforescente". Materiales avanzados . 21 (44): 4418–4441. Código Bibliográfico :2009AdM....21.4418U. doi :10.1002/adma.200803537. S2CID 96268110.
- ^ Penzes, WB (2001). "Cronología de la definición del metro". Instituto Nacional de Normas y Tecnología . Consultado el 16 de septiembre de 2008 .
- ^ Citas de la sección general: Recalibration of the US National Prototype Kilogram (Recalibración del prototipo nacional de kilogramo de EE. UU.) , R. S. Davis, Journal of Research of the National Bureau of Standards (Revista de investigación del National Bureau of Standards), 90 , n.º 4, julio-agosto de 1985 (PDF de 5,5 MB Archivado el 1 de febrero de 2017 en Wayback Machine ); y The Kilogram and Measurements of Mass and Force (El kilogramo y las mediciones de masa y fuerza ), Z. J. Jabbour et al. , J. Res. Natl. Inst. Stand. Technol. 106 , 2001, 25-46 (PDF de 3,5 MB)
- ^ Mottishaw, J. (1999). "Notas de Nib Works: ¿Dónde está el iridio?". The PENnant . XIII (2).
- ^ Crookes, W., ed. (1867). "La Exposición de París". The Chemical News and Journal of Physical Science . XV : 182.
- ^ Pepper, JH (1861). El libro de jugadas de los metales: incluye relatos personales de visitas a minas de carbón, plomo, cobre y estaño, con una gran cantidad de experimentos interesantes relacionados con la alquimia y la química de los cincuenta elementos metálicos. Routledge, Warne y Routledge. pág. 455.
- ^ "Iridio (Ir): propiedades químicas, efectos sobre la salud y el medio ambiente". www.lenntech.com . Consultado el 27 de julio de 2024 .
- ^ "Informe sobre radioisótopos: iridio-192 (Ir-192)" (PDF) . Emergencias por radiación . Centros para el Control y la Prevención de Enfermedades. 18 de agosto de 2004 . Consultado el 20 de septiembre de 2008 .
Enlaces externos
- Iridio en la tabla periódica de vídeos (Universidad de Nottingham)
- Iridio en la Encyclopædia Britannica





