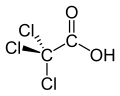
Ácido tricloroacético
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Ácido tricloroacético | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 970119 | |||
| EBICh |
| ||
| Química biológica |
| ||
| Araña química |
| ||
| Tarjeta informativa de la ECHA | 100.000.844 | ||
| 2842 | |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C2HCl3O2 | |||
| Masa molar | 163,38 g·mol −1 | ||
| Apariencia | Sólido cristalino, incoloro a blanco. | ||
| Olor | Picante, picante [1] | ||
| Densidad | 1,63 g/ cm3 | ||
| Punto de fusión | 57 a 58 °C (135 a 136 °F; 330 a 331 K) [2] | ||
| Punto de ebullición | 196 a 197 °C (385 a 387 °F; 469 a 470 K) [2] | ||
| 1000 g/100 ml [2] | |||
| Presión de vapor | 1 mmHg (51,1 °C) [1] | ||
| Acidez (p K a ) | 0,66 [3] | ||
| −73,0·10 −6 cm3 / mol | |||
| Estructura | |||
| 3.23 D | |||
| Peligros | |||
| Etiquetado SGA : | |||
  | |||
| Peligro | |||
| H314 , H410 | |||
| P260 , P264 , P273 , P280 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P363 , P391 , P405 , P501 | |||
| NFPA 704 (rombo cortafuegos) | |||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 5000 mg/kg por vía oral en ratas [2] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | Ninguno [1] | ||
REL (recomendado) | TWA 1 ppm (7 mg/m3 ) [ 1] | ||
IDLH (Peligro inmediato) | Dakota del Norte [1] | ||
| Compuestos relacionados | |||
Ácidos cloroacéticos relacionados | Ácido cloroacético Ácido dicloroacético | ||
Compuestos relacionados | Ácido acético Ácido trifluoroacético Ácido tribromoacético | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El ácido tricloroacético ( TCA ; TCAA ; también conocido como ácido tricloroetanoico ) es un análogo del ácido acético en el que los tres átomos de hidrógeno del grupo metilo han sido reemplazados por átomos de cloro . Las sales y ésteres del ácido tricloroacético se denominan tricloroacetatos .
Síntesis
El ácido tricloroacético fue descubierto por Jean-Baptiste Dumas en 1830. [4]
Se prepara mediante la reacción del cloro con ácido acético en presencia de un catalizador adecuado, como el fósforo rojo . Esta reacción se denomina halogenación de Hell-Volhard-Zelinsky .
- es
3COOH + 3 Cl
2→ CCl3
3COOH + 3 HCl
Otra ruta para obtener ácido tricloroacético es la oxidación del tricloroacetaldehído .
Usar
Se utiliza ampliamente en bioquímica para la precipitación de macromoléculas, como proteínas , ADN y ARN . Tanto el TCA como el DCA se utilizan en tratamientos cosméticos (como peelings químicos y eliminación de tatuajes ) y como medicación tópica para la quimioablación de verrugas , incluidas las verrugas genitales . También puede matar células normales. Se considera seguro para su uso con este fin durante el embarazo. [5] [6]
La sal de sodio ( tricloroacetato de sodio ) se utilizó como herbicida a partir de la década de 1950, pero los reguladores la retiraron del mercado a fines de la década de 1980 y principios de la de 1990. [7] [8] [9] [10]
Preocupaciones ambientales y de salud
Según la Agencia Europea de Sustancias y Mezclas Químicas, “Esta sustancia provoca quemaduras graves en la piel y daños oculares, es muy tóxica para la vida acuática y tiene efectos tóxicos duraderos”. [11]
Historia
El descubrimiento del ácido tricloroacético por Jean-Baptiste Dumas en 1839 supuso un ejemplo sorprendente para la teoría de los radicales orgánicos y las valencias, que evolucionaba lentamente. [12] La teoría era contraria a las creencias de Jöns Jakob Berzelius , lo que dio inicio a una larga disputa entre Dumas y Berzelius. [13]
Cultura popular
En la película The Blob de 1958 , se arroja una botella de ácido tricloroacético a Blob en un intento inútil de defenderse.
Véase también
Referencias
- ^ abcde Guía de bolsillo de NIOSH sobre peligros químicos n.° 0626 Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH)
- ^ abcd Budavari, Susan, ed. (1996), El índice Merck: una enciclopedia de productos químicos, fármacos y productos biológicos (12.ª ed.), Merck, ISBN 0911910123
- ^ Databog fysik kemi, F&K Forlaget 11. udgave 2009
- ^ Ácido tercloracético en Gmelin, L., Manual de química: Química orgánica
- ^ Jones, Kirtly (21 de junio de 2012). Marshall, Sarah (ed.). "Ácido tricloroacético o ácido bicloroacético para las verrugas genitales (virus del papiloma humano)". WebMD . HealthWise. Archivado desde el original el 16 de julio de 2015.
- ^ Wiley DJ, Douglas J, Beutner K, Cox T, Fife K, Moscicki AB, Fukumoto L (2002). "Verrugas genitales externas: diagnóstico, tratamiento y prevención". Clinical Infectious Diseases . 35 (Supl 2): S210–S224. doi : 10.1086/342109 . PMID 12353208.
- ^ TCA-sodio en la base de datos de propiedades de pesticidas (PPDB), consultado el 20 de junio de 2014
- ^ GS Rai y CL Hamner. "Persistencia del tricloroacetato de sodio en diferentes tipos de suelo". Weeds 2(4) octubre de 1953: 271-279. JSTOR 4040104. DOI 10.2307/4040104.
- ^ Programa de las Naciones Unidas para el Medio Ambiente. «Ácido tricloroacético CAS N°: 76-03-9» ( OCDE SIDS ). Consultado el 20 de junio de 2014. Archivado desde el original el 15 de agosto de 2018.
- ^ Heier, Al (diciembre de 1991). "Ácido tricloroacético (TCA)". EPA. Consultado el 20 de junio de 2014, a través de la base de datos de información sobre ingredientes activos de pesticidas de Cornell PMEP. Archivado desde el original el 15 de agosto de 2020.
- ^ "Ácido tricloroacético". Inventario C&L . Agencia Europea de Sustancias Químicas . Consultado el 14 de marzo de 2022 .
- ^ Dumas (1839). "Ácido tricloroacético". Annalen der Pharmacie . 32 : 101-119. doi :10.1002/jlac.18390320109.
- ^ William Albert Noyes (1927). "Valence". Actas de la American Philosophical Society . 66 : 287–308. JSTOR 3301070.
Enlaces externos
- Ficha internacional de seguridad química 0586
- CDC - Guía de bolsillo de NIOSH sobre peligros químicos