Ecología química
La ecología química es un campo vasto e interdisciplinario que utiliza la bioquímica , la biología , la ecología y la química orgánica para explicar las interacciones observadas de los seres vivos y su entorno a través de compuestos químicos (por ejemplo, la resiliencia del ecosistema y la biodiversidad). [1] [2] Los primeros ejemplos de este campo se remontan a experimentos con el mismo género de plantas en diferentes entornos, la interacción de plantas y mariposas y el efecto conductual de la hierba gatera. [3] [4] [5] Los ecólogos químicos buscan identificar las moléculas específicas (es decir, los semioquímicos ) que funcionan como señales que median los procesos de la comunidad o del ecosistema y comprender la evolución de estas señales. [6] Los productos químicos detrás de tales funciones son típicamente moléculas orgánicas pequeñas y fácilmente difundibles que actúan a varias distancias que dependen del entorno (es decir, terrestre o acuático), pero también pueden incluir moléculas más grandes y péptidos pequeños. [7] [8]

En la práctica, la ecología química se basa en técnicas cromatográficas , como la cromatografía de capa fina , la cromatografía líquida de alto rendimiento , la cromatografía de gases , la espectrometría de masas (MS) y la configuración absoluta utilizando resonancia magnética nuclear (RMN) para aislar e identificar metabolitos bioactivos. [2] [6] Para identificar moléculas con la actividad buscada, los ecólogos químicos a menudo utilizan el fraccionamiento guiado por bioensayo . [8] Hoy en día, los ecólogos químicos también incorporan técnicas genéticas y genómicas para comprender las vías biosintéticas y de transducción de señales que subyacen a las interacciones mediadas químicamente. [2] [8] [9]
Ecología química de plantas, microbios e insectos

La ecología química de plantas, microbios e insectos se centra en el papel de las señales y señales químicas en la mediación de las interacciones con su entorno abiótico (por ejemplo, la capacidad de algunas bacterias para reducir los metales en el entorno circundante) y biótico (por ejemplo, microorganismos, insectos fitófagos y polinizadores). [10] [11] Las señales permiten a los organismos monitorear las interacciones con el medio ambiente y adaptarse en consecuencia a través de cambios en la abundancia química como respuesta. [12] Los cambios en la abundancia de compuestos permiten que se implementen medidas defensivas, por ejemplo, atracciones para depredadores. [12]
Interacciones entre plantas e insectos

La ecología química de la interacción planta-insecto es un subcampo significativo de la ecología química. [2] [13] [14] En particular, las plantas y los insectos a menudo están involucrados en una carrera armamentista evolutiva química . [15] A medida que las plantas desarrollan defensas químicas contra la herbivoría, los insectos que se alimentan de ellas coevolucionan para desarrollar inmunidad a estos venenos y, en algunos casos, reutilizan estos venenos para su propia defensa química contra los depredadores. [15] Por ejemplo, las orugas de la mariposa monarca secuestran toxinas cardenolidas de sus plantas hospedantes de algodoncillo y pueden usarlas como defensa antidepredadores debido a la toxina. [15] El secuestro es una estrategia de la coevolución, los experimentos de alimentación en orugas de la mariposa monarca mostraron que las orugas que no se han alimentado de algodoncillo no poseen toxinas similares a las que se encuentran alimentándose de algodoncillo. [15] Mientras que la mayoría de los insectos mueren con cardenólidos, que son potentes inhibidores de la Na+/K+-ATPasa , las monarcas han desarrollado resistencia a la toxina a lo largo de su larga historia evolutiva con algodoncillos. Otros ejemplos de secuestro incluyen el gusano cuerno del tabaco Manduca sexta , que utiliza la nicotina secuestrada de las plantas de tabaco en la defensa de los depredadores; [13] y la polilla bella , que secreta una espuma que contiene quinona para disuadir a los depredadores obtenidos de alimentarse de plantas Crotalaria como oruga.
Los ecólogos químicos también estudian las interacciones químicas implicadas en las defensas indirectas de las plantas , como la atracción de depredadores y parasitoides a través de compuestos orgánicos volátiles (COV) inducidos por herbívoros . [12]
Interacciones entre plantas y microbios
Las interacciones de las plantas con los microorganismos también están mediadas por la química. Tanto los metabolitos secundarios constitutivos como los inducidos ( metabolitos especializados en la terminología moderna) están involucrados en la defensa de las plantas contra los patógenos y las señales químicas también son importantes en el establecimiento y mantenimiento de mutualismos de recursos . Por ejemplo, tanto los rizobios como las micorrizas dependen de señales químicas, como las estrigolactonas y los flavonoides exudados por las raíces de las plantas, para encontrar un huésped adecuado.
Para que los microbios puedan acceder a la planta, deben poder penetrar la capa de cera que forma una barrera hidrófoba en la superficie de la planta. [16] Muchos microbios patógenos de las plantas secretan enzimas que descomponen estas ceras cuticulares. [17] Por otro lado, los microbios mutualistas pueden tener acceso. Por ejemplo, los rizobios secretan factores Nod que desencadenan la formación de un hilo de infección en las plantas receptivas. Los simbiontes rizobianos pueden luego viajar a través de este hilo de infección para ingresar a las células de la raíz.
Las micorrizas y otros hongos endófitos también pueden beneficiar a sus plantas hospedantes al producir antibióticos u otros metabolitos secundarios /metabolitos especializados que alejan a los hongos, bacterias y herbívoros dañinos en el suelo. [18] Algunos hongos entomopatógenos también pueden formar relaciones endofíticas con las plantas e incluso pueden transferir nitrógeno directamente a las plantas desde los insectos que consumen en el suelo circundante. [19]
Interacciones entre plantas
Alelopatía
La alelopatía es un subcampo de la ecología química que se centra en los metabolitos secundarios/especializados (conocidos como aleloquímicos ) producidos por plantas o microorganismos que pueden inhibir el crecimiento y la formación de plantas o microorganismos vecinos dentro de la comunidad natural. [20] [21] Muchos ejemplos de competencia alelopática han sido controvertidos debido a la dificultad de demostrar positivamente un vínculo causal entre las sustancias alelopáticas y el rendimiento de las plantas en condiciones naturales, [22] pero es ampliamente aceptado que los fitoquímicos están involucrados en interacciones competitivas entre plantas. Uno de los ejemplos más claros de alelopatía es la producción de juglona por los nogales , cuyos fuertes efectos competitivos sobre las plantas vecinas fueron reconocidos en el mundo antiguo ya en el año 36 a. C. [23] Los compuestos alelopáticos también se han convertido en un interés en la agricultura como una alternativa al manejo de malezas sobre los herbicidas sintéticos, por ejemplo, la producción de trigo. [24]
Comunicación entre plantas
Las plantas se comunican entre sí a través de señales químicas tanto aéreas como subterráneas. Por ejemplo, cuando un herbívoro las daña, muchas plantas emiten un conjunto alterado de compuestos orgánicos volátiles (COV). Las hojas dañadas suelen emitir diversos ácidos grasos C6 y alcoholes (a veces conocidos como volátiles de las hojas verdes ), ya que son productos de degradación de las membranas celulares de las plantas. Estos compuestos (que muchos conocen como el olor de la hierba recién cortada) pueden ser percibidos por las plantas vecinas, donde pueden desencadenar la inducción de defensas vegetales. [25] Se debate hasta qué punto esta comunicación refleja una historia de selección activa debido al beneficio mutuo en lugar de "escuchar a escondidas" las señales emitidas involuntariamente por las plantas vecinas. [26]
Interacciones entre insectos y reptiles
Más información: carrera armamentista depredador-presa

La interacción de los reptiles también contribuye a la ecología química a través de la bioacumulación o neutralización de compuestos tóxicos. La rana venenosa Diablito ( Oophaga sylvatica) , que se alimenta de artrópodos de la hojarasca, secuestra los cardenólidos venenosos sin hacerse daño. [27] [28] Las especies de ranas dardo han evolucionado de manera similar a los insectos que consumen a través de la modificación de su Na+/K+-ATPasa. [28] Una vez más, de manera similar a los insectos de los que se alimentan, la fisiología de la rana dardo ha cambiado para permitir la secreción de sustancias químicas tóxicas como las batracotoxinas que se encuentran en la piel de ciertas ranas dendrobátidas neotropicales. [29] La modificación de la Na+/K+-ATPasa ilustra una coevolución basada en una carrera armamentista depredador-presa donde cada uno debe seguir evolucionando para sobrevivir. [15] [28] Otro ejemplo son las interacciones entre los lagartos cornudos ( Phrynosoma spp.) y las hormigas recolectoras ( Pogonomyrmex spp.). [30] La evolución de los lagartos cornudos ha demostrado que la sangre contiene un factor que metaboliza las toxinas producidas por las hormigas recolectoras. El veneno metabolizado se descompone y se utiliza en un mecanismo defensivo especializado que expulsa sangre para defender al lagarto cornudo de los depredadores. [31]
Interacciones entre insectos y mamíferos
Más información: benzoquinona y milpiés
_male.jpg/440px-Red-fronted_brown_lemur_(Eulemur_rufifrons)_male.jpg)
Mamíferos como los lémures y los monos demuestran la aplicación de productos químicos de manera similar a cómo los humanos usan los productos químicos para el manejo de plagas y uso médico. [32] [33] [34] Estas aplicaciones varían desde la prevención de parásitos o patógenos internos y externos, la disminución de la probabilidad de infección, el aumento de la función reproductiva, la reducción de la inflamación, las señales sociales y más. [32] [34] Los lémures de frente roja (Eulemur ruffrons) han desarrollado dos vías, una medida preventiva para evitar la bioacumulación, que permite la modificación de la 2-metil-1,4-benzoquinona y la 2-metoxi-3-metil-1,4-benzoquinona, una secreción de los milpiés Spirostreptidae que se ha demostrado que inhibe ciertas especies bacterianas. [33] También se ha observado que los lémures de frente roja se frotan la secreción en el pelaje de manera similar a los capuchinos, esta acción utiliza compuestos de benzoquinona como repelente para varios insectos como garrapatas y mosquitos. [34] [35] [36]
Ecología química marina
Defensa

.jpg/440px-Blue_crab_(black_background).jpg)
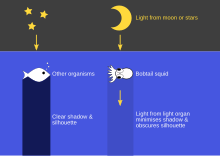
Muchos organismos marinos utilizan defensas químicas para disuadir a los depredadores. Por ejemplo, algunos crustáceos y mesograzers , como el Pseudamphithoides incurvaria , utilizan algas tóxicas y algas marinas como escudo contra la depredación al cubrir sus cuerpos con estas plantas. Estas plantas producen ficotoxinas , diterpenos como pachydictyol-A y dictyol-E, que se ha demostrado que disuaden a los depredadores. [ cita requerida ] Demostrando esta relación simbiótica están las cianobacterias y los camarones. Se ha observado que el camarón mordedor Alpheus frontalis utiliza Moorena bouillonii , una cianobacteria, para refugiarse y alimentarse. M. bouillonii produce compuestos que son tóxicos para otros organismos marinos y corales, pero su relación con A. frontalis demuestra el uso de M. bouillonii como disuasivo y refugio para proteger a A. frontalis . [37] Otros organismos marinos producen sustancias químicas de forma endógena para defenderse. Por ejemplo, el lenguado sin aleta ( Pardachirus marmoratus ) produce una toxina que paraliza las mandíbulas de los posibles depredadores. Muchos zoántidos producen potentes toxinas, como la palitoxina , que es una de las sustancias más venenosas conocidas. Algunas especies de estos zoántidos tienen colores muy brillantes, lo que puede ser indicativo de una defensa aposemática . [38] Otra medida defensiva que involucra la ecología química y la ecología marina es el órgano de luz del calamar bobtail. El bobtail que se encuentra en Hawái contiene un órgano de luz que alberga la bacteria consumida Vibrio fischeri, la bacteria V. fisheri utiliza la detección de quórum para indicar la expresión de bioluminiscencia, para la intensidad de la luz descendente. [39] La intensidad de la luz descendente permite al calamar bobtail alejarse de los depredadores imitando la intensidad de la luz de la luna y las estrellas mientras caza presas por la noche. [40] También se ha desarrollado una defensa del cangrejo azul, que utiliza órganos sensoriales para detectar cambios químicos en el agua y alertarlo de los depredadores. [41] Cuando se sienten alertas, los cangrejos azules se esconden como estrategia defensiva. La orina de los depredadores actúa como una presión selectiva, por lo que los cangrejos azules, que son más sensibles a los cambios químicos, tienen más probabilidades de sobrevivir. [41]Los que sobreviven aumentan la probabilidad de que la descendencia desarrolle los mismos órganos sensoriales para la detección. Sin embargo, existe una diferencia distintiva entre el desarrollo de los órganos sensoriales, la capacidad de procesar o acumular toxinas o bacterias en comparación con la estrategia defensiva adquirida o desarrollada por hábito. [37] [40] [41]
Reproducción
Muchos organismos marinos utilizan feromonas como señales químicas que alertan a sus posibles parejas de que están listos para reproducirse. [42] Por ejemplo, las lampreas marinas macho atraen a las hembras ovuladoras emitiendo una bilis que se puede detectar muchos metros río abajo. [43] Otros procesos pueden ser más complejos, como los hábitos de apareamiento de los cangrejos. Debido a que los cangrejos hembra solo pueden aparearse durante un corto período después de mudar su caparazón, las hembras producen feromonas antes de comenzar a mudar para atraer a una pareja. Los cangrejos macho detectarán estas feromonas y defenderán a su pareja potencial hasta que haya terminado de mudar. Sin embargo, debido a las tendencias caníbales de los cangrejos, la hembra produce una feromona adicional para suprimir los instintos caníbales en su guardián masculino. Estas feromonas son muy potentes, tanto que pueden inducir a los cangrejos macho a intentar copular con rocas o esponjas que hayan sido recubiertas de feromonas por los investigadores. [44] Además, la estructura compuesta juega un papel clave, por ejemplo, las feromonas de cangrejo están especializadas para viajar en ambientes acuáticos frente a terrestres. [45]
Dominio
.jpg/440px-American_lobster,_Homarus_americanus_in_Newfoundland,_Canada_(20996211958).jpg)
La dominancia entre crustáceos también se media a través de señales químicas. Cuando los crustáceos luchan para determinar su dominio, orinan en el agua. Más tarde, si se vuelven a encontrar, ambos individuos pueden reconocerse entre sí por las feromonas contenidas en su orina, lo que les permite evitar una pelea, si ya se ha establecido la dominancia. Cuando una langosta se encuentra con la orina de otro individuo, actuará de manera diferente según el estatus percibido del orinador (por ejemplo, de manera más sumisa cuando se expone a la orina de un cangrejo más dominante, o más audazmente cuando se expone a la orina de un individuo subdominante). Cuando los individuos no pueden comunicarse a través de la orina, las peleas pueden ser más largas e impredecibles. [44]
Aplicaciones de la ecología química

Control de plagas
La ecología química se ha utilizado en el desarrollo de estrategias sostenibles de control de plagas . Los semioquímicos (especialmente las feromonas sexuales de insectos ) se utilizan ampliamente en el manejo integrado de plagas para la vigilancia, el atrapamiento y la interrupción del apareamiento de los insectos plaga. [46] A diferencia de los insecticidas convencionales, los métodos de control de plagas basados en feromonas son generalmente específicos de la especie, no tóxicos y extremadamente potentes. En la silvicultura, el atrapamiento masivo se ha utilizado con éxito para reducir la mortalidad de los árboles por infestaciones de escarabajos de corteza en bosques de abetos y pinos y de gorgojos de la palma en plantaciones de palma. [46] En Australia, el uso de trampas basadas en feromonas se implementó para compensar el uso de pesticidas debido a los residuos que quedan en la lana de oveja. [46] En un sistema acuático, la Agencia de Protección Ambiental de los Estados Unidos ha registrado una feromona sexual de la lamprea marina invasora para su uso en trampas. [47] En Kenia se ha desarrollado una estrategia para proteger al ganado de la tripanosomiasis transmitida por la mosca tsé-tsé mediante la aplicación de una mezcla de olores repelentes derivados de un animal no huésped, el antílope acuático . [48] El uso de feromonas sexuales depende de varios factores, como la concentración, la capacidad de detectar la feromona, la temperatura, la mezcla de la feromona con otros compuestos y el medio en el que se administra la feromona, por ejemplo, acuático o terrestre. [45] [49]
El exitoso sistema de manejo de plagas agrícolas push-pull hace uso de señales químicas de plantas intercaladas para aumentar de manera sostenible los rendimientos agrícolas. La eficacia de la agricultura push-pull depende de múltiples formas de comunicación química. Aunque la técnica push-pull se inventó como una estrategia para controlar polillas perforadoras del tallo , como Chilo partellus , a través de la manipulación de señales volátiles de búsqueda de hospedadores , más tarde se descubrió que las sustancias alelopáticas exudadas por las raíces de Desmodium spp. también contribuyen a la supresión de la maleza parásita dañina, Striga . [50]
Desarrollo de fármacos y descubrimientos bioquímicos

Una gran proporción de medicamentos comerciales (por ejemplo, aspirina , ivermectina , ciclosporina , taxol ) se derivan de productos naturales que evolucionaron debido a su participación en interacciones ecológicas. Si bien se ha propuesto que el estudio de la historia natural podría contribuir al descubrimiento de nuevos fármacos , la mayoría de los fármacos derivados de productos naturales no se descubrieron debido al conocimiento previo de sus funciones ecológicas. [51] Sin embargo, muchos descubrimientos biológicos fundamentales se han visto facilitados por el estudio de las toxinas vegetales. Por ejemplo, la caracterización del receptor nicotínico de acetilcolina , el primer receptor de neurotransmisores que se identificó, surgió de las investigaciones sobre los mecanismos de acción del curare y la nicotina . De manera similar, el receptor muscarínico de acetilcolina toma su nombre de la toxina fúngica muscarina . [52] Mientras que los hongos acuáticos proporcionan metabolitos especializados de interés para los antibióticos, por ejemplo, la pestalona. [53] La pestalona inhibe el crecimiento de bacterias marinas, se encontró que la vía para producir pestalona por hongos marinos no funciona cuando la bacteria está ausente. [53] El compuesto pestalona se derivó de un hongo marino ubicado en las Islas Bahamas en la superficie de un alga marrón, Rosenvingea sp . [53] El desarrollo en biotecnología se centra en los hongos acuáticos en la búsqueda de nuevos antibióticos se inspiró en los hongos terrestres, el cruce no es equivalente ya que las demandas en los hongos acuáticos no son exactas a sus contrapartes terrestres. [54] Algunos hongos acuáticos han mostrado cambios en la producción de esfingolípidos bajo factores estresantes como el ácido, lo que resulta en la inhibición de la formación de biopelículas. [55] Mientras que, se sabe que los hongos de tipo salvaje regulan positivamente la producción de fármacos resistentes a los azoles, como la proteína de resistencia a múltiples fármacos 1 (MDR1) y los transportadores Cdr1 y Cdr2 que actúan como bombas para eliminar los fármacos antimicóticos. [55] [56] Los esfingolípidos y los esteroles constituyen la mayoría de la membrana de la bicapa lipídica en los hongos, por ejemplo, las especies de Candida , y ayudan a la formación de biopelículas. La comprensión del mecanismo se utiliza para el desarrollo de adyuvantes de vacunas. La producción de biopelículas se inicia a través de la detección de quórum . Un ejemplo de detección de quórum son las proteínas LuxR y LuxI que contribuyen a la bioluminiscencia en Vibrio fischeri; LuxI produce lactonas de homoserina aciladas.(AHL) que son recibidos por LuxR de bacterias vecinas, una concentración específica de AHL desencadena la expresión genética de bioluminiscencia. [57] Algunos adyuvantes de vacunas se centran en la formación de biopelículas con el objetivo de interrumpir la comunicación utilizando el conocimiento actual sobre detección de quórum.
Historia de la ecología química
Después de 1950

En 1959, Adolf Butenandt identificó la primera señal química intraespecífica ( bombykol ) de la polilla de seda, Bombyx mori , con material obtenido al moler 500.000 polillas. [58] El mismo año, Karlson y Lüscher propusieron el término "feromona" para describir este tipo de señal. [59] También en 1959, Gottfried S. Fraenkel también publicó su artículo histórico, "La razón de ser de las sustancias vegetales secundarias", argumentando que los metabolitos secundarios/especializados de las plantas no son productos de desecho metabólicos, sino que en realidad evolucionaron para proteger a las plantas de los consumidores. [60] Juntos, estos artículos marcaron el comienzo de la ecología química moderna. En 1964, Paul R. Ehrlich y Peter H. Raven escribieron un artículo en el que proponían su influyente teoría de la coevolución de escape e irradiación , que sugería que una "carrera armamentista" evolutiva entre plantas e insectos puede explicar la diversificación extrema de plantas e insectos. [61] La idea de que los metabolitos de las plantas no solo podrían contribuir a la supervivencia de plantas individuales, sino que también podrían influir en amplios patrones macroevolutivos , resultaría ser muy influyente. Sin embargo, Tibor Jermy cuestionó la visión de una carrera armamentista evolutiva entre plantas y sus insectos herbívoros y propuso que la evolución de los insectos fitófagos siguió y sigue a la de las plantas sin una retroalimentación evolutiva importante, es decir, sin afectar la evolución de las plantas. [62] Acuñó el término evolución secuencial para describir los patrones macroevolutivos planta-insecto, que enfatiza que la presión de selección ejercida por el ataque de insectos a las plantas es débil o inexistente. [63]
En los años 1960 y 1970, varios biólogos vegetales, ecólogos y entomólogos ampliaron esta línea de investigación sobre los roles ecológicos de los metabolitos secundarios/especializados de las plantas. Durante este período, Thomas Eisner y su colaborador cercano Jerrold Meinwald publicaron una serie de artículos seminales sobre defensas químicas en plantas e insectos. [64] [65] Varios otros científicos de Cornell también estaban trabajando en temas relacionados con la ecología química durante este período, incluidos Paul Feeny, Wendell L. Roelofs , Robert Whittaker y Richard B. Root . En 1968, se inició el primer curso de ecología química en Cornell. [66] En 1970, Eisner, Whittaker y el biólogo de hormigas William L. Brown, Jr. acuñaron los términos alomona (para describir semioquímicos que benefician al emisor, pero no al receptor) y kairomona (para describir semioquímicos que benefician solo al receptor). [67] Whittaker y Feeny publicaron un influyente artículo de revisión en Science al año siguiente, resumiendo la investigación reciente sobre los roles ecológicos de las defensas químicas en una amplia variedad de plantas y animales y probablemente presentando la nueva taxonomía de semioquímicos de Whittaker a una audiencia científica más amplia. [68] En esta época, Lincoln Brower también publicó una serie de importantes estudios ecológicos sobre el secuestro de cardenólidos por la mariposa monarca. A Brower se le atribuye la popularización del término "química ecológica", que apareció en el título de un artículo que publicó en Science en 1968 [69] y nuevamente al año siguiente en un artículo que escribió para Scientific American , donde el término también apareció en la portada debajo de una imagen de un arrendajo azul gigante que se eleva sobre dos mariposas monarca. [59] [70]
En 1975 se fundó la revista especializada Journal of Chemical Ecology y en 1990 la revista Journal Chemoecology . En 1984 se fundó la Sociedad Internacional de Ecología Química y en 1996 se fundó el Instituto Max Planck de Ecología Química en Jena, Alemania. [59]
Véase también
- Defensa química
- Semioquímico
- Ecologistas químicos
- Mayo R. Berenbaum
- Lincoln Brower
- Thomas Eisner
- Jerrold Meinwald
- Wendell L. Roelofs
- Escapar y radiar la coevolución
Referencias
- ^ Bunin, Barry A. (diciembre de 1996). "Ecología química: la química de la interacción biótica. Thomas Eisner, Jerrold Meinwald". The Quarterly Review of Biology . 71 (4): 562. doi :10.1086/419565. ISSN 0033-5770.
- ^ abcd Dyer, Lee A.; Philbin, Casey S.; Ochsenrider, Kaitlin M.; Richards, Lora A.; Massad, Tara J.; Smilanich, Angela M.; Forister, Matthew L.; Parchman, Thomas L.; Galland, Lanie M. (25 de mayo de 2018). "Enfoques modernos para estudiar las interacciones entre plantas e insectos en ecología química". Nature Reviews Chemistry . 2 (6): 50–64. doi :10.1038/s41570-018-0009-7. ISSN 2397-3358. S2CID 49362070.
- ^ Hartmann, Thomas (25 de marzo de 2008). "El origen perdido de la ecología química a finales del siglo XIX". Actas de la Academia Nacional de Ciencias . 105 (12): 4541–4546. doi : 10.1073/pnas.0709231105 . ISSN 0027-8424. PMC 2290813 . PMID 18218780.
- ^ Ehrlich, Paul R.; Raven, Peter H. (diciembre de 1964). "Mariposas y plantas: un estudio sobre coevolución". Evolución . 18 (4): 586–608. doi :10.1111/j.1558-5646.1964.tb01674.x. ISSN 0014-3820.
- ^ Eisner, Thomas (4 de diciembre de 1964). "Catnip: su razón de ser". Ciencia . 146 (3649): 1318-1320. Código bibliográfico : 1964 Ciencia... 146.1318E. doi : 10.1126/ciencia.146.3649.1318. ISSN 0036-8075. PMID 14207462.
- ^ ab Inamdar, Arati A.; Morath, Shannon; Bennett, Joan W. (8 de septiembre de 2020). "Compuestos orgánicos volátiles fúngicos: ¿más que un olor desagradable?". Revisión anual de microbiología . 74 (1): 101–116. doi :10.1146/annurev-micro-012420-080428. ISSN 0066-4227. PMID 32905756.
- ^ Wood William F. (1983). "Ecología química: comunicación química en la naturaleza". Revista de educación química . 60 (7): 531–539. Código Bibliográfico :1983JChEd..60..531W. doi :10.1021/ed060p531.
- ^ abc Schmidt, Ruth; Ulanova, Dana; Wick, Lukas Y; Bode, Helge B; Garbeva, Paolina (9 de julio de 2019). "Ecología química impulsada por microbios: pasado, presente y futuro". The ISME Journal . 13 (11): 2656–2663. Bibcode :2019ISMEJ..13.2656S. doi :10.1038/s41396-019-0469-x. ISSN 1751-7362. PMC 6794290 . PMID 31289346.
- ^ Meinwald, J.; Eisner, T. (19 de marzo de 2008). "Ecología química en retrospectiva y perspectiva". Actas de la Academia Nacional de Ciencias . 105 (12): 4539–4540. doi : 10.1073/pnas.0800649105 . ISSN 0027-8424. PMC 2290750 . PMID 18353981.
- ^ Johnston, Chad W; Wyatt, Morgan A; Li, Xiang; Ibrahim, Ashraf; Shuster, Jeremiah; Southam, Gordon; Magarvey, Nathan A (abril de 2013). "Biomineralización de oro por un metalóforo de un microbio asociado al oro". Nature Chemical Biology . 9 (4): 241–243. doi :10.1038/nchembio.1179. ISSN 1552-4450.
- ^ Fraenkel, Gottfried S. (29 de mayo de 1959). "La razón de ser de las sustancias vegetales secundarias: estas extrañas sustancias químicas surgieron como un medio para proteger a las plantas de los insectos y ahora guían a los insectos hacia el alimento". Science . 129 (3361): 1466–1470. doi :10.1126/science.129.3361.1466. ISSN 0036-8075. PMID 13658975.
- ^ abc Scott, Eric R.; Li, Xin; Wei, Ji-Peng; Kfoury, Nicole; Morimoto, Joshua; Guo, Ming-Ming; Agyei, Amma; Robbat, Albert; Ahmed, Selena; Cash, Sean B.; Griffin, Timothy S.; Stepp, John R.; Han, Wen-Yan; Orians, Colin M. (29 de mayo de 2020). "Cambios en los perfiles de metabolitos secundarios de la planta del té en función de la densidad y el daño de los saltahojas". Frontiers in Plant Science . 11 : 636. doi : 10.3389/fpls.2020.00636 . ISSN 1664-462X. PMC 7272924 . PMID 32547579.
- ^ ab Mithfer, Axel; Boland, Wilhelm; Maffei, Massimo E. (2008), "Ecología química de las interacciones entre plantas e insectos", Aspectos moleculares de la resistencia a las enfermedades de las plantas , Wiley-Blackwell, págs. 261-291, doi :10.1002/9781444301441.ch9, ISBN 978-1-4443-0144-1
- ^ Dyer, Lee A.; Philbin, Casey S.; Ochsenrider, Kaitlin M.; Richards, Lora A.; Massad, Tara J.; Smilanich, Angela M.; Forister, Matthew L.; Parchman, Thomas L.; Galland, Lanie M. (25 de mayo de 2018). "Enfoques modernos para estudiar las interacciones entre plantas e insectos en ecología química". Nature Reviews Chemistry . 2 (6): 50–64. doi :10.1038/s41570-018-0009-7. ISSN 2397-3358. S2CID 49362070.
- ^ abcde Brower, LP; van Brower, J; Corvino, JM (abril de 1967). "Venenos vegetales en una cadena alimentaria terrestre". Actas de la Academia Nacional de Ciencias . 57 (4): 893–898. Bibcode :1967PNAS...57..893B. doi : 10.1073/pnas.57.4.893 . ISSN 0027-8424. PMC 224631 . PMID 5231352.
- ^ Underwood, William (2012). "La pared celular de las plantas: una barrera dinámica contra la invasión de patógenos". Frontiers in Plant Science . 3 : 85. doi : 10.3389/fpls.2012.00085 . ISSN 1664-462X. PMC 3355688 . PMID 22639669.
- ^ Müller, Caroline; Riederer, Markus (2005). "Propiedades de la superficie de las plantas en ecología química". Revista de ecología química . 31 (11): 2621–2651. Código Bibliográfico :2005JCEco..31.2621M. doi :10.1007/s10886-005-7617-7. ISSN 0098-0331. PMID 16273432. S2CID 33373155.
- ^ Spiteller, Peter (2015). "Ecología química de los hongos". Natural Product Reports . 32 (7): 971–993. doi :10.1039/C4NP00166D. PMID 26038303.
- ^ Behie, SW, PM Zelisko y MJ Bidochka. 2012. Los hongos endófitos parásitos de insectos trasladan nitrógeno directamente de los insectos a las plantas. Science 336:1576–1577.
- ^ Cheng, Fang; Cheng, Zhihui (17 de noviembre de 2015). "Progreso de la investigación sobre el uso de la alelopatía vegetal en la agricultura y los mecanismos fisiológicos y ecológicos de la alelopatía". Frontiers in Plant Science . 6 . doi : 10.3389/fpls.2015.01020 . ISSN 1664-462X. PMC 4647110 . PMID 26635845.
- ^ Inderjit; Dakshini, KMM; Inderjit; Instituto Americano de Ciencias Biológicas, eds. (1995). Allelopathy: organisms, processes, and applications (Alelopatía: organismos, procesos y aplicaciones); desarrollado a partir de una reunión patrocinada por la Sección de la Sociedad Botánica de América del Instituto Americano de Ciencias Biológicas, Ames, Iowa, 1 al 5 de agosto de 1993. Serie de simposios de la ACS. Washington, DC: Sociedad Química Americana. ISBN 978-0-8412-3061-3.
- ^ Duke, SO 2010. Alelopatía: estado actual de la investigación y futuro de la disciplina: un comentario.
- ^ Willis, RJ 2000. Juglans spp., juglona y alelopatía. Allelopathy Journal 7:1–55.
- ^ Fragasso, Mariagiovanna; Iannucci, Anna; Papa, Roberto (2013). "Trigo duro y alelopatía: hacia el mejoramiento del trigo para el manejo natural de malezas". Frontiers in Plant Science . 4 . doi : 10.3389/fpls.2013.00375 . ISSN 1664-462X. PMC 3781390 . PMID 24065979.
- ^ Arimura, Gen-ichiro; Matsui, Kenji; Takabayashi, Junji (1 de mayo de 2009). "Ecología química y molecular de compuestos volátiles de plantas inducidos por herbívoros: factores próximos y sus funciones últimas". Fisiología vegetal y celular . 50 (5): 911–923. doi : 10.1093/pcp/pcp030 . ISSN 0032-0781. PMID 19246460 . Consultado el 11 de octubre de 2017 .
- ^ Heil, M. y R. Karban. 2010. Explicación de la evolución de la comunicación de las plantas mediante señales aéreas. Trends in Ecology & Evolution 25:137–144.
- ^ O'Connell, Lauren A.; LS50: Curso de laboratorio de ciencias integradas; O'Connell, Jeremy D.; Paulo, Joao A.; Trauger, Sunia A.; Gygi, Steven P.; Murray, Andrew W. (1 de febrero de 2021). "El secuestro rápido de toxinas modifica la fisiología de la rana venenosa". Revista de biología experimental . 224 (3). doi :10.1242/jeb.230342. ISSN 0022-0949. PMC 7888741 . PMID 33408255.
{{cite journal}}: CS1 maint: nombres numéricos: lista de autores ( enlace ) - ^ abc Medina-Ortiz, Katherine; Navia, Felipe; Mosquera-Gil, Claudia; Sánchez, Adalberto; Sterling, Gonzalo; Fierro, Leonardo; Castaño, Santiago (abril de 2023). "Identificación de las isoformas α de la NA+/K+-ATPasa en seis especies de ranas venenosas y su sensibilidad a los esteroides cardiotónicos". Revista de Ecología Química . 49 (3–4): 116–132. doi :10.1007/s10886-023-01404-7. ISSN 0098-0331. PMC 10102066 . PMID 36877397.
- ^ Daly, John W.; Brown, George B.; Mensah-Dwumah, Monica; Myers, Charles W. (enero de 1978). "Clasificación de alcaloides de la piel de ranas venenosas dardo neotropicales (dendrobatidae)". Toxicon . 16 (2): 163–188. Bibcode :1978Txcn...16..163D. doi :10.1016/0041-0101(78)90036-3. ISSN 0041-0101. PMID 635931.
- ^ Schmidt, Justin O. (2 de agosto de 2019). "Batalla depredador-presa de íconos ecológicos: lagartijas cornudas (Phrynosoma spp.) y hormigas cosechadoras (Pogonomyrmex spp.)". Copeia . 107 (3): 404. doi :10.1643/CP-18-158. ISSN 0045-8511.
- ^ Sherbrooke, Wade C.; Kimball, Bruce A. (22 de marzo de 2024). "Defensa antidepredadora mediante chorros de sangre en lagartijas cornudas (Phrynosoma): aislamiento químico de componentes plasmáticos, origen dietético de las hormigas Pogonomyrmex y evolución". Ictiología y herpetología . 112 (1). doi :10.1643/h2021139. ISSN 2766-1512.
- ^ ab de Roode, Jacobus C.; Huffman, Michael A. (septiembre de 2024). "Medicación animal". Current Biology . 34 (17): R808–R812. Código Bibliográfico :2024CBio...34.R808D. doi :10.1016/j.cub.2024.07.034. ISSN 0960-9822. PMID 39255760.
- ^ ab Peckre, Louise R.; Defolie, Charlotte; Kappeler, Peter M.; Fichtel, Claudia (septiembre de 2018). "Potencial automedicación utilizando secreciones de milpiés en lémures de frente roja: ¿combinando unción e ingestión para una acción conjunta contra parásitos gastrointestinales?". Primates . 59 (5): 483–494. doi :10.1007/s10329-018-0674-7. ISSN 0032-8332. PMID 30058024.
- ^ abc Bowler, Mark; Messer, Emily JE; Claidière, Nicolas; Whiten, Andrew (12 de octubre de 2015). "Medicación mutua en monos capuchinos: la unción social mejora la cobertura de los medicamentos antiparasitarios de aplicación tópica". Scientific Reports . 5 (1): 15030. Bibcode :2015NatSR...515030B. doi :10.1038/srep15030. ISSN 2045-2322. PMC 4601033 . PMID 26456539.
- ^ Valderrama, Ximena (2000). "Unción estacional con milpiés en un primate salvaje: ¿una defensa química contra los insectos?". Journal of Chemical Ecology . 26 (12): 2781–2790. Bibcode :2000JCEco..26.2781V. doi :10.1023/a:1026489826714. ISSN 0098-0331.
- ^ Carroll, JF; Kramer, M.; Weldon, PJ; Robbins, RG (enero de 2005). "QUÍMICOS DE UNCIÓN Y ECTOPÁRASITOS: EFECTOS DE LAS BENZOQUINONAS DE LOS MILPIÉS EN LA GARRAPATA DE LA ESTRELLA SOLITARIA, Amblyomma americanum". Revista de Ecología Química . 31 (1): 63–75. Bibcode :2005JCEco..31...63C. doi :10.1007/s10886-005-0974-4. ISSN 0098-0331.
- ^ ab Leber, Christopher A.; Reyes, Andres Joshua; Biggs, Jason S.; Gerwick, William H. (junio de 2021). "Colonias de cianobacterias y camarones en las Islas Marianas". Ecología acuática . 55 (2): 453–465. Bibcode :2021AqEco..55..453L. doi :10.1007/s10452-021-09837-6. ISSN 1386-2588. PMC 8223766 . PMID 34177357.
- ^ Bakus, Gerald J.; Targett, Nancy M.; Schulte, Bruce (1986). "Ecología química de los organismos marinos: una visión general". Revista de ecología química . 12 (5): 951–987. Bibcode :1986JCEco..12..951B. doi :10.1007/bf01638991. ISSN 0098-0331. PMID 24307042. S2CID 34594704.
- ^ Jones, BW; Nishiguchi, MK (1 de junio de 2004). "Contrailuminación en el calamar bobtail hawaiano, Euprymna scolopes Berry (Mollusca: Cephalopoda)". Biología Marina . 144 (6): 1151-1155. Código Bib : 2004MarBi.144.1151J. doi :10.1007/s00227-003-1285-3. ISSN 1432-1793.
- ^ ab McFall-Ngai, Margaret (noviembre de 2008). "Calamar bobtail hawaiano". Current Biology . 18 (22): R1043–R1044. Bibcode :2008CBio...18R1043M. doi :10.1016/j.cub.2008.08.059. PMID 19036327.
- ^ abc Poulin, Remington X.; Lavoie, Serge; Siegel, Katherine; Gaul, David A.; Weissburg, Marc J.; Kubanek, Julia (23 de enero de 2018). "Codificación química de la percepción del riesgo y la detección de depredadores entre los invertebrados estuarinos". Actas de la Academia Nacional de Ciencias . 115 (4): 662–667. Bibcode :2018PNAS..115..662P. doi : 10.1073/pnas.1713901115 . ISSN 0027-8424. PMC 5789921 . PMID 29311305.
- ^ "CH105: Capítulo 6 - Una breve historia de los productos naturales y la química orgánica". Química . Consultado el 15 de septiembre de 2024 .
- ^ Li, Weiming; Scott, Alexander P.; Siefkes, Michael J.; Yan, Honggao; Liu, Qin; Yun, Sang-Seon; Gage, Douglas A. (5 de abril de 2002). "Ácido biliar secretado por la lamprea marina macho que actúa como feromona sexual". Science . 296 (5565): 138–141. Bibcode :2002Sci...296..138L. doi :10.1126/science.1067797. ISSN 0036-8075. PMID 11935026. S2CID 1688247 . Consultado el 19 de octubre de 2020 .
- ^ ab Hay, Mark E. (2009). "Ecología química marina: señales y señales químicas que estructuran poblaciones, comunidades y ecosistemas marinos". Revista anual de ciencias marinas . 1 : 193–212. Bibcode :2009ARMS....1..193H. doi :10.1146/annurev.marine.010908.163708. ISSN 1941-1405. PMC 3380104 . PMID 21141035.
- ^ ab Schmidt, Ruth; Ulanova, Dana; Wick, Lukas Y; Bode, Helge B; Garbeva, Paolina (1 de noviembre de 2019). "Ecología química impulsada por microbios: pasado, presente y futuro". The ISME Journal . 13 (11): 2656–2663. Bibcode :2019ISMEJ..13.2656S. doi :10.1038/s41396-019-0469-x. ISSN 1751-7362. PMC 6794290 . PMID 31289346.
- ^ abc Witzgall, P., P. Kirsch y A. Cork. 2010. Feromonas sexuales y su impacto en el manejo de plagas. J Chem Ecol 36:80–100.
- ^ Klein, 20 de enero de 2016, K., y 13:30 horas de 2016. ¡Hasta luego, idiotas! La feromona sexual puede combatir a las lampreas destructivas.
- ^ Saini, RK, BO Orindi, N. Mbahin, JA Andoke, PN Muasa, DM Mbuvi, CM Muya, JA Pickett y CW Borgemeister. 2017. Protección de las vacas en granjas de pequeños productores en África Oriental contra las moscas tsé-tsé imitando el perfil de olor de un bóvido no huésped. PLOS Neglected Tropical Diseases 11:e0005977. Biblioteca Pública de Ciencias.
- ^ Witzgall, Peter; Kirsch, Philipp; Cork, Alan (enero de 2010). "Feromonas sexuales y su impacto en el manejo de plagas". Revista de ecología química . 36 (1): 80–100. Bibcode :2010JCEco..36...80W. doi :10.1007/s10886-009-9737-y. ISSN 0098-0331. PMID 20108027.
- ^ Khan, Z., C. Midega, J. Pittchar, J. Pickett y T. Bruce. 2011. Tecnología push-pull: un enfoque de agricultura de conservación para el manejo integrado de plagas de insectos, malezas y salud del suelo en África. Revista internacional de sostenibilidad agrícola 9:162–170. Taylor & Francis.
- ^ Caporale, LH 1995. Ecología química: una perspectiva desde la industria farmacéutica. Actas de la Academia Nacional de Ciencias 92:75–82.
- ^ Martindale, R. y RAJ Lester. 2014. Sobre el descubrimiento del canal receptor nicotínico de acetilcolina. Págs. 1–16 en RAJ Lester, ed. Nicotinic Receptors. Springer, Nueva York, NY.
- ^ abc Cueto, Mercedes; Jensen, Paul R.; Kauffman, Chris; Fenical, William; Lobkovsky, Emil; Clardy, Jon (1 de noviembre de 2001). "Pestalona, un nuevo antibiótico producido por un hongo marino en respuesta a un desafío bacteriano". Revista de productos naturales . 64 (11): 1444–1446. doi :10.1021/np0102713. ISSN 0163-3864. PMID 11720529.
- ^ Silber, Johanna; Kramer, Annemarie; Labes, Antje; Tasdemir, Deniz (21 de julio de 2016). "Del descubrimiento a la producción: biotecnología de hongos marinos para la producción de nuevos antibióticos". Marine Drugs . 14 (7): 137. doi : 10.3390/md14070137 . ISSN 1660-3397. PMC 4962027 . PMID 27455283.
- ^ ab Prasath, Krishnan Ganesh; Sethupathy, Sivasamy; Pandian, Shunmugiah Karutha (septiembre de 2019). "El análisis proteómico descubre la modulación de la vía del ergosterol, los esfingolípidos y el estrés oxidativo por el ácido mirístico que impide la formación de biopelículas y la virulencia en Candida albicans". Journal of Proteomics . 208 : 103503. doi :10.1016/j.jprot.2019.103503. PMID 31454558.
- ^ Prasad, Rajendra; Singh, Ashutosh (noviembre de 2013). "Lípidos de Candida albicans y su papel en la resistencia a múltiples fármacos". Genética actual . 59 (4): 243–250. doi :10.1007/s00294-013-0402-1. ISSN 0172-8083. PMID 23974286.
- ^ Fuqua, WC; Winans, SC; Greenberg, EP (enero de 1994). "Detección de quórum en bacterias: la familia LuxR-LuxI de reguladores transcripcionales sensibles a la densidad celular". Journal of Bacteriology . 176 (2): 269–275. doi :10.1128/jb.176.2.269-275.1994. ISSN 0021-9193. PMC 205046 . PMID 8288518.
- ^ Wyatt, TD 2009. Cincuenta años de feromonas. Nature 457:262–263. Nature Publishing Group.
- ^ abc Bergström, G. 2007. Ecología química = química + ecología. Química pura y aplicada 79:2305–2323.
- ^ Fraenkel, GS 1959. La razón de ser de las sustancias vegetales secundarias: estas extrañas sustancias químicas surgieron como un medio para proteger a las plantas de los insectos y ahora guían a los insectos hacia el alimento. Science 129:1466–1470. Asociación Estadounidense para el Avance de la Ciencia.
- ^ Ehrlich, PR y PH Raven. 1964. Mariposas y plantas: un estudio sobre coevolución. Evolution 18:586–608.
- ^ Jermy, Tibor (1984). "Evolución de las relaciones entre insectos y plantas hospedantes". The American Naturalist . 124 (5): 609–630. doi :10.1086/284302.
- ^ Jermy, Tibor (1993). "Evolución de las relaciones entre insectos y plantas: un enfoque de abogado del diablo". Entomologia Experimentalis et Applicata . 66 (1): 3–12. Bibcode :1993EEApp..66....3J. doi :10.1111/j.1570-7458.1993.tb00686.x.
- ^ Eisner, T. (4 de diciembre de 1964). "Catnip: Its Raison d'Etre". Science . 146 (3649): 1318–1320. Bibcode :1964Sci...146.1318E. doi :10.1126/science.146.3649.1318. ISSN 0036-8075. PMID 14207462. S2CID 11282193.
- ^ Eisner, Thomas; Meinwald, Jerrold (1966). "Secreciones defensivas de los artrópodos". Science . 153 (3742): 1341–1350. Bibcode :1966Sci...153.1341E. doi :10.1126/science.153.3742.1341. ISSN 0036-8075. JSTOR 1719969. PMID 17814381 . Consultado el 25 de octubre de 2020 .
- ^ "Historia e Introducción".
- ^ Brown, WL, T. Eisner y RH Whittaker. 1970. Alomonas y cairomonas: mensajeros químicos transespecíficos. BioScience 20:21–21. Oxford Academic.
- ^ Whittaker, RH y PP Feeny. 1971. Allelochemics: Chemical Interactions between Species (Aleloquímica: interacciones químicas entre especies). Science 171:757–770. Asociación Estadounidense para el Avance de la Ciencia.
- ^ Brower, LP, WN Ryerson, LL Coppinger y SC Glazier. 1968. Química ecológica y espectro de palatabilidad. Science 161:1349–1350. Asociación Estadounidense para el Avance de la Ciencia.
- ^ "Dr. Lincoln Brower". 3 de agosto de 2018.
Lectura adicional
- Berenbaum MR y Robinson GE (2003). "Comunicación química en un mundo postgenómico [artículo introductorio del coloquio]". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (Supl 2, 25 de noviembre): 14513. Bibcode :2003PNAS..10014513B. doi : 10.1073/pnas.2335883100 . PMC 304109 . PMID 14595008.
- Bergström, Gunnar (1 de enero de 2007). "Ecología química = química + ecología". Química pura y aplicada . 79 (12): 2305–2323. doi : 10.1351/pac200779122305 . ISSN 1365-3075. S2CID 86385084.
- Wajnberg, Eric; Colazza, Stefano (2013). Ecología química de los parasitoides de insectos . Blackwell. ISBN 978-1-118-40952-7.
- B. Harborne, Jeffrey (2001). "Veinticinco años de ecología química". Natural Product Reports . 18 (4): 361–379. doi :10.1039/B005311M. PMID 11548048 . Consultado el 13 de junio de 2021 .
- Hartmann, Thomas (25 de marzo de 2008). "El origen perdido de la ecología química a finales del siglo XIX". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (12): 4541–4546. doi : 10.1073/pnas.0709231105 . ISSN 0027-8424. PMC 2290813 . PMID 18218780.
- Hartmann, Thomas (1 de noviembre de 2007). "De los productos de desecho a los ecoquímicos: cincuenta años de investigación sobre el metabolismo secundario de las plantas". Fitoquímica . Lo más destacado de la evolución de la fitoquímica: 50 años de la Sociedad Fitoquímica de Europa. 68 (22): 2831–2846. Bibcode :2007PChem..68.2831H. doi :10.1016/j.phytochem.2007.09.017. ISSN 0031-9422. PMID 17980895. Consultado el 25 de abril de 2018 .
- Johns, Timothy (1 de enero de 1996). Los orígenes de la dieta y la medicina humanas: ecología química . University of Arizona Press. ISBN 978-0-8165-1687-2.
- Meinwald, Jerrold; Eisner, Thomas (25 de marzo de 2008). "Ecología química en retrospectiva y perspectiva". Actas de la Academia Nacional de Ciencias . 105 (12): 4539–4540. doi : 10.1073/pnas.0800649105 . PMC 2290750 . PMID 18353981.
- Putnam, AR (1988). "Aleloquímicos de plantas como herbicidas" Weed Technology . 2(4): 510–518.
- Raguso, Robert A.; Agrawal, Anurag A.; Douglas, Ángela E.; Jander, Georg; Kessler, André; Poveda, Katja; Thaler, Jennifer S. (marzo de 2015). "La razón de ser de la ecología química". Ecología . 96 (3): 617–630. Código Bib :2015Ecol...96..617R. doi :10.1890/14-1474.1. hdl : 1813/66778 . ISSN 0012-9658. PMID 26236859.
Enlaces externos
- Sociedad Internacional de Ecología Química
