Sistema conjugado



En química teórica , un sistema conjugado es un sistema de orbitales p conectados con electrones deslocalizados en una molécula , lo que en general reduce la energía total de la molécula y aumenta la estabilidad . Se representa convencionalmente como un sistema con enlaces simples y múltiples alternados . Pares solitarios , radicales o iones carbenio pueden ser parte del sistema, que puede ser cíclico , acíclico, lineal o mixto. El término "conjugado" fue acuñado en 1899 por el químico alemán Johannes Thiele . [1]
La conjugación es la superposición de un orbital p con otro a través de un enlace σ adyacente (en los metales de transición , pueden estar involucrados los orbitales d). [2] [a]
Un sistema conjugado tiene una región de orbitales p superpuestos, que unen las posiciones intermedias que los diagramas simples ilustran como carentes de un enlace π. Permiten una deslocalización de los electrones π a lo largo de todos los orbitales p alineados adyacentes. [3] Los electrones π no pertenecen a un solo enlace o átomo , sino a un grupo de átomos.
Las moléculas que contienen sistemas conjugados de orbitales y electrones se denominan moléculas conjugadas , que tienen orbitales p superpuestos en tres o más átomos. Algunas moléculas conjugadas orgánicas simples son el 1,3-butadieno, el benceno y los carbocationes alílicos . [4] Los sistemas conjugados más grandes se encuentran en el grafeno , el grafito , los polímeros conductores y los nanotubos de carbono .
Enlace químico en sistemas conjugados

La conjugación es posible por medio de enlaces simples y dobles alternados en los que cada átomo proporciona un orbital p perpendicular al plano de la molécula. Sin embargo, esa no es la única forma de que tenga lugar la conjugación. Siempre que cada átomo contiguo en una cadena tenga un orbital p disponible, el sistema puede considerarse conjugado. Por ejemplo, el furano es un anillo de cinco miembros con dos enlaces dobles alternados que flanquean un oxígeno . [5] El oxígeno tiene dos pares solitarios , uno de los cuales ocupa un orbital p perpendicular al anillo en esa posición, manteniendo así la conjugación de ese anillo de cinco miembros por superposición con el orbital p perpendicular en cada uno de los átomos de carbono adyacentes. El otro par solitario permanece en el plano y no participa en la conjugación.
En general, cualquier carbono o heteroátomo sp 2 o sp-hibridado , incluidos los que tienen un orbital vacío o un orbital de par solitario, pueden participar en sistemas conjugados. Sin embargo, los pares solitarios no siempre participan en un sistema conjugado. Por ejemplo, en la piridina , el átomo de nitrógeno ya participa en el sistema conjugado a través de un doble enlace formal con un carbono adyacente, por lo que el par solitario permanece en el plano del anillo en un orbital híbrido sp 2 y no participa en la conjugación. Un requisito para la conjugación es la superposición de orbitales. Por lo tanto, el sistema conjugado debe ser plano (o casi). Como consecuencia, los pares solitarios que participan en sistemas conjugados ocuparán orbitales de carácter p puro en lugar de orbitales híbridos sp n típicos de pares solitarios no conjugados.

Un modelo común para el tratamiento de moléculas conjugadas es un tratamiento de enlace de valencia compuesto/teoría de orbitales moleculares de Hückel (VB/HMOT), en el que el marco σ de la molécula se separa del sistema (o sistemas) π de la molécula ( consulte el artículo sobre los modelos sigma-pi y orbital equivalente para este modelo y un tratamiento alternativo ). Aunque el enlace σ también se puede tratar utilizando un enfoque deslocalizado, generalmente es el enlace π el que se considera cuando se invoca el enlace deslocalizado en el contexto de moléculas orgánicas simples.
Estructura sigma (σ) : la estructura σ se describe mediante un esquema de enlace estrictamente localizado y consiste en enlaces σ formados a partir de las interacciones entre orbitales atómicos hibridados sp3- , sp2- y sp- en los elementos del grupo principal (y orbitales atómicos 1s en el hidrógeno), junto con pares solitarios localizados derivados de orbitales híbridos no enlazantes llenos. La interacción que resulta en el enlace σ toma la forma de superposición cabeza con cabeza del lóbulo más grande de cada orbital híbrido (o el lóbulo esférico único de un orbital 1s de hidrógeno). Cada orbital atómico contribuye con un electrón cuando los orbitales se superponen por pares para formar enlaces σ de dos electrones, o dos electrones cuando el orbital constituye un par solitario. Estos orbitales localizados (enlazantes y no enlazantes) están todos ubicados en el plano de la molécula, con enlaces σ localizados principalmente entre núcleos a lo largo del eje internuclear.
Sistema o sistemas Pi (π) : Ortogonal al marco σ descrito anteriormente, el enlace π ocurre por encima y por debajo del plano de la molécula donde tiene lugar el enlace σ. El sistema o sistemas π de la molécula se forman por la interacción de orbitales atómicos p no hibridados en átomos que emplean hibridación sp 2 y sp. La interacción que resulta en el enlace π tiene lugar entre orbitales p que son adyacentes en virtud de un enlace σ que une los átomos y toma la forma de superposición de lado a lado de los dos lóbulos igualmente grandes que forman cada orbital p. Los átomos que tienen hibridación sp 3 no tienen un orbital p no hibridado disponible para participar en el enlace π y su presencia necesariamente termina un sistema π o separa dos sistemas π. Un orbital p base que participa en un sistema π puede contribuir con un electrón (que corresponde a la mitad de un "doble enlace" formal), dos electrones (que corresponden a un "par solitario" deslocalizado) o cero electrones (que corresponden a un orbital "vacío" formal). La unión de los sistemas π formados a partir de la superposición de más de dos orbitales p se maneja utilizando el enfoque de Hückel para obtener una aproximación de orden cero (cualitativa) de los orbitales moleculares de simetría π que resultan del enlace π deslocalizado.

Este modelo simple para el enlace químico es exitoso para la descripción de la mayoría de las moléculas de valencia normal que consisten solo en elementos del bloque s y p, aunque los sistemas que involucran enlaces deficientes en electrones, incluidos los carbocationes no clásicos, los grupos de litio y boro y los centros hipervalentes requieren modificaciones significativas en las que también se permite que los enlaces σ se deslocalicen y tal vez se traten mejor con orbitales moleculares canónicos que están deslocalizados en toda la molécula. Del mismo modo, los organometálicos del bloque d y f también se describen inadecuadamente con este modelo simple. Los enlaces en anillos pequeños tensos (como el ciclopropano o el epóxido) no se describen bien mediante una separación estricta σ/π, ya que los enlaces entre átomos en el anillo consisten en " enlaces doblados " o "enlaces banana" que están arqueados hacia afuera y son de naturaleza intermedia entre los enlaces σ y π. Sin embargo, los químicos orgánicos usan con frecuencia el lenguaje de este modelo para racionalizar la estructura y reactividad de compuestos orgánicos típicos.
Los electrones en sistemas π conjugados son compartidos por todos los átomos adyacentes hibridados sp2 y sp2 que contribuyen con orbitales atómicos p superpuestos y paralelos. Como tal, los átomos y los electrones π involucrados se comportan como un gran sistema enlazado. Estos sistemas a menudo se denominan " enlaces π de electrones k con centro n ", denotados de forma compacta con el símbolo Π.k-
n, para enfatizar este comportamiento. Por ejemplo, se dice que los electrones π deslocalizados en el anión acetato y el benceno están involucrados en Π4
3y Π6
6sistemas, respectivamente ( ver el artículo sobre enlace de cuatro electrones y tres centros ). Es importante reconocer que, en términos generales, estos enlaces multicéntricos corresponden a la ocupación de varios orbitales moleculares (OM) con diversos grados de carácter enlazante o no enlazante (el llenado de orbitales con carácter antienlazante es poco común). Cada uno está ocupado por uno o dos electrones de acuerdo con el principio de Aufbau y la regla de Hund . Las caricaturas que muestran orbitales p superpuestos, como la del benceno a continuación, muestran los orbitales atómicos p básicos antes de que se combinen para formar orbitales moleculares. De conformidad con el principio de exclusión de Pauli , los orbitales p superpuestos no dan como resultado la formación de un gran OM que contenga más de dos electrones.
La teoría de OM de Hückel es un enfoque comúnmente utilizado para obtener una imagen de orden cero de los orbitales moleculares π deslocalizados, incluido el signo matemático de la función de onda en varias partes de la molécula y las ubicaciones de los planos nodales. Es particularmente fácil de aplicar para hidrocarburos conjugados y proporciona una aproximación razonable siempre que se suponga que la molécula es plana con una buena superposición de orbitales p.
Energía de estabilización
La estimación cuantitativa de la estabilización a partir de la conjugación es notoriamente polémica y depende de las suposiciones implícitas que se hacen al comparar sistemas de referencia o reacciones. La energía de estabilización se conoce como energía de resonancia cuando se define formalmente como la diferencia de energía entre las especies químicas reales y las especies hipotéticas que presentan un enlace π localizado que corresponde a la forma de resonancia más estable . [6] Esta energía no se puede medir, y es probable que siga siendo difícil encontrar una definición precisa aceptada por la mayoría de los químicos. Sin embargo, se pueden hacer algunas afirmaciones generales. En general, la estabilización es más significativa para los sistemas catiónicos que para los neutros. Para el buta-1,3-dieno , una medida cruda de la estabilización es la energía de activación para la rotación del enlace C2-C3. Esto sitúa la estabilización por resonancia en alrededor de 6 kcal/mol. [7] La comparación de los calores de hidrogenación del 1,4-pentadieno y el 1,3-pentadieno estima un valor ligeramente más modesto de 3,5 kcal/mol. [8] A modo de comparación, el catión alilo tiene una barrera de rotación en fase gaseosa de alrededor de 38 kcal/mol, [9] una penalización mucho mayor por pérdida de conjugación. La comparación de las afinidades de iones hidruro del catión propilo y el catión alilo, corregidas por efectos inductivos, da como resultado una estimación considerablemente menor de la energía de resonancia a 20-22 kcal/mol. [10] Sin embargo, está claro que la conjugación estabiliza el catión alilo en un grado mucho mayor que el buta-1,3-dieno. En contraste con el efecto generalmente menor de la conjugación neutra, la estabilización aromática puede ser considerable. Las estimaciones para la energía de resonancia del benceno varían de alrededor de 36 a 73 kcal/mol. [11]
Generalizaciones y conceptos relacionados

Existen también otros tipos de interacciones que generalizan la idea de orbitales p interactuantes en un sistema conjugado. El concepto de hiperconjugación sostiene que ciertos enlaces σ también pueden deslocalizarse en un orbital desocupado de baja altitud de un sistema π o en un orbital p desocupado. La hiperconjugación se invoca comúnmente para explicar la estabilidad de radicales sustituidos con alquilo y carbocationes. La hiperconjugación es menos importante para las especies en las que todos los átomos satisfacen la regla del octeto, pero un estudio computacional reciente apoya la hiperconjugación como el origen de la mayor estabilidad de los alquenos con un mayor grado de sustitución ( regla de Zaitsev ). [12]
La homoconjugación [13] es una superposición de dos sistemas π separados por un grupo no conjugante, como CH 2 . Los ejemplos inequívocos son comparativamente raros en sistemas neutros, debido a un beneficio energético comparativamente menor que es fácilmente anulado por una variedad de otros factores; sin embargo, son comunes en sistemas catiónicos en los que se puede derivar un gran beneficio energético de la deslocalización de la carga positiva ( ver el artículo sobre homoaromaticidad para más detalles ). [14] Los sistemas neutros generalmente requieren geometrías restringidas que favorezcan la interacción para producir grados significativos de homoconjugación. [15] En el siguiente ejemplo, las frecuencias de estiramiento de carbonilo de los espectros IR de los respectivos compuestos demuestran homoconjugación, o falta de ella, en las moléculas del estado fundamental neutro.
Debido al carácter π parcial de los enlaces formalmente σ en un anillo de ciclopropano, también se ha obtenido evidencia de transmisión de "conjugación" a través de ciclopropanos. [16]
Dos sistemas π adecuadamente alineados cuyos extremos se encuentran en ángulos rectos pueden participar en espiroconjugación [17] o en homoconjugación a través del átomo espiro.

La vinilología es la extensión de un grupo funcional a través de un sistema de enlace orgánico conjugado, que transmite efectos electrónicos . [18]
Compuestos cíclicos conjugados


Los compuestos cíclicos pueden estar parcial o totalmente conjugados. Los anulenos , hidrocarburos monocíclicos completamente conjugados, pueden ser aromáticos, no aromáticos o antiaromáticos.
Compuestos aromáticos
Los compuestos que tienen un sistema conjugado planar monocíclico que contiene (4 n + 2) electrones π para números enteros n son aromáticos y exhiben una estabilidad inusual. El ejemplo clásico del benceno tiene un sistema de seis electrones π, que, junto con el anillo planar de enlaces σ C–C que contiene 12 electrones y enlaces σ radiales C–H que contienen seis electrones, forma el anillo de benceno termodinámicamente y cinéticamente estable , el núcleo común de los compuestos aromáticos bencenoides. Para el propio benceno, hay dos estructuras de Lewis contribuyentes conjugadas equivalentes (las llamadas estructuras de Kekulé) que predominan. [19] [20] La verdadera estructura electrónica es, por lo tanto, una combinación mecánico-cuántica (híbrido de resonancia) de estos contribuyentes, lo que da como resultado los enlaces C–C observados experimentalmente que son intermedios entre los enlaces simples y dobles y de igual fuerza y longitud. En la imagen de los orbitales moleculares, los seis orbitales atómicos p del benceno se combinan para dar seis orbitales moleculares. Tres de estos orbitales, que se encuentran a energías más bajas que el orbital p aislado y, por lo tanto, tienen un carácter de enlace neto (un orbital molecular es fuertemente enlazante, mientras que los otros dos son iguales en energía pero enlazan en menor medida) están ocupados por seis electrones, mientras que tres orbitales desestabilizados de carácter antienlazante general permanecen desocupados. El resultado es una fuerte estabilización aromática termodinámica y cinética. Ambos modelos describen anillos de densidad electrónica π por encima y por debajo del marco de enlaces σ C–C.
Compuestos no aromáticos y antiaromáticos

No todos los compuestos con enlaces dobles y simples alternados son aromáticos. El ciclooctatetraeno , por ejemplo, posee enlaces simples y dobles alternados. La molécula típicamente adopta una conformación de "bañera" . Debido a que los orbitales p de la molécula no se alinean bien en esta molécula no plana, los enlaces π están esencialmente aislados y no conjugados. La falta de conjugación permite que la molécula de 8 electrones π evite la antiaromaticidad , un efecto desestabilizador asociado con sistemas cíclicos conjugados que contienen 4 n π ( n = 0, 1, 2, ...) electrones. Este efecto se debe a la colocación de dos electrones en dos orbitales no enlazantes degenerados (o casi no enlazantes) de la molécula, lo que, además de reducir drásticamente la estabilización termodinámica de la deslocalización, obligaría a la molécula a adoptar un carácter dirradical triplete o provocaría que sufriera una distorsión de Jahn-Teller para aliviar la degeneración. Esto tiene el efecto de aumentar considerablemente la reactividad cinética de la molécula. Debido a la falta de interacciones de largo alcance, el ciclooctatetraeno adopta una conformación no plana y no es aromático en su carácter, comportándose como un alqueno típico. En contraste, se ha descubierto experimentalmente que los derivados del dicatión y dianión ciclooctatetraeno son planos, de acuerdo con la predicción de que son sistemas aromáticos estabilizados con 6 y 10 electrones π, respectivamente. Debido a que la antiaromaticidad es una propiedad que las moléculas intentan evitar siempre que sea posible, se cree que solo unas pocas especies observadas experimentalmente son antiaromáticas. El ciclobutadieno y el catión ciclopentadienilo se citan comúnmente como ejemplos de sistemas antiaromáticos.
En pigmentos
En un sistema pi conjugado, los electrones pueden capturar ciertos fotones a medida que resuenan a lo largo de una cierta distancia de orbitales p, de manera similar a cómo una antena de radio detecta fotones a lo largo de su longitud. Por lo general, cuanto más conjugado (más largo) sea el sistema pi, mayor será la longitud de onda del fotón que se puede capturar. Los compuestos cuyas moléculas contienen una cantidad suficiente de enlaces conjugados pueden absorber luz en la región visible y, por lo tanto, se ven coloridos a simple vista, generalmente de color amarillo o rojo. [21]
Muchos tintes utilizan sistemas de electrones conjugados para absorber la luz visible , lo que da lugar a colores intensos. Por ejemplo, la larga cadena de hidrocarburos conjugados del betacaroteno da lugar a su intenso color naranja. Cuando un electrón del sistema absorbe un fotón de luz de la longitud de onda adecuada , puede ascender a un nivel de energía superior. Un modelo simple de los niveles de energía lo proporciona el problema mecánico cuántico de una partícula unidimensional en una caja de longitud L, que representa el movimiento de un electrón π a lo largo de una larga cadena conjugada de átomos de carbono. En este modelo, la energía de absorción más baja posible corresponde a la diferencia de energía entre el orbital molecular ocupado más alto ( HOMO ) y el orbital molecular desocupado más bajo (LUMO). Para una cadena de n enlaces C=C o 2 n átomos de carbono en el estado fundamental molecular , hay 2 n electrones π que ocupan n orbitales moleculares, de modo que la brecha de energía es [22]
Dado que la longitud de la caja L aumenta aproximadamente linealmente con el número de enlaces C=C n , esto significa que la energía Δ E de un fotón absorbido en la transición HOMO–LUMO es aproximadamente proporcional a 1/ n . La longitud de onda del fotón λ = hc /Δ E es entonces aproximadamente proporcional a n . Aunque este modelo es muy aproximado, λ aumenta en general con n (o L ) para moléculas similares. Por ejemplo, las longitudes de onda de absorción de HOMO–LUMO para butadieno conjugado , hexatrieno y octatetraeno son 217 nm, 252 nm y 304 nm respectivamente. [23] Sin embargo, para una buena concordancia numérica de la partícula en un modelo de caja con el experimento, se deben tener en cuenta las alternancias de longitud de enlace de enlace simple/enlace doble de los polienos. [24] Alternativamente, se puede utilizar el método de Hückel que también está diseñado para modelar la estructura electrónica de sistemas conjugados.
Muchas transiciones electrónicas en sistemas π conjugados son de un orbital molecular (OM) predominantemente enlazante a un OM predominantemente antienlazante (π a π * ), pero los electrones de pares solitarios no enlazantes también pueden ser promovidos a un OM del sistema π (n a π * ) como sucede a menudo en complejos de transferencia de carga . Una transición de HOMO a LUMO es realizada por un electrón si lo permiten las reglas de selección para transiciones electromagnéticas . Los sistemas conjugados de menos de ocho enlaces dobles conjugados absorben solo en la región ultravioleta y son incoloros para el ojo humano. Con cada enlace doble agregado, el sistema absorbe fotones de mayor longitud de onda (y menor energía), y el compuesto varía de amarillo a rojo en color. Los compuestos que son azules o verdes típicamente no dependen solo de enlaces dobles conjugados.
Esta absorción de luz en el espectro ultravioleta-visible se puede cuantificar mediante espectroscopia ultravioleta-visible y constituye la base de todo el campo de la fotoquímica .
Los sistemas conjugados que se utilizan ampliamente para pigmentos y colorantes sintéticos son los compuestos diazo y azo y los compuestos de ftalocianina.
Compuestos de ftalocianina
Los sistemas conjugados no solo tienen excitaciones de baja energía en la región espectral visible, sino que también aceptan o donan electrones fácilmente. Las ftalocianinas , que, como el azul de ftalocianina BN y el verde de ftalocianina G , a menudo contienen un ion de metal de transición, intercambian un electrón con el ion de metal de transición complejado que cambia fácilmente su estado de oxidación . Los pigmentos y colorantes como estos son complejos de transferencia de carga .
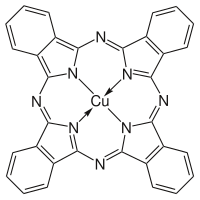
Porfirinas y compuestos similares
Las porfirinas tienen sistemas de anillos moleculares conjugados ( macrociclos ) que aparecen en muchas enzimas de sistemas biológicos. Como ligando , la porfirina forma numerosos complejos con iones metálicos como el hierro en la hemoglobina que colorea la sangre de rojo. La hemoglobina transporta oxígeno a las células de nuestro cuerpo. Los complejos de porfirina-metal a menudo tienen colores fuertes. Una unidad de anillo estructural molecular similar llamada clorina está complejada de manera similar con magnesio en lugar de hierro cuando forma parte de las formas más comunes de moléculas de clorofila , lo que les da un color verde. Otra unidad de macrociclo similar es la corrina , que forma complejos con cobalto cuando forma parte de las moléculas de cobalamina , constituyendo la vitamina B12 , que es de un rojo intenso. La unidad de corrina tiene seis dobles enlaces conjugados, pero no está conjugada en todo el recorrido de su anillo de macrociclo.
 |  |  |
| Grupo hemo de la hemoglobina | La sección de clorina de la molécula de clorofila A. El recuadro verde muestra un grupo que varía entre los tipos de clorofila . | La estructura de la cobalamina incluye un macrociclo de corrina . |
Cromóforos
Los sistemas conjugados forman la base de los cromóforos , que son partes de una molécula que absorben la luz y que pueden hacer que un compuesto adquiera color. Dichos cromóforos suelen estar presentes en diversos compuestos orgánicos y, a veces, en polímeros que están coloreados o brillan en la oscuridad. Los cromóforos suelen consistir en una serie de enlaces conjugados y/o sistemas de anillos, comúnmente aromáticos, que pueden incluir enlaces C–C, C=C, C=O o N=N.

Los cromóforos conjugados se encuentran en muchos compuestos orgánicos , incluidos los colorantes azoicos (también aditivos alimentarios artificiales ), compuestos en frutas y verduras ( licopeno y antocianidinas ), fotorreceptores del ojo y algunos compuestos farmacéuticos como los siguientes:

Las nanopartículas de polímero conjugado (PDots) se ensamblan a partir de polímeros conjugados fluorescentes hidrófobos, junto con polímeros anfifílicos para proporcionar solubilidad en agua. Los Pdots son etiquetas importantes para la microscopía de fluorescencia de moléculas individuales , basadas en un alto brillo, falta de parpadeo o fracción oscura y fotoblanqueo lento . [25] [26]
Véase también
- Polímero microporoso conjugado
- Conjugación cruzada
- Hiperconjugación
- Lista de polímeros conjugados
- Enlace metálico
- Polieno
- Resonancia
- Vinología
Notas
- ^ Para los fines de este artículo, nos ocuparemos principalmente de los orbitales deslocalizados con simetría π. Esto está en línea con el uso típico de "sistema conjugado" para referirse a la deslocalización π (y no σ). Los orbitales moleculares canónicos están completamente deslocalizados, por lo que, en cierto sentido, todos los electrones involucrados en el enlace, incluidos los que forman los enlaces σ y los pares solitarios, están deslocalizados en toda la molécula. Sin embargo, si bien tratar los electrones π como deslocalizados brinda muchos conocimientos útiles sobre la reactividad química, el tratamiento de los electrones σ y no enlazantes de la misma manera es generalmente menos rentable, excepto en casos de enlaces σ multicéntricos como los que se encuentran en compuestos en racimo de Li y B. Además, la complejidad agregada tiende a impedir la intuición química. Por lo tanto, para la mayoría de las moléculas orgánicas , los químicos suelen utilizar un modelo orbital localizado para describir los enlaces σ y los pares solitarios, mientras que superponen orbitales moleculares deslocalizados para describir el enlace π. Esta visión tiene la ventaja adicional de que existe una correspondencia clara entre la estructura de Lewis de una molécula y los orbitales utilizados para describir su enlace.
Referencias
- ^ Thiele, Johannes (1899). "Zur Kenntnis der ungesättigten Verbindungen" [[Contribución] a nuestro conocimiento de los compuestos insaturados]. Annalen der Chemie de Justus Liebig (en alemán). 306 : 87-142. doi :10.1002/jlac.18993060107.En la pág. 90, Thiele acuñó el término "conjugado": "Ein solches System benachbarter Doppelbindungen mit ausgeglichenen internalen Partialvalenzen sei als 'conjugirt' bezeichnet". (Un sistema de este tipo de dobles enlaces adyacentes con valencias parciales internas ecualizadas se denominará "conjugado".)
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "sistema conjugado (conjugación)". doi :10.1351/goldbook.C01267
- ^ March, Jerry (1985). Química orgánica avanzada: reacciones, mecanismos y estructura (3.ª ed.). Nueva York: John Wiley & Sons, Inc. ISBN 0-471-85472-7.
- ^ "16 Conjugación, resonancia y dienos". Química orgánica (PDF) (3.ª ed.). Belonia, Tripura Sur, India: Iswar Chandra Vidyasagar College . Consultado el 19 de abril de 2022 .
- ^ "1.10: Conjugación de Pi". Chemistry LibreTexts . 2014-08-01 . Consultado el 2024-10-07 .
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "resonance energy". doi :10.1351/goldbook.R05333
- ^ Feller, David; Craig, Norman C. (5 de febrero de 2009). "Energías y estructuras ab initio de alto nivel para los rotámeros de 1,3-butadieno". The Journal of Physical Chemistry A . 113 (8): 1601–1607. Bibcode :2009JPCA..113.1601F. doi :10.1021/jp8095709. PMID 19199679.
- ^ Carey, Francisco A.; Giuliano, Robert M. (7 de enero de 2013). Química orgánica (Novena ed.). Nueva York, Nueva York. ISBN 9780073402741.OCLC 822971422 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Gobbi, Alberto; Frenking, Gernot (1994-10-01). "Estabilización por resonancia en catión, radical y anión alílico". Revista de la Sociedad Química Americana . 116 (20): 9275–9286. doi :10.1021/ja00099a052. ISSN 0002-7863.
- ^ Barbour, Josiah B.; Karty, Joel M. (14 de enero de 2004). "Energías de resonancia del catión alilo y del anión alilo: contribución de los efectos de resonancia e inducción a la acidez y la entalpía de abstracción de hidruros del propeno". The Journal of Organic Chemistry . 69 (3): 648–654. doi :10.1021/jo035189m. PMID 14750787.
- ^ Cotton, Frank Albert (1990). Aplicaciones químicas de la teoría de grupos (3.ª ed.). Nueva York: Wiley. ISBN 978-0471510949.OCLC 19975337 .
- ^ Braida, Benoit; Prana, Vinca; Hiberty, Philippe C. (2009-07-20). "El origen físico de la regla de Saytzeff". Angewandte Chemie International Edition . 48 (31): 5724–5728. doi :10.1002/anie.200901923. ISSN 1433-7851. PMID 19562814.
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "homoconjugación". doi :10.1351/goldbook.H02842
- ^ Es posible que exista cierta superposición orbital incluso entre enlaces separados por uno (o más) CH 2 porque los electrones de enlace ocupan orbitales que son funciones mecánico-cuánticas y se extienden indefinidamente en el espacio. Los dibujos macroscópicos y los modelos con límites nítidos son engañosos porque no muestran este aspecto.
- ^ Scott, LT (1 de enero de 1986). "Homoconjugación cíclica en moléculas orgánicas neutras". Química pura y aplicada . 58 (1): 105–110. CiteSeerX 10.1.1.562.8748 . doi :10.1351/pac198658010105. ISSN 1365-3075. S2CID 98131188.
- ^ Stewart, John Mathews; Pagenkopf, Gordon K. (enero de 1969). "Transmisión de la conjugación por el anillo de ciclopropano". Revista de química orgánica . 34 (1): 7–11. doi :10.1021/jo00838a003. ISSN 0022-3263.
- ^ Maslak, Przemyslaw (mayo de 1994). "Espiroconjugación: una dimensión añadida en el diseño de materiales moleculares orgánicos". Materiales avanzados . 6 (5): 405–407. Bibcode :1994AdM.....6..405M. doi :10.1002/adma.19940060515. ISSN 0935-9648.
- ^ La reacción aldólica viníloga: una maniobra de formación de enlaces carbono-carbono valiosa pero discreta Giovanni Casiraghi, Franca Zanardi, Giovanni Appendino y Gloria Rassu Chem. Rev. 2000 ; 100(6) págs. 1929 - 1972; (Revisión) doi :10.1021/cr990247i
- ^ Rashid, Zahid; van Lenthe, Joop H. (marzo de 2011). "Generación de estructuras de valencia de Kekulé y la función de onda de enlace de valencia correspondiente". Journal of Computational Chemistry . 32 (4): 696–708. doi :10.1002/jcc.21655. ISSN 1096-987X. PMID 20941739. S2CID 16526798.
- ^ Si bien las dos formas de resonancia de Kekulé contribuyen a la mayor parte (>90 %) de la energía de enlace π, también hay una serie de otros contribuyentes menores a la función de onda en el tratamiento del enlace de valencia, incluidas las tres formas de resonancia de Dewar, e incluso contribuciones más pequeñas de varias formas iónicas y dirradical singlete. Consulte el artículo de Rashid y van Lenthe para obtener un tratamiento computacional reciente.
- ^ Lipton, Mark (31 de enero de 2017). "Capítulo 1. Estructura electrónica y enlace químico". Purdue: Chem 26505: Química orgánica I (Lipton) (LibreTexts ed.). Universidad de Purdue.
- ^ P. Atkins y J. de Paula Química física (8.ª ed., WHFreeman 2006), pág. 281 ISBN 0-7167-8759-8
- ^ Atkins y de Paula pág. 398
- ^ Autschbach, Jochen (noviembre de 2007). "Por qué el modelo de partículas en una caja funciona bien para los colorantes de cianina pero no para los polienos conjugados". Journal of Chemical Education . 84 (11): 1840. Bibcode :2007JChEd..84.1840A. doi :10.1021/ed084p1840. ISSN 0021-9584.
- ^ Wu C, Hansen SJ, Hou Q, Yu J, Zeigler M, Jin Y, Burnham DR, McNeill JD, Olson JM, Chiu DT (2011). "Diseño de bioconjugados de polímeros de alta emisión para la focalización de tumores in vivo". Angewandte Chemie . 50 (15): 3430–4. doi : 10.1002/anie.201007461 . PMC 3095208 . PMID 21381164.
- ^ Koner AL, Krndija D, Hou Q, Sherratt DJ, Howarth M (2013). "Las nanopartículas de polímero conjugado con terminación hidroxi tienen una fracción brillante cercana a la unidad y revelan la dependencia del colesterol de los nanodominios de IGF1R". ACS Nano . 7 (2): 1137–1144. doi : 10.1021/nn3042122 . PMC 3584654 . PMID 23330847.

