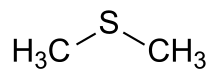
Sulfuro de dimetilo
 | |
 Modelo de relleno espacial de la estructura molecular [1] [2] | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido (Metilsulfanil)metano [3] | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 3DMet |
|
| 1696847 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.000.770 |
| Número CE |
|
| BARRIL | |
| Malla | dimetil+sulfuro |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 1164 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| ( CH3 ) 2S | |
| Masa molar | 62,13 g·mol −1 |
| Apariencia | Líquido incoloro |
| Olor | Olor: a col, sulfuroso, desagradable. |
| Densidad | 0,846 g·cm −3 |
| Punto de fusión | −98 °C; −145 °F; 175 K |
| Punto de ebullición | 35 a 41 °C; 95 a 106 °F; 308 a 314 K |
| registro P | 0,977 |
| Presión de vapor | 53,7 kPa (a 20 °C) |
| −44,9 × 10 −6 cm3 / mol | |
Índice de refracción ( n D ) | 1.435 |
| Termoquímica | |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −63,9 a −66,9 kJ⋅mol −1 |
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | −2,1812 a −2,1818 MJ⋅mol −1 |
| Peligros | |
| Etiquetado SGA : | |
   | |
| Peligro | |
| H225 , H315 , H318 , H335 | |
| P210 , P261 , P280 , P305+P351+P338 | |
| punto de inflamabilidad | -36 °C (-33 °F; 237 K) |
| 206 °C (403 °F; 479 K) | |
| Límites de explosividad | 19,7% [ aclaración necesaria ] |
| Ficha de datos de seguridad (FDS) | osha.gov |
| Compuestos relacionados | |
Calcogenuros relacionados |
|
Compuestos relacionados | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El sulfuro de dimetilo ( DMS ) o metiltiometano es un compuesto orgánico de azufre con la fórmula (CH3 ) 2S . Es el tioéter más simple y tiene un olor desagradable característico. Es un líquido inflamable que hierve a 37 °C (99 °F). Es un componente del olor producido por la cocción de ciertas verduras (especialmente maíz , repollo y remolacha ) y mariscos . También es un indicio de contaminación bacteriana en la producción de malta y la elaboración de cerveza . Es un producto de degradación del dimetilsulfoniopropionato (DMSP) y también se produce por el metabolismo bacteriano del metanotiol .
Ocurrencia y producción
El DMS se origina principalmente a partir del DMSP, un metabolito secundario importante en algunas algas marinas . [5] El DMS es el compuesto de azufre biológico más abundante emitido a la atmósfera . [6] [7] La emisión ocurre sobre los océanos por el fitoplancton . El DMS también se produce de forma natural por la transformación bacteriana de los desechos de dimetilsulfóxido (DMSO) que se eliminan en las alcantarillas, donde puede causar problemas de olores ambientales. [8]
El DMS se oxida en la atmósfera marina a varios compuestos que contienen azufre, como el dióxido de azufre , el dimetilsulfóxido (DMSO), la dimetilsulfona , el ácido metanosulfónico y el ácido sulfúrico . [9] Entre estos compuestos, el ácido sulfúrico tiene el potencial de crear nuevos aerosoles que actúan como núcleos de condensación de nubes . Por lo general, da como resultado la formación de partículas de sulfato en la troposfera. A través de esta interacción con la formación de nubes , la producción masiva de DMS atmosférico sobre los océanos puede tener un impacto significativo en el clima de la Tierra . [10] [11] La hipótesis CLAW sugiere que de esta manera el DMS puede desempeñar un papel en la homeostasis planetaria . [12]
El fitoplancton marino también produce sulfuro de dimetilo, [13] y el DMS también se produce por escisión bacteriana del DMSP extracelular. [14] El DMS se ha caracterizado como el "olor del mar", [15] aunque sería más preciso decir que el DMS es un componente del olor del mar, siendo otros derivados químicos del DMS, como los óxidos, y otros son feromonas de algas como los dictiopterenos . [16]
Entre los compuestos volátiles que emite la planta que atrae a las moscas conocida como arum de caballo muerto ( Helicodiceros muscivorus ) se encuentran el sulfuro de dimetilo, el disulfuro de dimetilo y el trisulfuro de dimetilo . Estos compuestos son componentes de un olor parecido al de la carne podrida, que atrae a varios polinizadores que se alimentan de carroña, como muchas especies de moscas. [17]
El 12 de septiembre de 2023, la NASA anunció que su investigación sobre el exoplaneta K2-18b reveló la posible presencia de sulfuro de dimetilo, y señaló que "en la Tierra, esto solo lo produce la vida". [18]
Procesos industriales
En la industria, el sulfuro de dimetilo se produce tratando sulfuro de hidrógeno con exceso de metanol sobre un catalizador de óxido de aluminio : [19]
- 2CH3OH + H2S → ( CH3 ) 2S + 2H2O
El sulfuro de dimetilo es emitido por las plantas de pulpa kraft como un producto secundario de la deslignificación.
Fisiología del sulfuro de dimetilo
El sulfuro de dimetilo normalmente está presente en niveles muy bajos en personas sanas, concretamente menos de 7 nM en sangre, menos de 3 nM en orina y entre 0,13 y 0,65 nM en el aliento espirado. [20] [21]
En concentraciones patológicamente peligrosas, esto se conoce como dimetilsulfidemia. Esta afección está asociada con halitosis transmitida por la sangre y dimetilsulfiduria. [22] [23] [24]
En personas con enfermedad hepática crónica (cirrosis), puede haber altos niveles de sulfuro de dimetilo en el aliento, lo que produce un olor desagradable ( hedor hepático ).
Olor
El sulfuro de dimetilo tiene un olor característico que comúnmente se describe como parecido al del repollo . Se vuelve altamente desagradable incluso en concentraciones bastante bajas. Algunos informes afirman que el DMS tiene un umbral olfativo bajo que varía de 0,02 a 0,1 ppm [ aclaración necesaria ] entre diferentes personas, pero se ha sugerido que el olor atribuido al sulfuro de dimetilo puede de hecho deberse a disulfuros, polisulfuros e impurezas de tiol, ya que el olor del sulfuro de dimetilo es mucho menos desagradable después de lavarlo recién hecho con cloruro de mercurio acuoso saturado. [25] El sulfuro de dimetilo también está disponible como aditivo alimentario para impartir un sabor sabroso; en tal uso, su concentración es baja. La remolacha , [26] los espárragos , [27] el repollo , el maíz y los mariscos producen sulfuro de dimetilo cuando se cocinan.
El sulfuro de dimetilo también es producido por microorganismos planctónicos marinos como los cocolitóforos y, por lo tanto, es uno de los principales componentes responsables del olor característico de los aerosoles de agua de mar , que forman parte del aire marino . En la era victoriana , antes de que se descubriera el DMS, el origen del aroma "vigorizante" del aire marino se atribuía al ozono . [28]
El sulfuro de dimetilo es el principal químico volátil producido por varias especies de trufa , y es el compuesto que los animales entrenados para descubrir el hongo (como los cerdos y los perros detectores ) detectan cuando los buscan. [29]
Usos industriales
El sulfuro de dimetilo se considera el tioéter más importante producido industrialmente. Uno de sus principales usos es la producción de sulfuro de dimetilo de borano a partir de diborano : [19]
- B2H6 +2 ( CH3 ) 2S → 2BH3 · S ( CH3 ) 2
La oxidación del sulfuro de dimetilo produce el disolvente dimetilsulfóxido . Una oxidación posterior produce dimetilsulfona .
Reacciones químicas
Como se ilustra arriba mediante la formación de su aducto con borano, el sulfuro de dimetilo es una base de Lewis. Se clasifica como un ligando blando (véase también el modelo ECW ). Forma complejos con muchos metales de transición, pero dichos aductos suelen ser lábiles. Por ejemplo, sirve como ligando desplazable en el cloro(sulfuro de dimetilo)oro(I) .
El sulfuro de dimetilo se utiliza en el tratamiento de la ozonólisis de alquenos . Reduce el intermediario trioxolano. La oxidación de Swern produce sulfuro de dimetilo mediante reducción de dimetilsulfóxido.
Con agentes clorantes como el cloruro de sulfurilo , el sulfuro de dimetilo se convierte en clorometilsulfuro de metilo :
- SO2Cl2 + ( CH3 ) 2S → SO2 + HCl + ClCH2SCH3
Al igual que otros compuestos de metiltio, el DMS se desprotona con butil litio : [30]
- CH 3 CH 2 CH 2 CH 2 Li + (CH 3 ) 2 S → CH 3 CH 2 CH 2 CH 3 + LiCH 2 SCH 3
Seguridad
El sulfuro de dimetilo es altamente inflamable . Su temperatura de ignición es de 205 °C [ se necesita aclaración ] . Es irritante para los ojos y la piel y es nocivo si se ingiere. Tiene un olor desagradable incluso en concentraciones extremadamente bajas.
Véase también
- Cocolitóforo , un alga planctónica fotosintética unicelular marina, productora de DMS
- Dimetilsulfoniopropionato , una molécula madre del DMS y el metanotiol en los océanos
- Emiliania huxleyi , un cocolitofórido productor de DMS
- Fosfina , otra molécula que está asociada a procesos biológicos y por lo tanto se utiliza como biofirma en astrobiología.
- Oxidación de Swern
- Hipótesis de Gaia
- Geosmina , la sustancia responsable del olor de la tierra
- Petricor , el aroma terroso que se produce cuando la lluvia cae sobre el suelo seco
Referencias
- ^ Moorthy, JN; Natarajan, P.; Venugopalan, P. (2010). "Entrada CSD TUYLOP: clatrato de bis(dimetilsulfuro) de 1,3,6,8-tetrakis(4-metoxi-2,6-dimetilfenil)pireno". Base de datos estructural de Cambridge : Access Structures . Centro de datos cristalográficos de Cambridge . doi :10.5517/ccscgn7 . Consultado el 3 de noviembre de 2021 .
- ^ Moorthy, JN; Natarajan, P.; Venugopalan, P. (2009). "Fenómeno de inclusión reticular abundante con tetraarilpirenos con impedimentos estéricos e inherentemente selectivos en cuanto a forma". J. Org. Chem. 74 (22): 8566–8577. doi :10.1021/jo901465f. PMID 19831423.
- ^ abc "Capítulo P-6. Aplicaciones a clases específicas de compuestos". Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. p. 706. doi :10.1039/9781849733069-00648. ISBN . 978-0-85404-182-4.
- ^ "Sulfuro de dimetilo".
- ^ Stefels, J.; Steinke, M.; Turner, S.; Malin, S.; Belviso, A. (2007). "Restricciones ambientales en la producción y remoción del gas climáticamente activo dimetilsulfuro (DMS) e implicaciones para el modelado de ecosistemas". Biogeoquímica . 83 (1–3): 245–275. Bibcode :2007Biogc..83..245S. doi : 10.1007/s10533-007-9091-5 .
- ^ Kappler, U.; Schäfer, H. (2014). "Capítulo 11. Transformaciones de dimetilsulfuro". En Kroneck, PMH; Sosa Torres, ME (eds.). La biogeoquímica impulsada por metales de compuestos gaseosos en el medio ambiente . Iones metálicos en ciencias de la vida. Vol. 14. Springer. págs. 279–313. doi :10.1007/978-94-017-9269-1_11. ISBN . 978-94-017-9268-4. Número de identificación personal 25416398.
- ^ Simpson, D.; Winiwarter, W.; Börjesson, G.; Cinderby, S.; Ferreiro, A.; Günther, A.; Hewitt, CN; Janson, R.; Khalil, MAK; Owen, S.; Pierce, TE; Puxbaum, H.; Esquilador, M.; Skiba, U.; Steinbrecher, R.; Tarrasón, L.; Öquist, MG (1999). "Inventario de emisiones de la naturaleza en Europa". Revista de investigaciones geofísicas . 104 (D7): 8113–8152. Código bibliográfico : 1999JGR...104.8113S. doi : 10.1029/98JD02747 . S2CID 54677953.
- ^ Glindemann, D.; Novak, J.; Witherspoon, J. (2006). "Residuos de dimetilsulfóxido (DMSO) y olor de aguas residuales municipales por sulfuro de dimetilo (DMS): la planta de WPCP del noreste de Filadelfia". Environmental Science and Technology . 40 (1): 202–207. Bibcode :2006EnST...40..202G. doi :10.1021/es051312a. PMID 16433352.
- ^ Lucas, DD; Prinn, RG (2005). "Análisis de la sensibilidad paramétrica y la incertidumbre de la oxidación del sulfuro de dimetilo en la capa límite marina remota en cielo despejado" (PDF) . Química y física atmosférica . 5 (6): 1505–1525. Bibcode :2005ACP.....5.1505L. doi : 10.5194/acp-5-1505-2005 .
- ^ Malin, G.; Turner, SM; Liss, PS (1992). "Azufre: la conexión entre el plancton y el clima". Revista de Ficología . 28 (5): 590–597. Código Bibliográfico :1992JPcgy..28..590M. doi :10.1111/j.0022-3646.1992.00590.x. S2CID 86179536.
- ^ Gunson, JR; Spall, SA; Anderson, TR; Jones, A.; Totterdell, IJ; Woodage, MJ (1 de abril de 2006). "Sensibilidad climática a las emisiones de dimetilsulfuro oceánico". Geophysical Research Letters . 33 (7): L07701. Bibcode :2006GeoRL..33.7701G. doi : 10.1029/2005GL024982 .
- ^ Charlson, RJ ; Lovelock, JE ; Andreae, MO; Warren, SG (1987). "Fitoplancton oceánico, azufre atmosférico, albedo de las nubes y clima". Nature . 326 (6114): 655–661. Código Bibliográfico :1987Natur.326..655C. doi :10.1038/326655a0. S2CID 4321239.
- ^ "El gas climático del que nunca has oído hablar". Revista Oceanus.
- ^ Ledyard, KM; Dacey, JWH (1994). "Producción de dimetilsulfuro a partir de dimetilsulfoniopropionato por una bacteria marina". Marine Ecology Progress Series . 110 : 95–103. Bibcode :1994MEPS..110...95L. doi : 10.3354/meps110095 .
- ^ "Clonando el olor del mar". Universidad de East Anglia. 2 de febrero de 2007. Archivado desde el original el 12 de noviembre de 2013. Consultado el 24 de mayo de 2012 .
- ^ Itoh, T.; Inoue, H.; Emoto, S. (2000). "Síntesis de dictioptereno A: tributilestannilciclopropano ópticamente activo como sintón quiral". Boletín de la Sociedad Química de Japón . 73 (2): 409–416. doi :10.1246/bcsj.73.409. ISSN 1348-0634.
- ^ Stensmyr, MC; Urru, I.; Collu, I.; Celander, M.; Hansson, BS; Angioy, A.-M. (2002). "Olor a podrido de las flores de arum de caballo muerto". Nature . 420 (6916): 625–626. Bibcode :2002Natur.420..625S. doi :10.1038/420625a. PMID 12478279. S2CID 1001475.
- ^ "Webb descubre metano y dióxido de carbono en la atmósfera de K2-18 b". 12 de septiembre de 2023. Consultado el 12 de septiembre de 2023 .
- ^ ab Roy, K.-M. (15 de junio de 2000). "Tioles y sulfuros orgánicos". Ullmann's Encyclopedia of Industrial Chemistry . pág. 8. doi :10.1002/14356007.a26_767. ISBN 978-3-527-30673-2.
- ^ Gahl, WA; Bernardini, I.; Finkelstein, JD; Tangerman, A.; Martin, JJ; Blom, HJ; Mullen, KD; Mudd, SH (febrero de 1988). "Transulfuración en un adulto con deficiencia hepática de metionina adenosiltransferasa". The Journal of Clinical Investigation . 81 (2): 390–397. doi :10.1172/JCI113331. PMC 329581 . PMID 3339126.
- ^ Tangerman, A. (15 de octubre de 2009). "Medición y significado biológico de los compuestos volátiles de azufre sulfuro de hidrógeno, metanotiol y sulfuro de dimetilo en varias matrices biológicas". Journal of Chromatography B . 877 (28): 3366–3377. doi :10.1016/j.jchromb.2009.05.026. PMID 19505855.
- ^ Tangerman, A.; Winkel, EG (septiembre de 2007). "Halitosis intra y extraoral: hallazgo de una nueva forma de halitosis extraoral transmitida por sangre causada por sulfuro de dimetilo". J. Clin. Periodontol . 34 (9): 748–755. doi :10.1111/j.1600-051X.2007.01116.x. PMID 17716310.
- ^ Tangerman, A.; Winkel, EG (marzo de 2008). "El cromatógrafo de gases portátil OralChroma: un método de elección para detectar la halitosis oral y extraoral". Journal of Breath Research . 2 (1): 017010. doi :10.1088/1752-7155/2/1/017010. PMID 21386154. S2CID 572545.
- ^ Tangerman, A.; Winkel, EG (2 de marzo de 2010). "Halitosis extraoral: una descripción general". Journal of Breath Research . 4 (1): 017003. Bibcode :2010JBR.....4a7003T. doi :10.1088/1752-7155/4/1/017003. PMID 21386205. S2CID 5342660.
- ^ Morton, TH (2000). "Archivar olores". En Bhushan, N.; Rosenfeld, S. (eds.). De moléculas y mente . Oxford: Oxford University Press. págs. 205–216.
- ^ Parliment, TH; Kolor, MG; Maing, IY (1977). "Identificación de los principales componentes volátiles de las remolachas cocidas". Journal of Food Science . 42 (6): 1592–1593. doi :10.1111/j.1365-2621.1977.tb08434.x.
- ^ U., Detlef; Hoberg, E.; Bittner, T.; Engewald, W.; Meilchen, K. (2001). "Contribución de los compuestos volátiles al sabor de los espárragos cocidos". Investigación y tecnología alimentaria europea . 213 (3): 200–204. doi :10.1007/s002170100349. S2CID 95248775.
- ^ Highfield, R. (2 de febrero de 2007). "Los secretos del aire marino 'vigorizante' embotellado por los científicos". Daily Telegraph . ISSN 0307-1235 . Consultado el 27 de marzo de 2020 .
- ^ Talou, T.; G aset, A.; Delmas, M.; Kulifaj, M.; Montant, C. (1990). "Dimetilsulfuro: ¿el secreto para la caza de trufa negra por parte de los animales?". Investigación micológica . 94 (2): 277–278. doi :10.1016/s0953-7562(09)80630-8. ISSN 0953-7562.
- ^ Reich, Hans J. (2013). "El papel de los agregados de organolitio y los agregados mixtos en los mecanismos de organolitio". Chemical Reviews . 113 (9): 7130–7178. doi :10.1021/cr400187u. PMID 23941648.
Enlaces externos
- Sulfuro de dimetilo (DMS) en el mar de Bering y aguas adyacentes: observaciones in situ y por satélite
- DMS y el clima
- Productos químicos industriales
- Flujo DMS de la NOAA



