Descubrimiento y desarrollo de agonistas beta2
Los agonistas de los receptores β2 - adrenérgicos son un grupo de fármacos que actúan selectivamente sobre los receptores β2 de los pulmones, lo que provoca broncodilatación . Los agonistas β2 se utilizan para tratar el asma y la EPOC , enfermedades que causan obstrucción de las vías respiratorias. Antes de su descubrimiento, se utilizaba el agonista beta no selectivo isoprenalina . El objetivo del desarrollo de fármacos a lo largo de los años ha sido minimizar los efectos secundarios, lograr selectividad y una mayor duración de la acción. El mecanismo de acción se entiende bien y ha facilitado el desarrollo. La estructura del sitio de unión y la naturaleza de la unión también son bien conocidas, al igual que la relación estructura-actividad .
Historia
Los agonistas β2 - selectivos se desarrollaron en el siglo XX y son una clase de fármacos muy valiosa. En 1901, Jōkichi Takamine aisló la hormona adrenalina, también conocida como epinefrina . [1] En 1890, la adrenalina se administró por primera vez a pacientes con asma por vía oral. Tuvo poco o ningún efecto porque se metaboliza en el tracto digestivo y se desactiva. En 1930, la epinefrina se administró por primera vez por vía subcutánea y se descubrió que tenía un efecto positivo sobre el asma. [1] Cuando se administra por vía subcutánea, la adrenalina afecta a todo el cuerpo, dando varios efectos secundarios y reduciendo así el valor de este tratamiento. Más tarde se probó la vía inhalatoria y dio muchos menos efectos adversos, pero aún tenía efectos secundarios inconvenientes como miedo, ansiedad, inquietud, dolor de cabeza, mareos y palpitaciones. [1]
En 1940 se descubrió el isoproterenol ( isoprenalina ). Este compuesto tenía un efecto similar a la adrenalina, pero se encontraron menos efectos secundarios. En 1949, el isoproterenol se utilizó generalmente para tratar a los pacientes con asma, administrado por vía sublingual o inhalado. [1] El primer inhalador de dosis medida presurizado se introdujo en 1956. Esto era mucho más conveniente para los pacientes que los inhaladores de pera exprimible utilizados anteriormente. La técnica del inhalador de dosis medida presurizado se desarrolló rápidamente en la década de 1970.
En 1967 se demostró que el receptor β2 era responsable de la broncodilatación, lo que condujo al desarrollo de fármacos más selectivos. [1] En 1961 se descubrió la orciprenalina, un agonista β2 de acción más prolongada , pero no tan potente como el isoproterenol. La orciprenalina no tiene la estructura de catecol , que era la razón de su mayor tiempo de acción. A mediados de los años 60 se descubrió el albuterol o salbutamol, seguido por la tributalina y el fenoterol unos años más tarde. El albuterol y la terbutalina produjeron menos efectos secundarios, como aumento de la frecuencia cardíaca, que el isoproterenol. La empresa farmacéutica Glaxo descubrió el salmeterol, un agonista β2 de acción prolongada que tenía actividad broncodilatadora durante hasta 12 horas. Se comercializó en 1990. Poco después se comercializó el formoterol, otro agonista β2 de acción prolongada . Esta larga duración de acción hizo que el tratamiento del asma grave y la EPOC fuera más cómodo para los pacientes, ya que se inhala dos veces al día. [1] En 2013, se comercializó un agonista β2 de acción extra prolongada , el vilanterol. Su duración de acción es de 24 horas, lo que debería mejorar el cumplimiento del tratamiento por parte de los pacientes y hacer que el tratamiento sea más cómodo. [2]
Uso clínico
Asma
Los agonistas β2 se utilizan para tratar el asma , una enfermedad inflamatoria de las vías respiratorias. La inflamación hace que los bronquios sean sensibles a algunos factores del entorno, lo que provoca broncoconstricción. Cuando se produce esta constricción, las vías respiratorias se estrechan y provoca síntomas como sibilancia, opresión en el pecho, dificultad para respirar y tos. Los músculos de las vías respiratorias se tensan y las células de las vías respiratorias empiezan a producir más moco de lo habitual, lo que estrecha aún más las vías respiratorias. Los síntomas suelen empezar en la infancia, pero pueden aparecer a cualquier edad. [3]
Enfermedad pulmonar obstructiva crónica
Los agonistas β2 de acción corta y prolongada se utilizan para tratar la enfermedad pulmonar obstructiva crónica . La EPOC causa limitaciones del flujo de aire en los pulmones debido a la inflamación. El tabaquismo es el principal factor de riesgo, pero la inhalación de partículas y gases tóxicos y nocivos también puede causar la enfermedad. Los síntomas son producción anormal de moco, inflación en los pulmones que causa limitación del flujo de aire, intercambio anormal de gases e hipertensión pulmonar. La EPOC es más común en personas mayores de cincuenta años que tienen un largo historial de tabaquismo. Los síntomas son leves al principio, pero empeoran con el tiempo. [4]
Usar
Existen dos tipos de agonistas β2 , de acción prolongada y de acción corta. Ambos se inhalan y se administran mediante dispositivos de administración en aerosol. [5] [6] Los agonistas β2 de acción prolongada se administran a menudo en combinación con corticosteroides para tratar el asma. Los agonistas β2 de acción corta se utilizan para tratar el asma inducida por el ejercicio, [7] y para que los pacientes con asma obtengan un alivio rápido de los síntomas. Se toman entre 10 y 15 minutos antes del ejercicio. La broncodilatación comienza pocos minutos después de la inhalación de agonistas β2 de acción corta y dura de 4 a 8 horas. [8] [9] Los agonistas β2 de acción prolongada se desaconsejan para tratar el asma aguda inducida por el ejercicio , porque su uso crónico podría enmascarar un asma mal controlada. [10]
Mecanismo de acción
Farmacocinética
La cinética de la relajación del músculo liso de las vías respiratorias, así como el inicio y la duración de la broncodilatación en pacientes asmáticos, se reflejan en la diferencia en el mecanismo de interacción de los agonistas β 2 de acción corta (SABA) y prolongada (LABA) y el receptor β 2 . [11] Existen muchas formulaciones de agonistas β 2 selectivos ; la inhalación es la vía de elección porque es la más rápidamente efectiva y se asocia con efectos secundarios mínimos. [12] Los conjugados de sulfato son los principales metabolitos ; la unión a proteínas es bastante débil y solo se han encontrado interacciones insignificantes con otros fármacos. [13] Las principales enzimas que regulan el metabolismo de las catecolaminas son COMT y MAO . Los SABA comerciales, salbutamol y terbutalina son resistentes a COMT pero son metabolizados lentamente por MAO, mientras que los LABA son resistentes tanto a COMT como a MAO. Además, la larga duración de acción del salmeterol está relacionada con una mayor lipofilicidad de las moléculas, lo que le permite permanecer durante más tiempo en los pulmones. [14] Los β 2 -agonistas se eliminan principalmente por vía renal después de la administración parenteral, mientras que después de la administración oral, un aclaramiento metabólico más pronunciado (efecto de primer paso elevado) es responsable de una baja biodisponibilidad. La eliminación después de la inhalación no se ha estudiado, pero es probable que el perfil se encuentre en algún punto entre lo que vemos después de la administración parenteral y oral. [13]
Unión a los receptores adrenérgicos β

Los receptores β son receptores unidos a la membrana acoplados a proteínas G. Se han identificado tres tipos de receptores β mediante farmacología molecular. Los receptores β 1 representan hasta el 75% de todos los receptores beta y se encuentran predominantemente en el corazón. Los receptores β 2 se encuentran en el músculo liso vascular y bronquial. Los receptores β 3 , que se presume que participan en el metabolismo de los ácidos grasos, se encuentran en los adipocitos . [15]

Los receptores acoplados a proteína G consisten en cadenas polipeptídicas simples de 300 a 600 aminoácidos y atraviesan la membrana plasmática siete veces. [16] Hay tres bucles extracelulares, uno de ellos con extremo amino , y tres bucles intracelulares con extremo carboxiterminal . [11] El bolsillo hidrofílico está formado dentro de la membrana por los siete dominios transmembrana alfa-helicoidales . El ligando se une al bolsillo hidrofílico en la proteína receptora y activa el receptor, dando lugar al efecto celular. [16]
Cuando el β 2 -agonista se une y activa el β 2 -adrenoreceptor la señalización intracelular se ve afectada en gran medida a través del monofosfato de adenosina cíclico ( cAMP ) y la proteína quinasa A ( PKA ). El acoplamiento del β 2 -receptor a la adenilato ciclasa se ve afectado a través de una proteína Gs trimérica, como se muestra en la figura 2, que consiste en una subunidad α (que estimula la adenilato ciclasa) y subunidades βγ (que transducen otras señales). La adenilato ciclasa cataliza la conversión de trifosfato de adenosina en AMPc, que es un segundo mensajero , aumentando así los niveles intracelulares de AMPc, lo que resulta en la relajación de los músculos lisos. Los niveles de AMPc se regulan a través de la actividad de las isoenzimas/isoformas de la fosfodiesterasa , que lo degradan a 5'-AMP . [11] [16] El mecanismo por el cual el AMPc induce la relajación en las células del músculo liso de las vías respiratorias no se comprende completamente. Se cree que el AMPc cataliza la activación de la PKA, que a su vez fosforila proteínas reguladoras clave involucradas en el control del tono muscular. El AMPc también tiene un papel en la inhibición de la liberación de iones de calcio (Ca 2+ ) de los depósitos intracelulares, el secuestro de Ca 2+ intracelular y la reducción de la entrada de Ca 2+ a la membrana , lo que conduce a la relajación del músculo liso de las vías respiratorias. [11]

La unión de la norepinefrina al sitio de unión consta de un enlace iónico , tres enlaces de hidrógeno y una interacción de van der Waals en dos lugares. El enlace iónico se forma entre la amina protonada y Asp-113 en la hélice 3. Los enlaces de hidrógeno se forman a partir de los grupos hidroxilo, unidos al anillo de catecol, a Ser-204 y Ser-207 en la hélice 5. Esta unión limita la libertad configuracional y rotacional. Las fuerzas de Van der Waals entre el anillo de catecol aromático y Phe-290 en el residuo de la hélice 6 y Val-114 en el residuo de la hélice 3 refuerzan la unión. Se cree que los sustituyentes N-alquilo encajan en un bolsillo hidrofóbico formado entre los residuos en la hélice 6 y 7. El carbono beta es quiral y debe tener la configuración R para que el grupo beta-hidroxilo esté orientado hacia el residuo Asn-293 en la hélice 6 para formar un enlace de hidrógeno esencial para la unión al receptor beta-2. [14]
Mecanismo de acción prolongada de los β2-agonistas
Dos teorías explican el largo tiempo de acción de los LABA. La primera explicaba la larga acción en términos de un supuesto “ exositio ” o “exoceptor” distinto del β2 - adrenorreceptor al que se une con alta afinidad la larga cola alifática del salmeterol. Esto permite que la cabeza activa de la saligenina se incline hacia adentro y hacia afuera del receptor para activarlo repetidamente. [17] El formoterol no tiene una cadena lateral larga como el salmeterol para unirse al “exositio”, por lo que esta teoría ha sido cuestionada. En 1994, Anderson et al. introdujeron la teoría microcinética de difusión del plasmalema, explicando lo que le sucede al agonista β2 en la bicapa lipídica de la membrana celular y en la biofase acuosa más cercana al sitio de unión del β2 - adrenorreceptor. Se postula que la bicapa lipídica del plasmalema de los músculos lisos de las vías respiratorias actúa como un depósito para los agonistas del β2-adrenorreceptor . Los agonistas de los receptores β2 -adrenérgicos permanecen disponibles para interactuar con el sitio activo del receptor β2 - adrenérgico después de haberse dividido en la bicapa lipídica. [17]
Relaciones estructura-actividad (SAR)
Estructura básica de los agonistas
El farmacóforo fundamental de todos los agonistas adrenérgicos es una fenetilamina sustituida que aumenta la duración de la acción. [14]
Actividad de β2-agonistas de los receptores adrenérgicos
Los agonistas adrenérgicos selectivos del subtipo β2 causan dilatación bronquial y se podría esperar que alivien el broncoespasmo de un ataque asmático. Los agonistas β no selectivos tienen efectos cardíacos estimulantes y, por lo tanto, su uso es limitado en pacientes cardíacos con asma. [14]
La administración de dosis más altas de agonistas β2 de acción corta aumenta la duración de la acción, pero también aumenta los efectos secundarios, como los efectos cardíacos. Un enfoque para evitar estos efectos secundarios es utilizar características estructuralmente diferentes que puedan minimizar la absorción en la circulación sistémica . Por ejemplo, se podrían utilizar medicamentos que se transformen en metabolitos inactivos al ingresar a la circulación sistémica. [18]
Los sustituyentes del farmacóforo influyen en si un análogo actuará de forma directa o indirecta o si será una mezcla de ambas. También influyen en la especificidad de los subtipos de receptores β. El análogo de acción directa se une directamente a los receptores β-adrenérgicos y genera una respuesta simpática . El análogo de acción indirecta causa un efecto agonista pero sin una unión directa al receptor β-adrenérgico, por ejemplo, al promover la liberación de noradrenalina (NE) desde la terminal presináptica o al inhibir la recaptación de NE liberada. [14]
Estructura básica de cada β2-agonistas

La figura 4 muestra los anillos de fenilo que se utilizan para los agonistas β2 . Se denominan anillo de resorcinol, alcohol salicílico o grupo m-formamida. [14] La figura 5 muestra dónde ocupan los distintos sustituyentes de la feniletilamina los grupos R diferentes.
Actividad de los grupos R enumerados
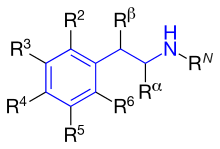
A continuación se describe la diferencia entre los sustituyentes R1-R5. Todos los agonistas β2 comercializados tienen el grupo hidroxilo en la posición R3 y, con mayor frecuencia, en la posición R5. [14]
R N : Este grupo determina la selectividad del receptor α o β. Cuanto mayor sea el sustituyente, mayor será la selectividad por el receptor β. Si el t-butilo se encuentra en R N, muestra una alta afinidad por el receptor β 2 . Un sustituyente fenilbutoxihexilo largo en esta posición proporciona una alta selectividad por el receptor β 2 y también una alta lipofilicidad y, por lo tanto, una mayor duración de la acción. [14]
R α : Los sustituyentes distintos del hidrógeno aumentarían la duración de la acción. Un grupo etilo aumentaría la selectividad por el receptor β 2 . Sin embargo, un grupo etilo parece causar mayores efectos adversos y una menor potencia del receptor β 2 en comparación con otros agonistas selectivos de β 2 . [14]
R β : Un grupo hidroxilo confiere acción directa al receptor β. Como se señaló anteriormente, todos los agonistas β 2 comercializados tienen un grupo hidroxilo en esta posición, lo que hace que el compuesto sea quiral y esté activo cuando tiene la configuración (R). [14]
R 5 o R 3 : El grupo hidroxilo colocado en el carbono número 5 o 3 ( posición meta ) confiere acción directa al receptor β-adrenérgico. [14]
R 4 : El grupo hidroxilo o el grupo hidrógeno en esta posición confieren acción directa al receptor β. [14]
Resumiendo algunos agonistas de los receptores β2 - adrenérgicos y su estructura-actividad se muestra cómo actúan de manera diferente en cuanto a potencia, selectividad, afinidad y duración de acción (ver tabla 1 ):
| Estructura química | Nombre | Descripción |
|---|---|---|
 | Epinefrina (adrenalina) | Combinación de núcleo catecol, grupo β-hidroxilo y grupo N-metilo. Estas identidades le confieren una acción directa y una fuerte afinidad por todos los receptores adrenérgicos. [14] |
 | Terbutalina | Combinación de Nt-butilo y un anillo de fenilo resorcinol que da potencia al receptor β2. [14] |
 | Albuterol (salbutamol) | Tiene un anillo de fenilo de Nt-butilo y de alcohol salicílico que le da una selectividad β2 óptima. [14] El salbutamol es un agonista β2 de acción corta, pero tiene un inicio de acción rápido. [18] Su inicio por inhalación es dentro de los 5 minutos. El grupo hidroxilo en el carbono β es una mezcla de isómeros S y R, donde el isómero R es el activo. Otro fármaco, el levalbuterol , tiene exactamente la misma estructura. Contiene solo el isómero R del albutarol y, por lo tanto, es mucho más activo y la dosis sería cuatro veces menor para el levalbuterol que para el albutarol. [14] |
 | Salmeterol | Tiene un sustituyente N-fenilbutoxihexilo, un grupo β-hidroxilo y un anillo de salicil fenilo que le confiere potencia y selectividad directa para el receptor β2. [14] La posición óptima del oxígeno del éter en la cadena del salmeterol tanto para potencia como para duración es de seis átomos de carbono desde el nitrógeno básico. [18] |
 | Formoterol | Tiene un grupo N-isopropil-p-metoxifenilo que le da acción directa a los receptores β. El formeterol también tiene un anillo m-formamida y p-hidroxifenilo, que le da selectividad a los receptores β2. El inicio de acción del formeterol es de unos 20 minutos, pero la duración de acción de 12 horas. Si se compara el formeterol con el salmeterol, tiene una mayor solubilidad en agua que le permite llegar a los sitios receptores más rápido y la lipofilicidad lo mantiene en los pulmones durante más tiempo. El formeterol tiene dos centros asimétricos. Se informa que el enantiómero R,R es 1000 veces más activo que el enantiómero S,S. [14] |
 | Vilanterol | El último fármaco en el mercado. Tiene una estructura similar al salmeterol, pero también 2,6-diclorobencilo y dos grupos alcoxi en la cadena N. Ha demostrado una selectividad similar a la del salmeterol para el receptor β2, pero una selectividad mayor en comparación con todos los demás agonistas probados. Se demostró que la actividad intrínseca es mayor que la del salmeterol. [19] El vilanterol es muy potente y tiene una alta potencia. Tiene un inicio de acción rápido y una larga duración de acción. La inclusión del grupo alcoxi adicional en la cadena lateral proporciona un potente agonista β2 que se metaboliza rápidamente en el hígado humano. El 2,6-diclorobencilo parece proporcionar mayor potencia, selectividad, inicio de acción rápido, larga duración de acción y recambio rápido. [18] |
Síntesis de β2-agonistas de los receptores adrenérgicos
Los agonistas β2 que se utilizan clínicamente son todos β-fenetilamina sustituida (ver figura 5) y tienen tres tipos de anillos de fenilo que se muestran en la figura 4. Se llaman anillo de resorcinol, anillo de alcohol salicílico o anillo de N-formamida. Los sustituyentes de alcohol en el anillo de fenilo son reactivos y complican la síntesis de los agonistas β2 . Se necesita un paso de protección mientras se agrega el residuo N en la posición R1 (figura 5). Otra cosa que complica la síntesis es obtener el enantiómero R (-) ópticamente puro del compuesto. La estereoquímica es muy importante para la actividad porque solo el enantiómero R (-) es capaz de formar los enlaces de hidrógeno necesarios para encajar en el sitio de unión y activar el receptor β2 . [ 14]
El salbutamol se suele inhalar en mezclas racémicas (por ejemplo, Ventolin). Al tratar el asma con (R)-salbutamol ópticamente puro, se puede minimizar el riesgo de efectos secundarios, como efectos estimulantes del sistema nervioso y arritmia cardíaca. [20] Existen varias rutas para la síntesis enantioselectiva , así como métodos para la síntesis de la mezcla racémica seguida de resolución quiral . [21]
La síntesis estereoselectiva de tributalina y acetal de salbutamol se puede realizar a partir de (R)-cianhidrinas O-protegidas. F. Effenberg, et al. describen una forma de síntesis. Las principales complicaciones son realizar el paso de desprotección sin racemización y formar una sal pura. Se puede utilizar una reacción de Ritter para una N-butilación terciaria. En este experimento, la desacetilación de (R)-acetal de salbutamol no tuvo éxito, por lo que no se puede utilizar para obtener (R)-salbutamol puro. La Figura 6 muestra los pasos principales en la síntesis de salmeterol y tributalina. [22]

Véase también
- Agonista beta2-adrenérgico
- Agonista alfa-adrenérgico
- Asma
- Betabloqueante
- Receptor adrenérgico beta-1
- Receptor adrenérgico beta-2
- Receptor adrenérgico beta-3
- EPOC
- Terapia de inhalación
- RGPC
- Catecolamina
Referencias
- ^ abcdef Tattersfield, AE (2006). "Cuestiones actuales con los agonistas de los receptores adrenérgicos beta2: antecedentes históricos". Am J Med . 68 (4): 471–472. doi :10.1385/CRIAI:31:2:107. PMID 17085787. S2CID 70683736.
- ^ Donohue, JF; Niewoehner, D.; Brooks, J.; O'Dell, D.; Church, A. (2014). "Seguridad y tolerabilidad de umeclidinio/vilanterol 125/25 mcg y umeclidinio 125 mcg una vez al día en pacientes con enfermedad pulmonar obstructiva crónica: resultados de un estudio aleatorizado, doble ciego y controlado con placebo de 52 semanas". Respir Res . 15 (1): 78. doi : 10.1186/1465-9921-15-78 . PMC 4113670 . PMID 25015176.
- ^ "¿Qué es el asma?". nhlbi.nih.gov . Consultado el 22 de octubre de 2014 .
- ^ Celli, BR; Macnee, W. (2006). "Estándares para el diagnóstico y tratamiento de pacientes con EPOC: resumen del documento de posición de la ATS/ERS". Revista Respiratoria Europea . 27 (1): 242. doi : 10.1183/09031936.06.00129305 .
- ^ Barner, PJ (2002). "Fundamento científico para la terapia combinada inhalada con agonistas beta2 de acción prolongada y corticosteroides". Eur Respir J . 19 (1): 182–191. doi : 10.1183/09031936.02.00283202 . PMID 11843317.
- ^ Homer, CJ (1997). "Manejo de la enfermedad del asma". N Engl J Med . 337 (20): 1461–1463. doi :10.1056/nejm199711133372010. PMID 9358146.
- ^ Lazarinis, N; Jorgensen, L; Ekstrom, T; Bjermer, L; Dahlen, B; Pulleritis, T; Larsson, K (2014). ". La combinación de budesonida/formoterol a demanda mejora el control del asma al reducir la broncoconstricción inducida por el ejercicio". Thorax . 69 (2): 130–136. doi :10.1136/thoraxjnl-2013-203557. PMC 3913208 . PMID 24092567.
- ^ McFadden, ER Jr. (1980). "Asma inducida por el ejercicio". Am J Med . 68 (4): 471–472. doi : 10.1016/0002-9343(80)90282-x . PMID 7369227.
- ^ Boulet, LP (1994). "Agonistas β2 de acción prolongada y de acción corta". Drugs . 47 (2): 207–222. doi :10.2165/00003495-199447020-00001. PMID 7512898. S2CID 46984067.
- ^ "Referencia rápida para el cuidado del asma, diagnóstico y manejo del asma" (PDF) . nhlbi.nih.gov . Instituto Nacional del Corazón, los Pulmones y la Sangre. p. 4 . Consultado el 24 de octubre de 2014 .
- ^ abcd Johnson, M (2006). "Mecanismos moleculares de la función, respuesta y regulación del receptor beta(2)-adrenérgico". J Allergy Clin Immunol . 117 (1): 18–24. doi :10.1016/j.jaci.2005.11.012. PMID 16387578.
- ^ Armstrong, DJ; Mottram, DR (2010). "Agonistas beta-2". Drogas en el deporte . 98 .
- ^ ab Hochhaus, G; Mollmann, H (1992). "Características farmacocinéticas y farmacodinámicas de los agonistas beta-2 terbutalina, salbutamol y fenoterol". Revista internacional de farmacología clínica y terapéutica . 30 (9): 342–362. PMID 1358833.
- ^ abcdefghijklmnopqrs Lemke, TL; Williams, DA; Roche, VF; Zito, SW (2013). Principios de química medicinal de Foye . Filadelfia, PA: Lippincott Williams & Wilkins. págs. 1314–1320.
- ^ Ladage, RH G; Schwinger, D; Brixius, K (2013). "Bloqueadores beta cardioselectivos: evidencia farmacológica y su influencia en la capacidad de ejercicio". Terapéutica cardiovascular . 31 (2): 76–83. doi : 10.1111/J.1755-5922.2011.00306.X . PMID 22279967.
- ^ abc King, FD (2002). Principios y práctica de la química medicinal (2.ª ed.). Cambridge, Reino Unido: The Royal Society of Chemistry. págs. 1-24.
- ^ ab Anderson, GP; Linden, A.; Rabe, KF (1994). "¿Por qué los agonistas beta-adrenérgicos de acción prolongada tienen una acción prolongada?". Eur Respir J. 7 ( 3): 569–578. doi : 10.1183/09031936.94.07030569 . PMID 7912202.
- ^ abcd Procopiou, Panayiotis A.; Barrett, Victoria J.; Bevan, Nicola J.; Biggadike, Keith; Box, Philip C.; Butchers, Peter R.; Coe, Diane M.; Conroy, Richard; Emmons, Amanda; Ford, Alison J.; Holmes, Duncan S.; Horsley, Helen; Kerr, Fern; Li-Kwai-Cheung, Anne-Marie; Looker, Brian E.; Mann, Inderjit S.; McLay, Iain M.; Morrison, Valerie S.; Mutch, Peter J.; Smith, Claire E.; Tomlin, Paula (2010). "Síntesis y relaciones estructura-actividad de agonistas de receptores adrenérgicos β de acción prolongada que incorporan inactivación metabólica: un enfoque antidrogas". Journal of Medicinal Chemistry . 53 (11): 4522–4530. doi :10.1021/jm100326d. PMID 20462258.
- ^ Slack, RJ; Barret, VJ; Morrison, VS; Sturton, RG; Emmons, AJ; Ford, AJ; Knowles, RG (2013). "Caracterización farmacológica in vitro de Vilanterol, un nuevo agonista de los receptores β2 adrenérgicos de acción prolongada con una duración de acción de 24 horas". Revista de farmacología y terapéutica experimental . 344 (1): 218–230. doi :10.1124/jpet.112.198481. PMID 23131596. S2CID 44503234.
- ^ Barberich, TJ "Método para el tratamiento del asma utilizando (R)-albuterol ópticamente puro". Google Patents . Consultado el 27 de octubre de 2014 .
- ^ Hettich, Jerome. "Química, bioquímica y aplicaciones del salbutamol". Imperial College - Departamento de Química . Consultado el 27 de octubre de 2014 .
- ^ Effenberger, Franz; Jäger, Jürgen (1997). "Síntesis de los broncodilatadores adrenérgicos (R)-terbutalina y (R)-salbutamol a partir de (R)-cianohidrinas". J. Org. Chem . 62 (12): 3867–3873. doi :10.1021/jo970032d.