Neurulación
| Neurulación | |
|---|---|
 Secciones transversales que muestran la progresión de la placa neural hasta el surco neural de abajo hacia arriba. | |
| Identificadores | |
| Malla | D054261 |
| Terminología anatómica [editar en Wikidata] | |
La neurulación se refiere al proceso de plegamiento en los embriones de vertebrados , que incluye la transformación de la placa neural en el tubo neural . [1] El embrión en esta etapa se denomina neurula .
El proceso comienza cuando la notocorda induce la formación del sistema nervioso central (SNC) al enviar señales a la capa germinal del ectodermo que se encuentra por encima de ella para formar la placa neural gruesa y plana . La placa neural se pliega sobre sí misma para formar el tubo neural , que luego se diferenciará en la médula espinal y el cerebro , y finalmente formará el sistema nervioso central. [2] Las simulaciones por computadora descubrieron que el acuñamiento celular y la proliferación diferencial son suficientes para la neurulación de los mamíferos. [3]
Diferentes porciones del tubo neural se forman mediante dos procesos diferentes, llamados neurulación primaria y secundaria, en diferentes especies. [4]
- En la neurulación primaria , la placa neural se pliega hacia adentro hasta que los bordes entran en contacto y se fusionan.
- En la neurulación secundaria , el tubo se forma ahuecando el interior de un precursor sólido.
Neurulación primaria

Inducción neuronal primaria
El concepto de inducción se originó en el trabajo de Pandor en 1817. [5] Los primeros experimentos que probaron la inducción fueron atribuidos por Viktor Hamburger [6] a descubrimientos independientes de Hans Spemann de Alemania en 1901 [7] y Warren Lewis de los EE. UU. en 1904. [8] Fue Hans Spemann quien popularizó por primera vez el término "inducción neural primaria" en referencia a la primera diferenciación del ectodermo en tejido neural durante la neurulación. [9] [10] Se llamó "primario" porque se pensó que era el primer evento de inducción en la embriogénesis. El experimento ganador del premio Nobel fue realizado por su estudiante Hilda Mangold . [9] El ectodermo de la región del labio dorsal del blastoporo de un embrión de salamandra en desarrollo se trasplantó a otro embrión y este tejido "organizador" "indujo" la formación de un eje secundario completo cambiando el tejido circundante en el embrión original de tejido ectodérmico a neural. Por lo tanto, se denominó al tejido del embrión donante como inductor, ya que indujo el cambio. [9] Si bien el organizador es el labio dorsal del blastoporo, no se trata de un conjunto de células, sino de un grupo de células en constante cambio que migran sobre el labio dorsal del blastoporo formando células en botella constreñidas apicalmente. En cualquier momento dado durante la gastrulación habrá diferentes células que conformarán el organizador. [11]
Los trabajos posteriores sobre inductores realizados por científicos durante el siglo XX demostraron que no solo el labio dorsal del blastoporo podía actuar como inductor, sino también una gran cantidad de otros elementos aparentemente no relacionados. Esto comenzó cuando Johannes Holtfreter descubrió que el ectodermo hervido aún podía inducir . [12] Elementos tan diversos como el pH bajo, el AMP cíclico e incluso el polvo del piso podían actuar como inductores, lo que provocó una consternación considerable. [13] Incluso el tejido que no podía inducir cuando estaba vivo podía inducir cuando se hervía. [14] Otros elementos como la manteca de cerdo, la cera, las cáscaras de plátano y la sangre de rana coagulada no inducían. [15] Los biólogos moleculares del desarrollo emprendieron la búsqueda de una molécula inductora de base química y continuó creciendo una vasta literatura de elementos que demostraban tener capacidades inductoras. [16] [17] Más recientemente, la molécula inductora se ha atribuido a los genes y en 1995, hubo un llamado para que todos los genes involucrados en la inducción neuronal primaria y todas sus interacciones se catalogaran en un esfuerzo por determinar "la naturaleza molecular del organizador de Spemann". [18] También se han invocado otras proteínas y factores de crecimiento como inductores, incluidos factores de crecimiento solubles como la proteína morfogenética ósea y un requisito de "señales inhibidoras" como noggin y folistatina .
Incluso antes de que se popularizara el término inducción, varios autores, comenzando por Hans Driesch en 1894, [19] sugirieron que la inducción neuronal primaria podría ser de naturaleza mecánica. En 1985, GW Brodland y R. Gordon propusieron un modelo basado en la mecanoquímica para la inducción neuronal primaria . [20] Se ha demostrado que una onda física real de contracción se origina en la ubicación precisa del organizador de Spemann que luego atraviesa el presunto epitelio neuronal [21] y en 2006 se propuso un modelo de trabajo completo de cómo se producen las inducciones neuronales primarias. [22] [23] Durante mucho tiempo ha habido una renuencia general en el campo a considerar la posibilidad de que la inducción neuronal primaria pueda iniciarse por efectos mecánicos. [24] Aún queda por encontrar una explicación completa para la inducción neuronal primaria.
Cambio de forma
A medida que avanza la neurulación después de la inducción, las células de la placa neural se vuelven columnares altas y pueden identificarse a través de la microscopía como diferentes del ectodermo epitelial presunto circundante ( endodermo epiblástico en amniotas). Las células se mueven lateralmente y se alejan del eje central y cambian a una forma de pirámide truncada. Esta forma de pirámide se logra a través de la tubulina y la actina en la porción apical de la célula que se contrae a medida que se mueven. La variación en las formas de las células está parcialmente determinada por la ubicación del núcleo dentro de la célula, lo que provoca abultamiento en áreas de las células que obligan a cambiar la altura y la forma de la célula. Este proceso se conoce como constricción apical . [25] [26] El resultado es un aplanamiento de la placa neural diferenciadora que es particularmente obvio en las salamandras cuando la gástrula previamente redonda se convierte en una bola redondeada con una parte superior plana. [27] Ver placa neural .
Plegable
El proceso por el cual la placa neural plana se pliega para formar el tubo neural cilíndrico se denomina neurulación primaria . Como resultado de los cambios en la forma celular, la placa neural forma el punto de articulación medial (PMM). La epidermis en expansión ejerce presión sobre el PAM y hace que la placa neural se pliegue, lo que da lugar a pliegues neurales y a la creación del surco neural . Los pliegues neurales forman puntos de articulación dorsolateral (PDL) y la presión sobre esta articulación hace que los pliegues neurales se junten y se fusionen en la línea media. La fusión requiere la regulación de las moléculas de adhesión celular. La placa neural cambia de la expresión de E-cadherina a la expresión de N-cadherina y N-CAM para reconocerse entre sí como el mismo tejido y cerrar el tubo. Este cambio en la expresión detiene la unión del tubo neural a la epidermis.
La notocorda desempeña un papel fundamental en el desarrollo del tubo neural. Antes de la neurulación, durante la migración de las células del endodermo epiblástico hacia el endodermo hipoblástico, el proceso notocordal se abre en un arco denominado placa notocordal y se adhiere al neuroepitelio suprayacente de la placa neural. La placa notocordal actúa entonces como un ancla para la placa neural y empuja los dos bordes de la placa hacia arriba mientras mantiene anclada la sección media. Algunas de las células notocordales se incorporan a la placa neural de la sección central para formar posteriormente la placa del suelo del tubo neural. La placa notocordal se separa y forma la notocorda sólida. [4]
El plegado del tubo neural para formar un tubo real no ocurre de una sola vez. En cambio, comienza aproximadamente a nivel del cuarto somita en la etapa de Carnegie 9 (alrededor del día embrionario 20 en humanos ). Los bordes laterales de la placa neural se tocan en la línea media y se unen. Esto continúa tanto cranealmente (hacia la cabeza) como caudalmente (hacia la cola). Las aberturas que se forman en las regiones craneal y caudal se denominan neuroporos craneales y caudales . En los embriones humanos , el neuroporo craneal se cierra aproximadamente el día 24 y el neuroporo caudal el día 28. [28] La falla del cierre del neuroporo craneal (superior) y caudal (inferior) da como resultado afecciones llamadas anencefalia y espina bífida , respectivamente. Además, la falla del cierre del tubo neural a lo largo del cuerpo da como resultado una afección llamada raquisquisis . [29]
Patrones
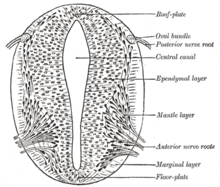
Según el modelo de la bandera francesa, en el que las etapas del desarrollo están dirigidas por gradientes de productos genéticos, varios genes se consideran importantes para inducir patrones en la placa neural abierta, especialmente para el desarrollo de placodas neurogénicas . Estas placodas se hacen evidentes por primera vez histológicamente en la placa neural abierta. Después de que la señalización de Sonic Hedgehog (SHH) de la notocorda induce su formación, la placa del suelo del tubo neural incipiente también secreta SHH. Después del cierre, el tubo neural forma una placa basal o del suelo y una placa del techo o alar en respuesta a los efectos combinados de SHH y factores que incluyen BMP4 secretados por la placa del techo. La placa basal forma la mayor parte de la porción ventral del sistema nervioso, incluida la porción motora de la médula espinal y el tronco encefálico; la placa alar forma las porciones dorsales, dedicadas principalmente al procesamiento sensorial. [30]
La epidermis dorsal expresa BMP4 y BMP7 . La placa del techo del tubo neural responde a esas señales expresando más BMP4 y otras señales del factor de crecimiento transformante beta (TGF-β) para formar un gradiente dorsal/ventral en el tubo neural. La notocorda expresa SHH. La placa del suelo responde a SHH produciendo su propia SHH y formando un gradiente. Estos gradientes permiten la expresión diferencial de factores de transcripción. [30]
Complejidades del modelo
El cierre del tubo neural no se entiende del todo. El cierre del tubo neural varía según la especie. En los mamíferos, el cierre se produce al encontrarse en múltiples puntos que luego se cierran hacia arriba y hacia abajo. En las aves, el cierre del tubo neural comienza en un punto del mesencéfalo y se mueve hacia delante y hacia atrás. [31] [32]
Neurulación secundaria
La neurulación primaria se transforma en neurulación secundaria cuando el neuroporo caudal experimenta el cierre final. La cavidad de la médula espinal se extiende hacia el cordón neural. [33] En la neurulación secundaria, el ectodermo neural y algunas células del endodermo forman el cordón medular . El cordón medular se condensa, se separa y luego forma cavidades. [34] Estas cavidades luego se fusionan para formar un solo tubo. La neurulación secundaria ocurre en la sección posterior de la mayoría de los animales, pero se expresa mejor en las aves. Los tubos de la neurulación primaria y secundaria finalmente se conectan alrededor de la sexta semana de desarrollo. [35]
En los seres humanos, los mecanismos de neurulación secundaria desempeñan un papel importante debido a su impacto en la formación adecuada de la médula espinal posterior. Los errores en cualquier punto del proceso pueden generar problemas. Por ejemplo, la retención de la médula espinal se produce debido a una detención parcial o completa de la neurulación secundaria que crea una porción no funcional en el extremo vestigial. [36]
Desarrollo cerebral temprano
La porción anterior del tubo neural forma las tres partes principales del cerebro: el prosencéfalo ( prosencéfalo ), el mesencéfalo ( mesencéfalo ) y el rombencéfalo ( rombencéfalo ). [37] Estas estructuras aparecen inicialmente justo después del cierre del tubo neural como protuberancias llamadas vesículas cerebrales en un patrón especificado por los genes de patrón anteroposterior, incluidos los genes Hox , otros factores de transcripción como los genes Emx, Otx y Pax, y factores de señalización secretados como los factores de crecimiento de fibroblastos (FGF) y Wnts . [38] Estas vesículas cerebrales se dividen aún más en subregiones. El prosencéfalo da lugar al telencéfalo y al diencéfalo , y el rombencéfalo genera el metencéfalo y el mielencéfalo . El rombencéfalo, que es la parte evolutivamente más antigua del cerebro cordado , también se divide en diferentes segmentos llamados rombómeros . Los rombómeros generan muchos de los circuitos neuronales más esenciales necesarios para la vida, incluidos los que controlan la respiración y la frecuencia cardíaca, y producen la mayoría de los nervios craneales . [37] Las células de la cresta neural forman ganglios por encima de cada rombómero. El tubo neural temprano está compuesto principalmente por el neuroepitelio germinal , más tarde llamado zona ventricular , que contiene células madre neuronales primarias llamadas células gliales radiales y sirve como la principal fuente de neuronas producidas durante el desarrollo del cerebro a través del proceso de neurogénesis . [39] [40]
Tejido ectodérmico no neuronal
El mesodermo paraxial que rodea la notocorda por los lados se desarrollará en los somitas (futuros músculos y huesos, y contribuye a la formación de las extremidades del vertebrado ). [41]
Células de la cresta neural
Las masas de tejido llamadas cresta neural , que se encuentran en los bordes de las placas laterales del tubo neural plegable, se separan del tubo neural y migran para convertirse en una variedad de células diferentes pero importantes. [ cita requerida ]
Las células de la cresta neural migrarán a través del embrión y darán lugar a varias poblaciones celulares, incluidas las células pigmentarias y las células del sistema nervioso periférico. [ cita requerida ]
Defectos del tubo neural
La falla de la neurulación, especialmente la falla del cierre del tubo neural, se encuentra entre los defectos congénitos más comunes y discapacitantes en los seres humanos, y ocurre aproximadamente en 1 de cada 500 nacidos vivos. [42] La falla del extremo rostral del tubo neural para cerrarse resulta en anencefalia , o falta de desarrollo cerebral, y es más a menudo fatal. [43] La falla del extremo caudal del tubo neural para cerrarse causa una condición conocida como espina bífida , en la cual la médula espinal no se cierra. [44]
Véase también
Referencias
- ^ Larsen WJ. Embriología humana. Tercera edición, 2001. Pág. 86. ISBN 0-443-06583-7
- ^ "Capítulo 14. Gastrulación y neurulación". biology.kenyon.edu . Consultado el 2 de febrero de 2016 .
- ^ Nielsen, Bjarke Frost; Nissen, Silas Boye; Sneppen, Kim; Mathiesen, Joachim; Trusina, Ala (21 de febrero de 2020). "Modelo para vincular la forma y polaridad celular con la organogénesis". iScience . 23 (2): 100830. Bibcode :2020iSci...23j0830N. doi : 10.1016/j.isci.2020.100830 . PMC 6994644 . PMID 31986479.
- ^ ab Wolpert, Lewis; Tickle, Cheryll; Arias, Alfonso Martínez (2015). Principios del desarrollo (Quinta edición). Oxford, Reino Unido: Oxford University Press. p. 393. ISBN 9780198709886.
- ^ Tiedemann, H. Enfoque químico de los agentes inductores. En: O. Nakamura y S. Toivonen (eds.), Organizador: un hito de medio siglo de Spemann, Ámsterdam: Elsevier/North Holland Biomedical Press, pág. 91-117. 1978
- ^ Hamburger, V.. La herencia de la embriología experimental: Hans Spemann y el organizador. Nueva York: Oxford University Press. 1988
- ^ Spemann, H. Über Korrelationen in der Entwicklung des Auges/Sobre las correlaciones en el desarrollo del ojo. Verh. anat. Ges. Jena 15, 61-79. 1901
- ^ Lewis, WH Estudios experimentales sobre el desarrollo del ojo en anfibios. I. Sobre el origen del cristalino en Rana palustris. Amer. J. Anat. 3, 505-536. 1904
- ^ abc Spemann, H. & H. Mangold, Über Induktion von Embryonalanlagen durch Implantation artfremder Organisatoren / Sobre la inducción de análagos embrionarios mediante la implantación de organizadores de otras especies. Microscopio de archivo. anat. Entwicklungsmech. 100, 599-638 1924
- ^ Spemann, H. & H. Mangold 1924: Inducción de primordios embrionarios mediante implantación de organizadores de una especie diferente. En: BH Willier & JM Oppenheimer (eds.), Foundations of Experimental Embryology, (traducido en la edición de 1964), Englewood Cliffs, Nueva Jersey: Prentice-Hall, págs. 144-184
- ^ Gordon, R., NK Björklund y PD Nieuwkoop. Diálogo sobre las ondas de inducción y diferenciación embrionaria. Int. Rev. Cytol. 150, 373-420. 1994
- ^ Holtfreter, J. Eigenschaften und Verbreitung induzierender Stoffe/Características y difusión de sustancias inductoras. Naturwissenschaften 21, 766-770. 1933
- ^ Twitty, VC, De científicos y salamandras Freeman, San Francisco, CA.1966
- ^ Spemann, H., FG Fischer & E. Wehmeier Fortgesetzte Versuche zur Analyse der Induktionsmittel in der Embryonalentwicklung/Intentos continuos de análisis de la causa de los medios de inducción en el desarrollo embrionario. Natuwissenschaften 21, 505-506. 1933
- ^ Weiss, PA. El llamado organizador y el problema de la organización en el desarrollo de los anfibios. Physiol. Rev. 15(4), 639-674. 1935
- ^ De Robertis, EM, M. Blum, C. Niehrs y H. Steinbeisser, Goosecoid y el organizador. Desarrollo (Supl.), 167-171. 1992
- ^ Hahn, M. & H. Jäckle El goosecoid de Drosophila participa en el desarrollo neuronal pero no en la formación del eje corporal. EMBO J. 15(12), 3077-3084. 1996
- ^ De Robertis, EM Desmantelando el organizador. Nature 374(6521), 407-408. 1995
- ^ Driesch, AEH. Analytische Theorie der Organischen Entwicklung/Teoría analítica del desarrollo orgánico. Leipzig: Verlag von Wilhelm Engelman. 1984
- ^ Gordon, R. Brodland, GW. La mecánica citoesquelética de la morfogénesis cerebral: los separadores de estados celulares causan inducción neuronal primaria. Gell Biophys. 11: 177-238. (1987)
- ^ Brodland, GW” Gordon, R, Scott MJ, Bjorklund NK, Luchka KB, Martin, CC, Matuga, C., Globus, M., Vethamany-Globus S. y Shu, D. Onda de contracción de la superficie de surco coincidente con la inducción neural primaria en embriones de anfibios. J Morphol. 219: 131-142. 1994
- ^ Gordon, NK, Gordon R El orgánulo de la diferenciación en embriones: el divisor del estado celular Theor Biol Med Model (2016) 13: 11. https://doi.org/10.1186/s12976-016-0037-2
- ^ Björklund, NK, Gordon, RA Hipótesis que vincula la baja ingesta de folato con defectos del tubo neural debido a la falla de las metilaciones postraduccionales del citoesqueleto International Journal of Developmental Biology 50 (2-3), 135-141
- ^ El genoma jerárquico y las ondas de diferenciación. Serie en biología matemática y medicina. Vol. 3. World Scientific Publishing Company. 1999. doi :10.1142/2755. ISBN 978-981-02-2268-0.
- ^ Burnside. MB Microrúbulos y microfilamentos en la neurulación de anfibios. Alii. Zool. 13, 989-1006 1973
- ^ Jacobson, AG y R. Gordon. Cambios en la forma del sistema nervioso de vertebrados en desarrollo analizados experimentalmente, matemáticamente y mediante simulación por computadora. J. Exp. Zool. 197, 191-246. 1973
- ^ Bordzilovskaya, NP, TA Dettlaff, ST Duhon y GM Malacinski (1989). Serie de estadios de desarrollo de embriones de axolote [Fe de erratas: la tabla de estadios 19-1 corresponde a 20 °C, no a 29 °C]. En: JB Armstrong y GM Malacinski (eds.), Biología del desarrollo del axolote, Nueva York: Oxford University Press, pág. 201-219.
- ^ Youman's Neurological Surgery, H. Richard Winn, 6.ª ed., volumen 1, pág. 81, 2011 Elsevier Saunders, Filadelfia, PA
- ^ Gilbert, SF (2000). "12: Formación del tubo neural". Biología del desarrollo (6.ª ed.). Sunderland, MA: Sinauer Associates. ISBN 978-0-87893-243-6. Recuperado el 30 de noviembre de 2011 .
- ^ ab Gilbert, SF (2013). "10: Emergencia del ectodermo". Biología del desarrollo (10.ª ed.). Sunderland, MA: Sinauer Associates. ISBN 978-0-87893-978-7. Recuperado el 22 de marzo de 2015 .
- ^ Golden JA, Chernoff G F. Patrón intermitente de cierre del tubo neural en dos cepas de ratones. Teratología. 1993;47:73–80.
- ^ Van Allen MI, 15 otros Evidencia de cierre de múltiples sitios del tubo neural en humanos. Am. J. Med. Genet. 1993;47:723–743.
- ^ Shepard, Thomas H. (1989). "Etapas de desarrollo en embriones humanos. R. O'Rahilly y F. Müller (Eds), Carnegie Institution of Washington, Washington, DC, 1987, 306 pp., $52". Teratology . 40 : 85. doi :10.1002/tera.1420400111.
- ^ Formación del tubo neural Biología del desarrollo Biblioteca del NCBI
- ^ Shimokita, E; Takahashi, Y (abril de 2011). "Neurulación secundaria: mapeo del destino y manipulación genética del tubo neural en el brote de la cola". Desarrollo, crecimiento y diferenciación . 53 (3): 401–10. doi : 10.1111/j.1440-169X.2011.01260.x . PMID 21492152.
- ^ Pang, Dachling; Zovickian, John (2011). «"Cordón medular retenido en humanos: detención tardía de la neurulación secundaria"». Neurocirugía . 68 (6): 1500–19. doi :10.1227/NEU.0b013e31820ee282. PMID 21336222. S2CID 25638763 . Consultado el 19 de noviembre de 2020 .
- ^ ab Gilbert, Scott F.; College, Swarthmore; Helsinki, la Universidad de (2014). Biología del desarrollo (décima edición). Sunderland, Mass.: Sinauer. ISBN 978-0878939787.
- ^ Eric R. Kandel, ed. (2006). Principios de la neurociencia (5.ª ed.). Appleton y Lange: McGraw Hill. ISBN 978-0071390118.
- ^ Rakic, P (octubre de 2009). "Evolución del neocórtex: una perspectiva desde la biología del desarrollo". Nature Reviews. Neuroscience . 10 (10): 724–35. doi :10.1038/nrn2719. PMC 2913577 . PMID 19763105.
- ^ Dehay, C; Kennedy, H (junio de 2007). "Control del ciclo celular y desarrollo cortical". Nature Reviews. Neuroscience . 8 (6): 438–50. doi :10.1038/nrn2097. PMID 17514197. S2CID 1851646.
- ^ Mesodermo paraxial: los somitas y sus derivados NCBI Bookshelf, Biología del desarrollo, sexta edición. Consultado el 29 de noviembre de 2017
- ^ Daley, Darrel. Formación del sistema nervioso. Archivado el 3 de enero de 2008 en Wayback Machine . Último acceso el 29 de octubre de 2007.
- ^ Referencia, Genetics Home. "Anencefalia". Referencia de Genetics Home . Consultado el 2 de marzo de 2020 .
- ^ CDC (31 de agosto de 2018). «Datos sobre la espina bífida | CDC». Centros para el Control y la Prevención de Enfermedades . Consultado el 2 de marzo de 2020 .
Lectura adicional
- Almeida, Karla L.; et al. (2010). "Neural Induction". En Henning, Ulrich (ed.). Perspectivas de las células madre: desde herramientas para estudiar los mecanismos de diferenciación neuronal hasta la terapia . Springer. ISBN 978-90-481-3374-1.
- Basch, Martín L.; Bonner-Fraser, Marianne (2006). "Señales inductoras de la cresta neural". En Saint-Jennet, Jean-Pierre (ed.). Inducción y diferenciación de la cresta neural. Saltador. ISBN 978-0-387-35136-0.
- Harland, Richard M. (1997). "Inducción neuronal en Xenopus". En Cowan, W. Maxwell (ed.). Enfoques moleculares y celulares del desarrollo neuronal . Oxford University Press. ISBN 978-0-19-511166-8.
- Ladher, Raj; Schoenwolf, Gary C. (2004). "Making a neural tube". En Jacobson, Marcus; Rao, Mahendra S. (eds.). Neurobiología del desarrollo . Springer. ISBN 978-0-306-48330-1.
- Tian, Jing; Sampath, Karuna (2004). "Formación y funciones de la placa del suelo". En Gong, Zhiyuan; Korzh, Vladimir (eds.). Desarrollo y genética de los peces: los modelos de pez cebra y medaka . World Scientific. págs. 123, 139–140. ISBN 978-981-238-821-6.
- Zhang, Su-Chun (2005). "Especificación neuronal a partir de células madre embrionarias humanas". En Odorico, John S.; et al. (eds.). Células madre embrionarias humanas . Garland Science. ISBN 978-1-85996-278-7.
Enlaces externos
- Descripción general en uvm.edu
- Animación de neurulación Archivado el 3 de marzo de 2016 en Wayback Machine