Diamanteide
En química, los diamantoides son generalizaciones de la molécula de jaula de carbono conocida como adamantano (C 10 H 16 ), la estructura de jaula unitaria más pequeña de la red cristalina del diamante . Los diamantoides, también conocidos como nanodiamantes o adamantanos condensados, pueden incluir una o más jaulas (adamantano, diamantano , triamantano y polimantanos superiores), así como numerosas variantes isoméricas y estructurales de adamantanos y polimantanos. Estos diamantoides se producen de forma natural en depósitos de petróleo y se han extraído y purificado en grandes cristales puros de moléculas de polimantano que tienen más de una docena de jaulas de adamantano por molécula. [1] Estas especies son de interés como aproximaciones moleculares de la estructura cúbica del diamante , terminada con enlaces C−H.
Ejemplos

Algunos ejemplos incluyen:
- Adamantano (C 10 H 16 )
- Iceano (C 12 H 18 )
- BC - 8 ( C14H20 )
- Diamantano (C 14 H 20 ) también diadamantano , dos jaulas fusionadas en las caras
- Triamantane (C 18 H 24 ), también triadamantano . El diamantano tiene cuatro caras idénticas disponibles para anclar una nueva unidad C 4 H 4 .
- Isotetramantano (C 22 H 28 ). El triamantano tiene ocho caras a las que se puede añadir una nueva unidad C 4 H 4 , lo que da lugar a cuatro isómeros . Uno de estos isómeros presenta una torsión helicoidal y, por tanto, es proquiral . Se han separado los enantiómeros P y M.
- El pentamantano tiene nueve isómeros con fórmula química C 26 H 32 y existe un pentamantano más con fórmula química C 25 H 30
- Ciclohexamantano (C 26 H 30 ) [2]
- Superadamantano (C 30 H 36 )
Un isómero de tetramantano es el diamantoide más grande jamás preparado por síntesis orgánica usando una reacción de ceto- carbenoide para unir anillos de ciclopentano. [3] Se han formado diamantoides más largos a partir del ácido dicarboxílico de diamantano. [4] El primer aislamiento de una amplia gama de diamantoides del petróleo se llevó a cabo en los siguientes pasos: [1] una destilación al vacío por encima de 345 °C, el punto de ebullición atmosférico equivalente , luego pirólisis a 400 a 450 °C para eliminar todos los compuestos no diamantoides (los diamantoides son termodinámicamente muy estables y sobrevivirán a esta pirólisis) y luego una serie de técnicas de separación por cromatografía líquida de alto rendimiento .
En un estudio, un compuesto de tetramantano está equipado con grupos tiol en las posiciones de la cabeza de puente. [5] Esto permite su anclaje a una superficie de oro y la formación de monocapas autoensambladas (diamante sobre oro).
La química orgánica de los diamantoides se extiende incluso al pentamantano . [6] Se calcula que la posición medial (base) en esta molécula (el isómero [1(2,3)4]pentamantano) produce un carbocatión más favorable que la posición apical (arriba) y la bromación simple del pentamantano 1 con bromo exclusivamente da el derivado bromo medial 2 que, por hidrólisis en agua y DMF, forma el alcohol 3 .
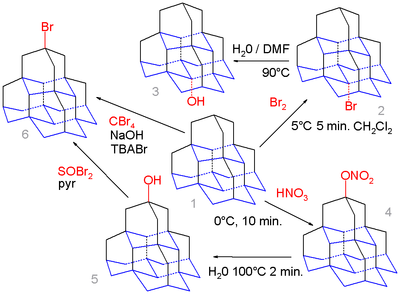
Por el contrario, la nitrooxilación de 1 con ácido nítrico produce el nitrato apical 4 como intermedio, que se hidroliza al alcohol apical 5 debido a la mayor demanda estérica del NO electrófilo activo. −
2HNO+
3especies. Este alcohol puede reaccionar con bromuro de tionilo para formar el bromuro 6 y en una serie de pasos (no mostrados) para formar el tiol correspondiente . El pentamantano también puede reaccionar con tetrabromometano y bromuro de tetra- n -butilamonio (TBABr) en una reacción de radicales libres para formar el bromuro, pero sin selectividad.
Origen y ocurrencia
Los diamantoides se encuentran en fluidos petrolíferos maduros de alta temperatura (aceites volátiles, condensados y gases húmedos). Estos fluidos pueden tener hasta una cucharada de diamantoides por galón estadounidense (3,78 litros). Una revisión realizada por Mello y Moldowan en 2005 mostró que, si bien el carbono en los diamantes no es de origen biológico, los diamantoides que se encuentran en el petróleo están compuestos de carbono de fuentes biológicas. Esto se determinó comparando las proporciones de los isótopos de carbono presentes. [7]
Propiedades ópticas y electrónicas
La absorción óptica de todos los diamantoides se encuentra en la profundidad de la región espectral ultravioleta , con brechas de banda ópticas de alrededor de 6 electronvoltios y más. [8] Se ha descubierto que el espectro de cada diamantoides refleja su tamaño, forma y simetría individuales . Debido a su tamaño y estructura bien definidos, los diamantoides también sirven como un sistema modelo para los cálculos de la estructura electrónica. [9]
Muchas de las propiedades optoelectrónicas de los diamantoides están determinadas por la diferencia en la naturaleza de los orbitales moleculares más altos ocupados y más bajos desocupados : el primero es un estado en masa, mientras que el segundo es un estado superficial . Como resultado, la energía del orbital molecular más bajo desocupado es aproximadamente independiente del tamaño del diamantoides. [10] [11]
Se ha descubierto que los diamantoides exhiben una afinidad electrónica negativa , lo que los hace potencialmente útiles en dispositivos de emisión de electrones . [10] [12]
Véase también
- Otros compuestos similares al diamante: Nitruro de boro
- Origen abiogénico del petróleo
- Nanorobot
Referencias
- ^ ab Dahl, JE; Liu, SG; Carlson, RMK (3 de enero de 2003). "Aislamiento y estructura de diamantoides superiores, moléculas de diamante de tamaño nanométrico". Science . 299 (5603): 96–99. doi : 10.1126/science.1078239 . PMID 12459548. S2CID 46688135.
- ^ Dahl, JEP; Moldowan, JM; Peakman, TM; Clardy, JC; Lobkovsky, E.; Olmstead, MM; May, PW; Davis, TJ; Steeds, JW; Peters, KE; Pepper, A.; Ekuan, A.; Carlson, RMK (2003). "Aislamiento y prueba estructural de la gran molécula de diamante, ciclohexamantano (C 26 H 30 )". Angewandte Chemie International Edition . 42 (18): 2040–2044. doi :10.1002/anie.200250794. PMID 12746817.
- ^ Burns, W.; McKervey, MA; Mitchell, TR; Rooney, JJ (1978). "Un nuevo enfoque para la construcción de hidrocarburos diamantoides. Síntesis de anti -tetramantano". Revista de la Sociedad Química Americana . 100 (3): 906–911. doi :10.1021/ja00471a041.
- ^ Zhang, J.; Zhu, Z.; Feng, Y.; Ishiwata, H.; Miyata, Y.; Kitaura, R.; Dahl, JE; Carlson, RM; Fokina, NA; Schreiner, PR; Tománek, D.; Shinohara, H. (25 de marzo de 2013). "Evidencia de nanocables de diamante formados dentro de nanotubos de carbono a partir de ácido diamantano dicarboxílico". Edición internacional Angewandte Chemie . 52 (13): 3717–3721. doi :10.1002/anie.201209192. PMID 23418054.
- ^ Tkachenko, Boryslav A.; Fokina, Natalie A.; Chernish, Lesya V.; Dahl, Jeremy EP; Liu, Shenggao; Carlson, Robert MK; Fokin, Andrey A.; Schreiner, Peter R. (2006). "Nanodiamantes funcionalizados, parte 3: tiolación de alcoholes terciarios/cabeza de puente". Cartas orgánicas . 8 (9): 1767–70. doi :10.1021/ol053136g. PMID 16623546.
- ^ Fokin, Andrey A.; Schreiner, Peter R.; Fokina, Natalie A.; Tkachenko, Boryslav A.; Hausmann, Heike; Serafin, Michael; Dahl, Jeremy EP; Liu, Shenggao; Carlson, Robert MK (2006). "Reactividad de [1(2,3)4]pentamantano (Td-pentamantano): un modelo a nanoescala del diamante". Revista de química orgánica . 71 (22): 8532–8540. doi :10.1021/jo061561x. PMID 17064030.
- ^ Mello, MR; Moldowan, JM (2005). "Petróleo: ¿ser o no ser abiogénico?". Búsqueda y descubrimiento .
- ^ Landt, L.; Klünder, K.; Dahl, JE; Carlson, RMK; Möller, T.; Bostedt, C. (2009). "Respuesta óptica de nanocristales de diamante en función del tamaño de partícula, la forma y la simetría". Physical Review Letters . 103 (4): 047402. Bibcode :2009PhRvL.103d7402L. doi :10.1103/PhysRevLett.103.047402. PMID 19659398.
- ^ Vörös, M.; Gali, A. (2009). "Absorción óptica de nanocristales de diamante a partir de cálculos funcionales de densidad ab initio ". Physical Review B . 80 (16): 161411. Bibcode :2009PhRvB..80p1411V. doi :10.1103/PhysRevB.80.161411.
- ^ ab Drummond, ND; Williamson, AJ; Needs, RJ; Galli, G. (2005). "Emisión de electrones desde diamantoides: un estudio de difusión cuántica de Monte Carlo". Physical Review Letters . 95 (9): 096801–096804. arXiv : 0801.0381 . Código Bibliográfico :2005PhRvL..95i6801D. doi :10.1103/PhysRevLett.95.096801. PMID 16197235. S2CID 16703233.
- ^ Willey, TM; Bostedt, C.; van Buuren, T.; Dahl, JE; Liu, SG; Carlson, RMK; Terminello, LJ; Möller, T. (2005). "Límites moleculares del modelo de confinamiento cuántico en cúmulos de diamantes". Physical Review Letters (manuscrito enviado). 95 (11): 113401–113404. Bibcode :2005PhRvL..95k3401W. doi :10.1103/PhysRevLett.95.113401. PMID 16197003.
- ^ Yang, WL; Fabbri, JD; Willey, TM; Lee, JRI; Dahl, JE; Carlson, RMK; Schreiner, PR; Fokin, AA; Tkachenko, BA; Fokina, NA; Meevasana, W.; Manella, N.; Tanaka, K.; Zhou, X.-J.; van Buuren, T.; Kelly, MA; Hussain, Z.; Melosh, NA; Shen, Z.-X. (2007). "Fotoemisión de electrones monocromáticos de monocapas diamantoides" (PDF) . Ciencia . 316 (5830): 1460–1462. Código Bib : 2007 Ciencia... 316.1460Y. doi : 10.1126/ciencia.1141811 . PMID 17556579.
Enlaces externos
- Grupo de Investigación de Clústeres y Nanocristales, Technische Universität Berlin
- Tecnologías de diamantes moleculares de Chevron Texaco
- La nanotecnología y la llegada de la era del diamante
- Espectroscopia láser Raman y modelado de diamantoides
- Propiedades electrónicas y ópticas de los diamantoides (descarga gratuita)
- Moléculas diamantoides: con aplicaciones en biomedicina, ciencia de materiales, nanotecnología y ciencia del petróleo
- Nanogaps de oro funcionalizados con diamantoides como sensores de nucleótidos de ADN naturales, mutados y modificados epigenéticamente