Pentafluoruro de bromo
 | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Pentafluoruro de bromo | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.029.234 | ||
| Número CE |
| ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD |
| ||
| Número de la ONU | 1745 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| BRF5 | |||
| Masa molar | 174,894 g.mol −1 | ||
| Apariencia | Líquido amarillo pálido | ||
| Densidad | 2,466 g/ cm3 | ||
| Punto de fusión | -61,30 °C (-78,34 °F; 211,85 K) | ||
| Punto de ebullición | 40,25 °C (104,45 °F; 313,40 K) | ||
| Reacciona con el agua | |||
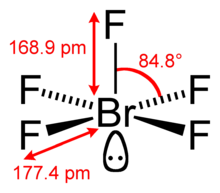
| Estructura | |||
| Pirámide cuadrada | |||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Potente oxidante, corrosivo, altamente tóxico, reacciona violentamente con el agua para liberar HF [1] | ||
| Etiquetado SGA : | |||
    | |||
| Peligro | |||
| H271 , H300+H310+H330 , H314 , H372 | |||
| P210 , P220 , P221 , P260 , P264 , P270 , P271 , P280 , P283 , P284 , P301+P310 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P306+P360 , P307+P311 , P309+P311 , P310 , P314 , P320 , P321 , P331 , P363 , P370+P378 , P371+P380+P375 , P403+P233 , P405 , P501 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | Ininflamable | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | ninguno [1] | ||
REL (recomendado) | TWA 0,1 ppm (0,7 mg/m3 ) [ 1] | ||
IDLH (Peligro inmediato) | Dakota del Norte [1] | ||
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa [ enlace roto ] | ||
| Compuestos relacionados | |||
Otros aniones | Monocloruro de bromo | ||
Otros cationes | Pentafluoruro de cloro Pentafluoruro de yodo | ||
Compuestos relacionados | Monofluoruro de bromo Trifluoruro de bromo | ||
| Página de datos complementarios | |||
| Pentafluoruro de bromo (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El pentafluoruro de bromo , Br F 5 , es un compuesto interhalogenado y un fluoruro de bromo . Es un agente fluorante fuerte .
El BrF 5 se utiliza en el análisis de isótopos de oxígeno . La ablación láser de silicatos sólidos en presencia de BrF 5 libera O 2 para su posterior análisis. [2] También se ha probado como oxidante en propulsores líquidos para cohetes y se utiliza como agente fluorante en el procesamiento de uranio .
Preparación
El BrF 5 se preparó por primera vez en 1931 mediante la reacción directa de bromo y flúor. [3] Esta reacción es adecuada para la preparación de grandes cantidades, [ cita requerida ] y se lleva a cabo a temperaturas superiores a 150 °C (302 °F) con un exceso de flúor:
- Br2 + 5F2 → 2BrF5
Para la preparación de cantidades más pequeñas se utiliza bromuro de potasio : [3]
- KBr+3F2 → KF+ BrF5
Esta ruta produce BrF 5 casi completamente libre de trifluoruros y otras impurezas. [3]
Reacciones
El BrF 5 reacciona con el agua para formar ácido brómico y ácido fluorhídrico : [4]
- BrF 5 + 3 H 2 O → HBrO 3 + 5 HF
Es un agente fluorante extremadamente eficaz, capaz de convertir la mayoría de los metales en sus fluoruros más altos incluso a temperatura ambiente. Con uranio y compuestos de uranio, se puede utilizar para producir hexafluoruro de uranio :
- 5U+ 6BrF5 → 5UF6 + 3Br2
Peligros
El BrF 5 reacciona violentamente con el agua y es extremadamente corrosivo y tóxico. Sus vapores también son extremadamente irritantes para todas las partes del cuerpo humano, especialmente la piel, los ojos y otras membranas mucosas . Al igual que muchos otros compuestos interhalogenados, liberará "humo" que contiene vapores ácidos si se expone al aire húmedo, que proviene de su reacción con el agua en el aire. La exposición a 100 ppm o más durante más de un minuto es letal para la mayoría de los animales de experimentación. La exposición crónica puede causar daño renal e insuficiencia hepática . [5]
Además, el BrF 5 es un agente oxidante fuerte y puede encenderse o explotar espontáneamente al entrar en contacto con sustancias inflamables como materiales orgánicos y polvo metálico. [5]
Referencias
- ^ abcd Guía de bolsillo del NIOSH sobre peligros químicos. "#0065". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Clayton, R.; Mayeda, TK (1963). "El uso de pentafluoruro de bromo en la extracción de oxígeno de óxidos y silicatos para análisis isotópico". Geochimica et Cosmochimica Acta . 27 (1): 43–48. Bibcode :1963GeCoA..27...43C. doi :10.1016/0016-7037(63)90071-1.
- ^ abc Hyde, GA; Boudakian, MM (1968). "Rutas de síntesis de pentafluoruros de cloro y bromo". Química inorgánica . 7 (12): 2648–2649. doi :10.1021/ic50070a039.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 834. ISBN 978-0-08-037941-8.
- ^ ab Patnaik, Pradyot (2007). Una guía completa sobre las propiedades peligrosas de las sustancias químicas (3.ª ed.). Wiley-Interscience. pág. 480. ISBN 978-0-471-71458-3.
Enlaces externos
- Página WebBook para BrF5
- Ficha internacional de seguridad química 0974
- Guía de bolsillo del NIOSH sobre peligros químicos. "#0065". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- Inventario Nacional de Contaminantes - Hoja informativa sobre fluoruros y compuestos