Creatina quinasa
| Creatina quinasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
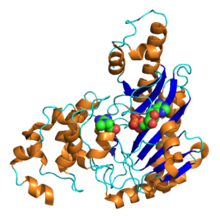 Estructura cristalina de la creatina quinasa de tipo cerebral humano con ADP y creatina. PDB 3b6r . [1] | |||||||||
| Identificadores | |||||||||
| N.º CE | 2.7.3.2 | ||||||||
| N.º CAS | 9001-15-4 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| Ontología genética | AmiGO / QuickGO | ||||||||
| |||||||||
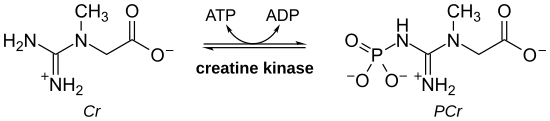
La creatina quinasa ( CK ), también conocida como creatina fosfoquinasa ( CPK ) o fosfocreatina quinasa , es una enzima ( EC 2.7.3.2) expresada por varios tejidos y tipos de células. La CK cataliza la conversión de creatina y utiliza trifosfato de adenosina (ATP) para crear fosfocreatina (PCr) y difosfato de adenosina (ADP). Esta reacción enzimática de la CK es reversible y, por lo tanto, se puede generar ATP a partir de PCr y ADP.
En los tejidos y células que consumen ATP rápidamente, especialmente el músculo esquelético , pero también el cerebro, las células fotorreceptoras de la retina , las células ciliadas del oído interno , los espermatozoides y el músculo liso , la PCr sirve como reservorio de energía para el rápido almacenamiento y regeneración del ATP in situ , así como para el transporte de energía intracelular por la lanzadera o circuito de PCr. [2] Por lo tanto, la creatina quinasa es una enzima importante en dichos tejidos. [3]
Clínicamente, la creatina quinasa se analiza en análisis de sangre como un marcador de daño del tejido rico en CK, como en el infarto de miocardio (ataque cardíaco), rabdomiólisis (deterioro muscular grave), distrofia muscular , miositis autoinmune y lesión renal aguda . [4]
Tipos
En las células, las enzimas CK citosólicas constan de dos subunidades, que pueden ser B (tipo cerebral) o M (tipo muscular). Por lo tanto, existen tres isoenzimas diferentes : CK-MM, CK-BB y CK-MB. Los genes de estas subunidades se encuentran en cromosomas diferentes : B en 14q32 y M en 19q13. Además de estas tres isoformas CK citosólicas , existen dos isoenzimas de creatina quinasa mitocondrial , la forma ubicua y la forma sarcomérica . La entidad funcional de las isoformas CK mitocondriales es un octámero que consta de cuatro dímeros cada uno. [5]
Mientras que la creatina quinasa mitocondrial participa directamente en la formación de fosfocreatina a partir del ATP mitocondrial, la CK citosólica regenera el ATP a partir del ADP, utilizando PCr. Esto sucede en los sitios intracelulares donde se utiliza el ATP en la célula, y la CK actúa como un regenerador de ATP in situ .
| gene | proteína |
|---|---|
| CKB | Creatina quinasa, cerebro, BB-CK |
| CKBE | Creatina quinasa, expresión ectópica |
| CKM | creatina quinasa, músculo, MM-CK |
| CKMT1A , CKMT1B | creatina quinasa mitocondrial 1; mtCK ubicua; o u mtCK |
| CKMT2 | creatina quinasa mitocondrial 2; mtCK sarcomérica; o s mtCK |
Los patrones de isoenzimas difieren entre los tejidos. El músculo esquelético expresa CK-MM (98%) y niveles bajos de CK-MB (1%). El miocardio (músculo cardíaco), en cambio, expresa CK-MM en un 70% y CK-MB en un 25-30%. La CK-BB se expresa predominantemente en el cerebro y el músculo liso, incluido el tejido vascular y uterino.
Estructura de la proteína
La primera estructura de una creatina quinasa resuelta por cristalografía de proteínas con rayos X fue la de la CK mitocondrial de tipo muscular octamérica y sarcomérica (s-mtCK) en 1996. [6] seguida por la estructura de la CK mitocondrial ubicua (u-mtCK) en 2000. [7] [8] La estructura atómica de la BB-CK cerebral citosólica, dimérica y con forma de banana, se resolvió en 1999 con una resolución de 1,4 Å . [9] La BB-CK citosólica, así como la MM-CK de tipo muscular, forman dímeros simétricos con forma de banana, con un sitio activo catalítico en cada subunidad. [10]
Funciones
La creatina quinasa mitocondrial (CK m ) está presente en el espacio intermembrana mitocondrial , donde regenera la fosfocreatina (PCr) a partir del ATP generado mitocondrialmente y la creatina (Cr) importada del citosol . Aparte de las dos formas de isoenzima CK mitocondrial, es decir, la ubicua mtCK (presente en tejidos no musculares) y la mtCK sarcomérica (presente en el músculo sarcomérico), hay tres isoformas CK citosólicas presentes en el citosol, dependiendo del tejido. Mientras que MM-CK se expresa en el músculo sarcomérico, es decir, el músculo esquelético y cardíaco, MB-CK se expresa en el músculo cardíaco y BB-CK se expresa en el músculo liso y en la mayoría de los tejidos no musculares.
La mtCK mitocondrial y la CK citosólica están conectadas en un denominado circuito o lanzadera PCr/Cr. La PCr generada por la mtCK en las mitocondrias se transporta a la CK citosólica que está acoplada a procesos dependientes de ATP, por ejemplo, las ATPasas, como la ATPasa de acto-miosina y la ATPasa de calcio involucradas en la contracción muscular, y la ATPasa de sodio/potasio involucrada en la retención de sodio en el riñón. La CK citosólica unida acepta la PCr transportada a través de la célula y utiliza ADP para regenerar ATP, que luego puede ser utilizado como fuente de energía por las ATPasas (la CK está asociada íntimamente con las ATPasas, formando un microcompartimento funcionalmente acoplado ). La PCr no solo es un amortiguador de energía, sino también una forma de transporte celular de energía entre los sitios subcelulares de producción de energía (ATP) (mitocondrias y glucólisis) y los de utilización de energía (ATPasas). [2]
Por lo tanto, la CK mejora la contractilidad del músculo esquelético, cardíaco y liso, y está involucrada en la generación de presión arterial . [11] Además, la acción depuradora de ADP de la creatina quinasa se ha relacionado con trastornos hemorrágicos : las personas con niveles plasmáticos muy elevados de CK podrían ser propensas a hemorragias importantes. [12]
Pruebas de laboratorio
| Creatina quinasa sérica | |
|---|---|
| Rango de referencia | 60 y 400 UI/L |
| Objetivo | Detección de daño muscular . [13] |
| Prueba de | La cantidad de creatina quinasa en la sangre. [13] |
La CK se determina a menudo de forma rutinaria en un laboratorio médico . Solía determinarse específicamente en pacientes con dolor torácico para reconocer un infarto agudo de miocardio, pero esta prueba ha sido reemplazada en gran medida por la troponina . Los valores normales en reposo suelen estar entre 60 y 400 UI/ L , [14] donde una unidad es la actividad enzimática , más específicamente la cantidad de enzima que catalizará 1 μmol de sustrato por minuto en condiciones específicas (temperatura, pH, concentraciones de sustrato y activadores. [15] ) Esta prueba no es específica para el tipo de CK que está elevado.
La creatina quinasa en sangre puede ser alta en personas sanas y enfermas. El ejercicio aumenta el flujo de salida de creatina quinasa al torrente sanguíneo durante hasta una semana, y esta es la causa más común de niveles altos de CK en sangre. [16] Además, los niveles altos de CK en sangre pueden estar relacionados con niveles altos de CK intracelular, como en personas de ascendencia africana. [17]
Por último, un nivel elevado de creatina quinasa en sangre puede ser un indicio de daño en el tejido rico en creatina quinasa, como en el caso de rabdomiólisis , infarto de miocardio , miositis y miocarditis . Esto significa que la creatina quinasa en sangre puede estar elevada en una amplia variedad de condiciones clínicas, incluido el uso de medicamentos como las estatinas ; trastornos endocrinos como el hipotiroidismo ; [18] y enfermedades y trastornos del músculo esquelético, incluida la hipertermia maligna , [19] y el síndrome neuroléptico maligno . [20]
Además, la determinación de isoenzimas se ha utilizado ampliamente en el pasado como indicador de daño miocárdico en casos de infarto de miocardio. La medición de troponina ha sustituido en gran medida esta medida en muchos hospitales, aunque algunos centros todavía dependen de la CK-MB.

Nomenclatura
Esta enzima aparece a menudo en la literatura médica con el nombre incorrecto de "creatinina quinasa". La creatinina no es un sustrato ni un producto de la enzima. [21]
Véase también
Referencias
- ^ Bong SM, Moon JH, Nam KH, Lee KS, Chi YM, Hwang KY (noviembre de 2008). "Estudios estructurales de la creatina quinasa de tipo cerebral humano complejada con el complejo análogo del estado de transición de creatina ADP-Mg2+-NO3-". FEBS Letters . 582 (28): 3959–65. doi :10.1016/j.febslet.2008.10.039. PMID 18977227. S2CID 21911841.
- ^ ab Wallimann T, Wyss M, Brdiczka D, Nicolay K, Eppenberger HM (enero de 1992). "Compartimentación intracelular, estructura y función de las isoenzimas de la creatina quinasa en tejidos con demandas energéticas altas y fluctuantes: el 'circuito de la fosfocreatina' para la homeostasis energética celular". The Biochemical Journal . 281 (Pt 1) (1): 21–40. doi :10.1042/bj2810021. PMC 1130636 . PMID 1731757.
- ^ Wallimann T, Hemmer W (1994). "Creatina quinasa en tejidos y células no musculares". Bioquímica molecular y celular . 133–134 (1): 193–220. doi :10.1007/BF01267955. eISSN 1573-4919. PMID 7808454. S2CID 10404672.
- ^ Moghadam-Kia S, Oddis CV, Aggarwal R (enero de 2016). "Enfoque para la elevación asintomática de la creatina quinasa". Cleveland Clinic Journal of Medicine . 83 (1): 37–42. doi :10.3949/ccjm.83a.14120. PMC 4871266 . PMID 26760521.
- ^ Schlattner U, Tokarska-Schlattner M, Wallimann T (febrero de 2006). "Creatina quinasa mitocondrial en la salud y la enfermedad humana". Biochimica et Biophysica Acta (BBA) - Base molecular de la enfermedad . 1762 (2): 164–80. doi :10.1016/j.bbadis.2005.09.004. PMID 16236486.
- ^ Fritz-Wolf K., Schnyder T., Wallimann, T. y W. Kabsch 1996 http://publicationslist.org/data/theo.wallimann/ref-135/Fritz-Wolf-sMtCK%20structure.pdf
- ^ Eder M., Schlattner U., Becker A., Wallimann T., Kabsch W. y K. Frotz-Wolf 2000 http://publicationslist.org/data/theo.wallimann/ref-101/Eder-X-ray.uMtCK.pdf. Ambas isoformas de mt-CK forman estructuras octaméricas (construidas a partir de 4 dímeros similares a los del plátano) con una simetría cuádruple y un canal central.
- ^ Schnyder T., Winkler H., Gross, H. Eppenberger HM y T. Wallimann 1991 http://publicationslist.org/data/theo.wallimann/ref-180/SchnyderT_Gross-MtCK-crystal-EMs.pdf
- ^ Eder M, Schlattner U, Wallimann T, Becker A, Kabsch W, Fritz-Wolf K (31 de diciembre de 2008). "Estructura cristalina de la creatina quinasa de tipo cerebral a una resolución de 1,41 Å". Protein Science . 8 (11). Wiley: 2258–2269. doi :10.1110/ps.8.11.2258. ISSN 0961-8368. PMC 2144193 . PMID 10595529.
- ^ Hornemann y col. 2000 http://publicationslist.org/data/theo.wallimann/ref-96/Hornmann-CK-dimer.pdf
- ^ Brewster LM, Mairuhu G, Bindraban NR, Koopmans RP, Clark JF, van Montfrans GA (noviembre de 2006). "La actividad de la creatina quinasa está asociada con la presión arterial". Circulation . 114 (19): 2034–9. doi :10.1161/CIRCULATIONAHA.105.584490. PMID 17075013. S2CID 6006006.
- ^ Brewster LM (junio de 2020). "Creatina La creatina quinasa extracelular puede modular la señalización purinérgica". Señalización purinérgica . 16 (3): 305–312. doi :10.1007/s11302-020-09707-0. PMC 7524943 . PMID 32572751.
- ^ ab "Creatina quinasa (CK)". labtestsonline.org . Consultado el 24 de diciembre de 2019 .
- ^ Armstrong AW, Golan DE (2008). "Farmacología de la hemostasia y la trombosis". En Golan DE, Tashjian AH, Armstrong EJ, Armstrong AW (eds.). Principios de farmacología: la base fisiopatológica de la farmacoterapia . Filadelfia : Lippincott Williams & Wilkins . pág. 388. ISBN. 978-0-7817-8355-2.OCLC 76262148 .
- ^ Bishop ML, Fody EP, Schoeff LE, eds. (2004). Química clínica: principios, procedimientos, correlaciones . Filadelfia : Lippincott Williams & Wilkins . pág. 243. ISBN. 978-0-7817-4611-3.OCLC 56446391 .
- ^ Johnsen SH, Lilleng H, Wilsgaard T, Bekkelund SI (enero de 2011). "Actividad de la creatina quinasa y presión arterial en una población normal: el estudio de Tromsø". Revista de hipertensión . 29 (1): 36–42. doi :10.1097/HJH.0b013e32834068e0. PMID 21063205. S2CID 7188988.
- ^ Brewster LM, Coronel CM, Sluiter W, Clark JF, van Montfrans GA (16 de marzo de 2012). Saks V (ed.). "Diferencias étnicas en la actividad de la creatina quinasa tisular: un estudio observacional". PLOS ONE . 7 (3): e32471. Bibcode :2012PLoSO...732471B. doi : 10.1371/journal.pone.0032471 . PMC 3306319 . PMID 22438879.
- ^ Hekimsoy Z, Oktem IK (2005). "Niveles séricos de creatina quinasa en hipotiroidismo manifiesto y subclínico". Endocrine Research . 31 (3): 171–5. doi :10.1080/07435800500371706. PMID 16392619. S2CID 5619524.
- ^ Johannsen S, Berberich C, Metterlein T, Roth C, Reiners K, Roewer N, Schuster F (mayo de 2013). "Prueba de detección de hipertermia maligna en pacientes con hiperCKemia persistente: un estudio piloto". Muscle & Nerve . 47 (5): 677–81. doi :10.1002/mus.23633. PMID 23400941. S2CID 5126493.
- ^ O'Dwyer AM, Sheppard NP (mayo de 1993). "El papel de la creatina quinasa en el diagnóstico del síndrome neuroléptico maligno". Psychological Medicine . 23 (2): 323–6. doi :10.1017/s0033291700028415. PMID 8101383. S2CID 10818939.
- ^ Nick Flynn (2021). "CK – ¿Qué significa?". American Journal of Emergency Medicine . 45 : 647. doi :10.1016/j.ajem.2020.11.015. PMC 7656996. PMID 33214021 .
Enlaces externos
- Sencillamente expresado en mdausa.org
- Creatina + quinasa en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Prueba de isoenzimas CPK Enciclopedia MedlinePlus : 003504
- CK en Pruebas de laboratorio en línea