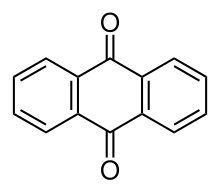
Antraquinona
 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Antraceno-9,10-diona [2] | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 390030 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.001.408 |
| 102870 | |
| BARRIL | |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD |
|
| Número de la ONU | 3143 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C14H8O2 | |
| Masa molar | 208,216 g·mol −1 |
| Apariencia | Sólido amarillo |
| Densidad | 1,438 g/cm3 [ 1] |
| Punto de fusión | 284,8 °C (544,6 °F; 558,0 K) [1] |
| Punto de ebullición | 377 °C (711 °F; 650 K) [1] |
| Insoluble | |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | posible carcinógeno |
| Etiquetado SGA : | |
 | |
| Peligro | |
| H350 | |
| P201 , P202 , P281 , P308+P313 , P405 , P501 | |
| punto de inflamabilidad | 185 °C (365 °F; 458 K) |
| Compuestos relacionados | |
Compuestos relacionados | quinona , antraceno |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La antraquinona , también llamada antracenodiona o dioxoantraceno , es un compuesto orgánico aromático con fórmula C
14yo
8Oh
2Existen varios isómeros , pero estos términos generalmente se refieren a la 9,10-antraquinona ( IUPAC : 9,10-dioxoantraceno), en la que los grupos ceto se encuentran en el anillo central. Se utiliza como aditivo digestor de pulpa de madera para la fabricación de papel. Muchos derivados de la antraquinona son generados por organismos o sintetizados industrialmente para su uso como tintes , productos farmacéuticos y catalizadores . La antraquinona es un sólido amarillo, altamente cristalino, poco soluble en agua pero soluble en disolventes orgánicos calientes. Es casi completamente insoluble en etanol cerca de la temperatura ambiente, pero 2,25 g se disolverán en 100 g de etanol hirviendo. Se encuentra en la naturaleza como el raro mineral hoelita .
Síntesis
Existen varios métodos industriales actuales para producir 9,10-antraquinona:
- Oxidación del antraceno . El cromo (VI) es el oxidante típico.
- Reacción de Friedel-Crafts entre benceno y anhídrido ftálico en presencia de AlCl 3 . El ácido o-benzoilbenzoico es un intermedio. Esta reacción es útil para producir antraquinonas sustituidas .
- La reacción de Diels-Alder de naftoquinona y butadieno seguida de deshidrogenación oxidativa.
- La dimerización catalizada por ácido del estireno para dar un 1,3-difenilbuteno, que luego puede transformarse en antraquinona. [3] Este proceso fue iniciado por BASF .
También surge a través de la reacción de Rickert-Alder, una reacción retro-Diels-Alder .
Reacciones
La hidrogenación produce dihidroantraquinona (antrahidroquinona). La reducción con cobre produce antrona . [4] La sulfonación con ácido sulfúrico produce ácido antroquinona-1-sulfónico, [5] que reacciona con clorato de sodio para producir 1-cloroantraquinona. [6]
Aplicaciones
Aditivo digestor en la fabricación de papel
La 9,10-antraquinona se utiliza como aditivo digestor en la producción de pulpa de papel mediante procesos alcalinos , como el kraft , el sulfito alcalino o los procesos Soda-AQ . La antraquinona es un catalizador redox . El mecanismo de reacción puede implicar la transferencia de un solo electrón (SET). [7] La antraquinona oxida el extremo reductor de los polisacáridos en la pulpa, es decir, celulosa y hemicelulosa , y de ese modo la protege de la degradación alcalina (pelado). La antraquinona se reduce a 9,10-dihidroxiantraceno que luego puede reaccionar con la lignina . La lignina se degrada y se vuelve más soluble en agua y, por lo tanto, más fácil de lavar de la pulpa, mientras que la antraquinona se regenera. Este proceso da un aumento en el rendimiento de la pulpa, típicamente 1-3% y una reducción en el número kappa . [8]
Usos de nicho
La 9,10-antraquinona se utiliza como repelente de aves en semillas y como generador de gas en globos satelitales. [9] También se ha mezclado con lanolina y se ha utilizado como spray para lana para proteger a los rebaños de ovejas contra los ataques del kea en Nueva Zelanda. [10]
Otros isómeros
Existen otros isómeros de la antraquinona, entre ellos las 1,2-, 1,4- y 2,6-antraquinonas, que tienen una importancia menor en comparación con la 9,10-antraquinona.
Seguridad
La antraquinona no tiene una DL 50 registrada , probablemente porque es muy insoluble en agua.
En términos del metabolismo de las antraquinonas sustituidas, la enzima codificada por el gen UGT1A8 tiene actividad glucuronidasa con muchos sustratos, incluidas las antraquinonas. [11]
Véase también
Referencias
- ^ abcd Haynes, William M., ed. (2016). Manual de química y física del CRC (97.ª edición). CRC Press . pág. 3.28. ISBN 9781498754293.
- ^ Unión Internacional de Química Pura y Aplicada (2014). Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013. The Royal Society of Chemistry . pág. 724. doi :10.1039/9781849733069. ISBN . 978-0-85404-182-4.
- ^ Vogel, A. "Antraquinona". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a02_347. ISBN 978-3527306732.
- ^ Macleod, LC; Allen, CFH (1934). "Benzantrona". Síntesis orgánicas . 14 : 4. doi :10.15227/orgsyn.014.0004.
- ^ Scott, WJ; Allen, CFH (1938). "Antraquinona-α-sulfonato de potasio". Síntesis orgánicas . 18 : 72. doi :10.15227/orgsyn.018.0072.
- ^ Scott, WJ; Allen, CFH (1938). "α-Cloroantraquinona". Síntesis orgánicas . 18 : 15. doi :10.15227/orgsyn.018.0015.
- ^ Samp, JC (2008). Un mecanismo integral para la transferencia de masa de antraquinona en pulpa alcalina (Tesis). Instituto Tecnológico de Georgia. p. 30. hdl :1853/24767.
- ^ Sturgeoff, LG; Pitl, Y. (1997) [1993]. "Despulpe de bajo índice kappa sin inversión de capital". En Goyal, GC (ed.). Despulpe de antraquinona . TAPPI Press. págs. 3–9. ISBN 0-89852-340-0.
- ^ "www.americanheritage.com". Archivado desde el original el 9 de junio de 2009. Consultado el 22 de septiembre de 2009 .
- ^ Dudding, Adam (29 de julio de 2012). "Cómo resolver un problema como el kea". Sunday Star Times . Nueva Zelanda . Consultado el 11 de noviembre de 2014 .
- ^ Ritter, JK; Chen, F.; Sheen, YY; Tran, HM; Kimura, S.; Yeatman, MT; Owens, IS (1992). "Un nuevo locus complejo UGT1 codifica bilirrubina humana, fenol y otras isozimas de UDP-glucuronosiltransferasa con extremos carboxilo idénticos" (PDF) . Journal of Biological Chemistry . 267 (5): 3257–3261. doi : 10.1016/S0021-9258(19)50724-4 . PMID 1339448.
Enlaces externos
- Inventario nacional de contaminantes: hoja informativa sobre hidrocarburos aromáticos policíclicos
- Las moléculas forman espontáneamente una red de panal


