Ciclooctano
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Ciclooctano | |
| Otros nombres Ciclooctano | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.005.484 |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C8H16 | |
| Masa molar | 112,216 g·mol −1 |
| Densidad | 0,840 g/cm3 [ 1] |
| Punto de fusión | 14,5 °C (58,1 °F; 287,6 K) [1] |
| Punto de ebullición | 151,2 °C (304,2 °F; 424,3 K) [1] |
| 7,90 mg/l | |
| −91,4·10 −6 cm3 / mol | |
| Compuestos relacionados | |
Cicloalcanos relacionados | Cicloheptano |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El ciclooctano es un cicloalcano con la fórmula molecular (CH 2 ) 8 . [2] Es un hidrocarburo incoloro simple , pero a menudo es un compuesto de referencia para compuestos de anillo de ocho miembros saturados en general.
El ciclooctano tiene un olor alcanforado . [3]
Conformaciones
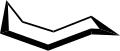
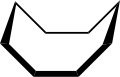
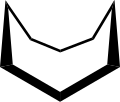
La conformación del ciclooctano se ha estudiado ampliamente mediante métodos computacionales . Hendrickson señaló que "el ciclooctano es, sin lugar a dudas, el cicloalcano conformacionalmente más complejo debido a la existencia de muchos confórmeros de energía comparable". La conformación de silla de barco (abajo) es la forma más estable. [4] Esta conformación fue confirmada por Allinger y colaboradores. [5] La conformación de corona (abajo) [6] es ligeramente menos estable. Entre los muchos compuestos que exhiben la conformación de corona (estructura II) se encuentra S 8 , azufre elemental .
Síntesis y reacciones
La principal ruta para obtener derivados de ciclooctano implica la dimerización de butadieno , catalizada por complejos de níquel(0) como el níquel bis(ciclooctadieno) . [9] Este proceso produce, entre otros productos, 1,5-ciclooctadieno (COD), que puede hidrogenarse. El COD se utiliza ampliamente para la preparación de precatalizadores para catálisis homogénea . La activación de estos catalizadores bajo H2 produce ciclooctano, que generalmente se descarta o se quema:
- C8H12 + 2H2 → C8H16
El ciclooctano no participa en reacciones distintas de las típicas de otros hidrocarburos saturados, la combustión y la halogenación por radicales libres . Los trabajos de 2009 sobre la funcionalización de alcanos, utilizando peróxidos como el peróxido de dicumilo, han abierto la química hasta cierto punto, permitiendo, por ejemplo, la introducción de un grupo fenilamino. [10]
Referencias
- ^ abc ALCANCE DE LA ECHA
- ^ Mackay, Donald (2006). Manual de propiedades físico-químicas y destino ambiental de sustancias químicas orgánicas. CRC Press. pág. 258. ISBN 978-1-56670-687-2.
- ^ Sell, CS (2006). "Sobre la imprevisibilidad del olor". Angew. Chem. Int. Ed . 45 (38): 6254–6261. doi :10.1002/anie.200600782. PMID 16983730.
- ^ Hendrickson, James B. (1967). "Geometría molecular V. Evaluación de funciones y conformaciones de anillos medianos". Revista de la Sociedad Química Americana . 89 (26): 7036–7043. doi :10.1021/ja01002a036.
- ^ Dorofeeva, OV; Mastryukov, VS; Allinger, NL; Almenningen, A. (1985). "La estructura molecular y la conformación del ciclooctano determinadas por difracción de electrones y cálculos de mecánica molecular". The Journal of Physical Chemistry . 89 (2): 252–257. doi :10.1021/j100248a015.
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "conformación de corona". doi :10.1351/goldbook.C01422
- ^ abcde Pakes, PW; Rounds, TC; Strauss, HL (1981). "Conformaciones del ciclooctano y algunos oxocanos relacionados". Revista de química física . 85 (17): 2469–2475. doi :10.1021/j150617a013. ISSN 0022-3654.
- ^ Moss, GP (1996). "Terminología básica de la estereoquímica (Recomendaciones IUPAC 1996)". Química pura y aplicada . 68 (12): 2193–2222. doi : 10.1351/pac199668122193 . ISSN 0033-4545. S2CID 98272391.
- ^ Thomas Schiffer, Georg Oenbrink, “Ciclododecatrieno, ciclooctadieno y 4-vinilciclohexeno” en Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi :10.1002/14356007.a08_205.
- ^ Deng, Guojun; Wenwen Chen; Chao-Jun Li (febrero de 2009). "Una aminación inusual mediada por peróxido de cicloalcanos con nitroarenos". Advanced Synthesis & Catalysis . 351 (3): 353–356. doi :10.1002/adsc.200800689.