Asparagina
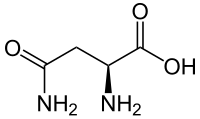 Fórmula esquelética de la L -asparagina | |||
 Fórmula esquelética de la L -asparagina en condiciones fisiológicas | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Asparagina | |||
| Otros nombres Ácido 2-amino-3-carbamoilpropanoico | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.019.565 | ||
| Número CE |
| ||
| |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C4H8N2O3 | |||
| Masa molar | 132,119 g·mol −1 | ||
| Apariencia | cristales blancos | ||
| Densidad | 1,543 g/ cm3 | ||
| Punto de fusión | 234 °C (453 °F; 507 K) | ||
| Punto de ebullición | 438 °C (820 °F; 711 K) | ||
| 2,94 g/100 ml | |||
| Solubilidad | soluble en ácidos , bases , insignificante en metanol , etanol , éter , benceno | ||
| registro P | -3,82 | ||
| Acidez (p K a ) |
| ||
| -69,5·10 −6 cm3 / mol | |||
| Estructura | |||
| ortorrómbico | |||
| Termoquímica | |||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −789,4 kJ/mol | ||
| Peligros | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | 219 °C (426 °F; 492 K) | ||
| Ficha de datos de seguridad (FDS) | Sigma-Alrich | ||
| Página de datos complementarios | |||
| Asparagina (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
La asparagina (símbolo Asn o N [2] ) es un α - aminoácido que se utiliza en la biosíntesis de proteínas . Contiene un grupo α-amino (que se encuentra en el −NH protonado)+
3forma en condiciones biológicas), un grupo ácido α-carboxílico (que está en la forma desprotonada −COO − en condiciones biológicas) y una cadena lateral carboxamida , clasificándolo como un aminoácido alifático polar (a pH fisiológico) . No es esencial en humanos, lo que significa que el cuerpo puede sintetizarlo. Está codificado por los codones AAU y AAC.
El símbolo de una letra N para asparagina se asignó arbitrariamente, [3] con el mnemónico propuesto asparagi N e; [4]
Historia
La asparagina fue aislada por primera vez en 1806 en forma cristalina por los químicos franceses Louis Nicolas Vauquelin y Pierre Jean Robiquet (en aquel entonces un joven asistente). Se aisló del jugo de espárragos , [5] [6] en el que es abundante, de ahí el nombre elegido. Fue el primer aminoácido que se aisló. [7]
Tres años más tarde, en 1809, Pierre Jean Robiquet identificó una sustancia procedente de la raíz de regaliz con propiedades que calificó como muy similares a las de la asparagina, [8] y que Plisson identificó en 1828 como la propia asparagina. [9] [10]
La determinación de la estructura de la asparagina requirió décadas de investigación. La fórmula empírica de la asparagina fue determinada por primera vez en 1833 por los químicos franceses Antoine François Boutron Charlard y Théophile-Jules Pelouze ; en el mismo año, el químico alemán Justus Liebig proporcionó una fórmula más precisa. [11] [12] En 1846, el químico italiano Raffaele Piria trató la asparagina con ácido nitroso , que eliminó los grupos amina (–NH 2 ) de la molécula y transformó la asparagina en ácido málico . [13] Esto reveló la estructura fundamental de la molécula: una cadena de cuatro átomos de carbono. Piria pensó que la asparagina era una diamida del ácido málico; [14] sin embargo, en 1862 el químico alemán Hermann Kolbe demostró que esta suposición era errónea; en cambio, Kolbe concluyó que la asparagina era una amida de una amina del ácido succínico . [15] En 1886, el químico italiano Arnaldo Piutti (1857-1928) descubrió una imagen especular o " enantiómero " de la forma natural de la asparagina, que compartía muchas de las propiedades de la asparagina, pero que también difería de ella. [16] Dado que la estructura de la asparagina aún no se conocía por completo (la ubicación del grupo amina dentro de la molécula aún no estaba resuelta [17] ), Piutti sintetizó la asparagina y, por lo tanto, publicó su verdadera estructura en 1888. [18]
Función estructural en las proteínas
Dado que la cadena lateral de asparagina puede formar interacciones de enlaces de hidrógeno con la estructura principal del péptido, los residuos de asparagina se encuentran a menudo cerca del comienzo de las hélices alfa como giros asx y motivos asx , y en motivos de giros similares, o como anillos de amida , en láminas beta . Su función puede considerarse como la de "proteger" las interacciones de enlaces de hidrógeno que de otro modo serían satisfechas por la estructura principal del polipéptido.
La asparagina también proporciona sitios clave para la glicosilación ligada a N , modificación de la cadena proteica con la adición de cadenas de carbohidratos . Por lo general, un árbol de carbohidratos solo se puede agregar a un residuo de asparagina si este último está flanqueado en el lado C por X -serina o X- treonina , donde X es cualquier aminoácido con la excepción de la prolina . [19]
La asparagina puede hidroxilarse en el factor de transcripción inducible por hipoxia HIF1 . Esta modificación inhibe la activación génica mediada por HIF1. [20]
Fuentes
Fuentes dietéticas
La asparagina no es esencial para los humanos, lo que significa que puede sintetizarse a partir de intermediarios de la vía metabólica central y no es necesaria en la dieta.
La asparagina se encuentra en:
- Fuentes animales: lácteos , suero , carne de res , aves , huevos , pescado , lactoalbúmina , mariscos [ cita requerida ]
- Fuentes vegetales: algas marinas (espirulina) , patatas , aislado de proteína de soja , tofu [ cita requerida ]
Biosíntesis y catabolismo
El precursor de la asparagina es el oxaloacetato , que una enzima transaminasa convierte en aspartato . La enzima transfiere el grupo amino del glutamato al oxaloacetato produciendo α-cetoglutarato y aspartato. La enzima asparagina sintetasa produce asparagina, AMP , glutamato y pirofosfato a partir de aspartato, glutamina y ATP . La asparagina sintetasa utiliza ATP para activar el aspartato, formando β-aspartil-AMP. La glutamina dona un grupo amonio, que reacciona con β-aspartil-AMP para formar asparagina y AMP libre. [21]

En una reacción inversa a su biosíntesis, la asparagina se hidroliza a aspartato por acción de la asparaginasa . Luego, el aspartato sufre una transaminación para formar glutamato y oxaloacetato a partir de alfa-cetoglutarato. El oxaloacetato, que ingresa al ciclo del ácido cítrico (ciclo de Krebs). [21]
La controversia sobre la acrilamida
Calentar una mezcla de asparagina y azúcares reductores u otra fuente de carbonilos produce acrilamida en los alimentos. Estos productos se encuentran en productos horneados como las papas fritas, las papas fritas y el pan tostado. La acrilamida se convierte en el hígado en glicidamida , que es un posible carcinógeno. [22]
Función
La asparagina sintetasa es necesaria para el desarrollo normal del cerebro. [23] La asparagina también está involucrada en la síntesis de proteínas durante la replicación de los virus de la viruela . [24]
La adición de N -acetilglucosamina a la asparagina se realiza mediante enzimas oligosacariltransferasas en el retículo endoplásmico . [25] Esta glicosilación está involucrada en la estructura [26] y función de las proteínas. [27]
Referencias
- ^ Haynes WM, ed. (2016). Manual de química y física del CRC (97.ª edición). CRC Press . págs. 5–89. ISBN 978-1498754286.
- ^ "Nomenclatura y simbolismo de aminoácidos y péptidos". Comisión Conjunta IUPAC-IUB sobre Nomenclatura Bioquímica. 1983. Archivado desde el original el 9 de octubre de 2008. Consultado el 5 de marzo de 2018 .
- ^ "Comisión IUPAC-IUB sobre nomenclatura bioquímica: una notación de una letra para secuencias de aminoácidos". Journal of Biological Chemistry . 243 (13): 3557–3559. 10 de julio de 1968. doi : 10.1016/S0021-9258(19)34176-6 .
- ^ Adoga, Godwin I; Nicholson, Bh (enero de 1988). "Cartas al editor". Educación bioquímica . 16 (1): 49. doi :10.1016/0307-4412(88)90026-X.
- ^ Vauquelin LN, Robiquet PJ (1806). "El descubrimiento de un nuevo príncipe vegetal en el suc des asperges". Annales de Chimie (en francés). 57 : 88–93. hdl :2027/nyp.33433062722578.
- ^ Plimmer RH (1912) [1908]. Plimmer RH, Hopkins FG (eds.). La composición química de las proteínas. Monografías sobre bioquímica. Vol. Parte I. Análisis (2.ª ed.). Londres: Longmans, Green and Co. p. 112. Consultado el 18 de enero de 2010 .
- ^ Anfinsen CB, Edsall JT, Richards FM (1972). Avances en química de proteínas. Nueva York: Academic Press. pp. 99, 103. ISBN 978-0-12-034226-6.
- ^ Robiquet PJ (1809). "Analyse de la racine de réglisse" [Análisis de la raíz de regaliz]. Annales de Chimie et de Physique (en francés). 72 (1): 143-159.
- ^ Plisson A (1828). "De l'indentité de l'asparagine avec l'agédoïte" [Sobre la identidad de la asparagina con la agédoïte]. Journal de Pharmacie et des Sciences Accessoires (en francés). 14 (4): 177–182.
- ^ Felter HW, Lloyd JU (1898). "Glycyrrhiza (USP)—Glycyrrhiza". Dispensario americano de King . Página de inicio de Henriette's Herbal.
- ^ Boutron-Charlard; Pelouze (1833). "Ueber das Asparamid (Asparagin des Herrn Robiquet) und die Asparamidsäure" [Sobre la asparamida (la asparagina del Sr. Robiquet) y el ácido aspártico]. Annalen der Chemie (en alemán). 6 : 75–88. doi :10.1002/jlac.18330060111. La fórmula empírica de la asparagina aparece en la página 80.
- ^ Liebig J (1833). "Ueber die Zusammensetzung des Asparamids und der Asparaginsäure" [Sobre la composición de la asparamida [asparagina] y el ácido aspártico]. Annalen der Chemie (en alemán). 7 (14): 146-150. Código bibliográfico : 1834AnP...107..220L. doi : 10.1002/andp.18341071405. La fórmula empírica aparece en la página 149; la fórmula es correcta si los subíndices se dividen por 2.
- ^ Ver:
- Piria R (enero 1846). "Studi sulla costituzione chimica dell' asparagina e dell' acido aspartico" [Estudios de la constitución química de la asparagina y el ácido aspártico]. Il Cimento (en italiano). 4 : 55–73. doi :10.1007/BF02532918. S2CID 177614807.
- Traducción al francés: Piria R (1848). "Recherches sur la constitution chimique de l'asparagine et de l'acide aspartique" [Investigaciones sobre la constitución química de la asparagina y del ácido aspártico]. Annales de Chimie et de Physique . 3ª serie (en francés). 22 : 160-179. De la pág. 175: "... on voit, en outre, que l'asparagine et l'acide aspartique lui-même se descomposent avec une facilité remarquable, sous l'influence de l'acide hiponitrique, en fournissant du gas azote et de l'acide malique ". (... se ve, además, que la asparagina y el propio ácido aspártico se descomponen con notable facilidad bajo la influencia del ácido nitroso, produciendo nitrógeno gaseoso y ácido málico.)
- ^ Plimmer RH (1912). Constitución química de las proteínas. Parte I: Análisis (2.ª ed.). Londres, Inglaterra: Longmans, Green and Co. p. 112.
- ^ Kolbe H (1862). "Ueber die chemische Constitution des Asparagins und der Asparaginsäure" [Sobre la constitución química de la asparagina y el ácido aspártico]. Annalen der Chemie (en alemán). 121 (2): 232–236. doi :10.1002/jlac.18621210209.
- ^ Piutti A (1886). "Ein neues Asparagin" [Una nueva asparagina]. Berichte der Deutschen Chemischen Gesellschaft (en alemán). 19 (2): 1691–1695. doi :10.1002/cber.18860190211.
- ^ El químico francés Edouard Grimaux pensaba que el grupo amino (–NH 2 ) estaba ubicado junto al grupo amida (–C(O)NH 2 ), mientras que el químico italiano Icilio Guareschi pensaba que el grupo amino estaba ubicado junto al grupo carboxilo (–COOH).
- Grimaux E (1875). "Recherches synthétiques sur le groupe urique" [Investigaciones sintéticas del grupo úrico]. Boletín de la Société Chimique de París . 2da serie (en francés). 24 : 337–355.En la página 352, Grimaux presentó dos posibles estructuras para la asparagina, y en la página 353, se inclinó por la estructura (I), lo cual es incorrecto. De la página 353: "… ce sont les formules marquées du chiffre I qui me semblent devoir être adoptées pour l'asparagine, … " (… son las fórmulas marcadas con la cifra I las que, me parece, deberían adoptarse para la asparagina, …)
- Guareschi I (1876). "Studi sull' asparagine e sull' acido aspartico" [Estudios de la asparagina y del ácido aspártico]. Atti della Reale Academia del Lincei . 2da serie (en italiano). 3 (parte 2): 378–393.En la página 388, Guareschi propuso dos estructuras (α y β) para la asparagina; se inclinó por la α, la correcta. De la página 388: " La fórmula α me parece preferible por la siguiente razón: …" (La fórmula α me parece preferible por la siguiente razón: …)
- Resumen en inglés en: Guareschi J (1877). "Asparagina y ácido aspártico". Journal of the Chemical Society . 31 : 457–459.Véase especialmente la pág. 458.
- ^ Piutti A (1888). "Sintesi e costituzione delle asparagine" [Síntesis y constitución de asparagina]. Gazzetta Chimica Italiana (en italiano). 18 : 457–472.
- ^ Brooker R, Widmaier E, Graham L, Stiling P, Hasenkampf C, Hunter F, Bidochka M, Riggs D (2010). "Capítulo 5: Biología de sistemas de la organización celular". Biology (edición canadiense). Estados Unidos de América: McGraw-Hill Ryerson. págs. 105-106. ISBN 978-0-07-074175-1.
- ^ Lando D, Peet DJ, Gorman JJ, Whelan DA, Whitelaw ML, Bruick RK (junio de 2002). "FIH-1 es una enzima asparaginil hidroxilasa que regula la actividad transcripcional del factor inducible por hipoxia". Genes & Development . 16 (12): 1466–71. doi :10.1101/gad.991402. PMC 186346 . PMID 12080085.
- ^ ab Berg, Jeremy; Tymoczko, John; Stryer, Lubert (2002). Bioquímica (5.ª ed.). Nueva York: WH Freeman. pág. 968. ISBN 0716746840. Recuperado el 27 de mayo de 2021 .
- ^ Friedman, Mendel (2003). "Química, bioquímica y seguridad de la acrilamida. Una revisión". Revista de química agrícola y alimentaria . 51 (16): 4504–4526. doi :10.1021/jf030204+. PMID 14705871.
- ^ Ruzzo EK, Capo-Chichi JM, Ben-Zeev B, Chitayat D, Mao H, Pappas AL, et al. (octubre de 2013). "La deficiencia de asparagina sintetasa causa microcefalia congénita y una forma progresiva de encefalopatía". Neuron . 80 (2): 429–41. doi :10.1016/j.neuron.2013.08.013. PMC 3820368 . PMID 24139043.
- ^ Pant A, Cao S, Yang Z (julio de 2019). Shisler JL (ed.). "La asparagina es un metabolito limitante crítico para la síntesis de proteínas del virus vaccinia durante la privación de glutamina". Journal of Virology . 93 (13): e01834–18, /jvi/93/13/JVI.01834–18.atom. doi :10.1128/JVI.01834-18. PMC 6580962 . PMID 30996100.
- ^ Burda P, Aebi M (enero de 1999). "La vía del dolicol de glicosilación ligada a N". Biochimica et Biophysica Acta (BBA) - Temas generales . 1426 (2): 239–57. doi :10.1016/S0304-4165(98)00127-5. PMID 9878760.
- ^ Imperiali B, O'Connor SE (diciembre de 1999). "Efecto de la glicosilación ligada a N en la estructura de glicopéptidos y glicoproteínas". Current Opinion in Chemical Biology . 3 (6): 643–9. doi :10.1016/S1367-5931(99)00021-6. PMID 10600722.
- ^ Patterson MC (septiembre de 2005). "Mímicas metabólicas: los trastornos de la glucosilación ligada a N". Seminarios en neurología pediátrica . 12 (3): 144–51. doi :10.1016/j.spen.2005.10.002. PMID 16584073.
Enlaces externos
- Espectro de espectroscopia GMD MS





