Haga clic en química
| Parte de una serie sobre |
| Química |
|---|
 |
La química de clic es un enfoque de la síntesis química que enfatiza la eficiencia, la simplicidad, la selectividad y la modularidad en los procesos químicos utilizados para unir bloques de construcción moleculares. Incluye tanto el desarrollo como el uso de "reacciones de clic", un conjunto de reacciones químicas simples y biocompatibles que cumplen criterios específicos como alto rendimiento, velocidades de reacción rápidas y subproductos mínimos. Fue descrita por primera vez en su totalidad por K. Barry Sharpless , Hartmuth C. Kolb y M. G. Finn del Scripps Research Institute en 2001. [1] [2] En este artículo seminal, Sharpless argumentó que la química sintética podría emular la forma en que la naturaleza construye moléculas complejas, utilizando reacciones eficientes para unir bloques de construcción simples y no tóxicos.
El término "química de clic" fue acuñado en 1998 por la esposa de Sharpless, Jan Dueser, [3] quien encontró la simplicidad de este enfoque de la síntesis química similar a unir bloques de Lego. De hecho, la simplicidad de la química de clic representó un cambio de paradigma en la química sintética y ha tenido un impacto significativo en muchas industrias, especialmente en el desarrollo farmacéutico. En 2022, el Premio Nobel de Química fue otorgado conjuntamente a Carolyn R. Bertozzi , Morten P. Meldal y Sharpless, "por el desarrollo de la química de clic y la química bioortogonal ". [4]
Principios
Para que una reacción se considere una reacción de clic, debe satisfacer ciertas características: [5]
- modularidad
- Insensibilidad a los parámetros del disolvente.
- Altos rendimientos químicos
- insensibilidad al oxígeno y al agua
- regioespecificidad y estereoespecificidad
- Una gran fuerza impulsora termodinámica (>20 kcal / mol ) que favorece una reacción con un único producto de reacción. Una reacción exotérmica distinta hace que un reactivo se "cargue de resorte".
El proceso preferiblemente sería:
- tienen condiciones de reacción simples
- Utilice materiales de partida y reactivos fácilmente disponibles
- No utilice disolventes o utilice un disolvente benigno o de fácil eliminación (preferiblemente agua)
- Proporcionar un aislamiento simple del producto mediante métodos no cromatográficos ( cristalización o destilación ).
- Tienen una alta economía de átomos .
Muchos de los criterios de química de clic son subjetivos y, aunque se pudieran acordar criterios mensurables y objetivos, es poco probable que alguna reacción sea perfecta para todas las situaciones y aplicaciones. Sin embargo, se han identificado varias reacciones que se ajustan al concepto mejor que otras: [ aclaración necesaria ]
- Las cicloadiciones [3+2] , como la cicloadición dipolar 1,3 de Huisgen , en particular la variante escalonada catalizada por Cu(I), [6] a menudo se denominan simplemente reacciones Click.
- Reacción del tiol-eno [7] [8]
- Reacción de Diels-Alder y demanda inversa de electrones Reacción de Diels-Alder [9] [10]
- [4+1] cicloadiciones entre isonitrilos (isocianuros) y tetrazinas [11]
- Sustitución nucleofílica, especialmente en anillos pequeños y tensos como el epoxi [12] y las aziridinas.
- formación de ureas similar a la química del carbonilo pero no reacciones del tipo aldólico debido a la baja fuerza impulsora termodinámica.
- reacciones de adición a enlaces dobles carbono-carbono como la dihidroxilación o los alquinos en la reacción tiol-ino . [5]
- Intercambio de fluoruro de azufre (VI)
Reacciones de clic específicas
Cicloadición de azida-alquino catalizada por cobre (I) (CuAAC)
La reacción clásica [13] [14] es la reacción catalizada por cobre de una azida con un alquino para formar un anillo de heteroátomos de 5 miembros: una cicloadición azida-alquino catalizada por Cu(I) (CuAAC). La primera síntesis de triazol , a partir de dietil acetilendicarboxilato y fenil azida, fue reportada por Arthur Michael en 1893. [15] Más tarde, a mediados del siglo XX, esta familia de cicloadiciones 1,3-dipolares tomó el nombre de Rolf Huisgen después de sus estudios de su cinética y condiciones de reacción.
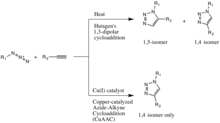
La catálisis de cobre(I) de la cicloadición 1,3-dipolar de Huisgen fue descubierta simultáneamente e independientemente por los grupos de Valery V. Fokin y K. Barry Sharpless en el Scripps Research Institute en California [16] y Morten Meldal en el Carlsberg Laboratory , Dinamarca. [17] La versión catalizada por cobre de esta reacción produce solo el isómero 1,4, mientras que la cicloadición 1,3-dipolar no catalizada de Huisgen produce tanto el isómero 1,4 como el 1,5, es lenta y requiere una temperatura de 100 grados Celsius. [15]

Además, este "clic" catalizado por cobre no requiere ligandos en el metal, aunque se han descrito y utilizado con éxito ligandos aceleradores como los ligandos de tris(triazolil)metilamina con varios sustituyentes en solución acuosa. [15] También se pueden utilizar otros ligandos como PPh3 y TBIA, aunque el PPh3 es propenso a la ligación de Staudinger con el sustituyente azida. Se descubrió que el Cu2O en agua a temperatura ambiente también catalizaba la misma reacción en 15 minutos con un rendimiento del 91%. [18]
El primer mecanismo de reacción propuesto incluía un átomo de cobre catalítico; pero estudios isotópicos, cinéticos y de otro tipo han sugerido que un mecanismo de dicopper puede ser más relevante. [19] [20] [21] [22] [23] Aunque esta reacción se desarrolla de manera efectiva en condiciones biológicas, el cobre en este rango de dosis es citotóxico. Se han presentado soluciones a este problema, como el uso de ligandos solubles en agua sobre el cobre para mejorar la penetración celular del catalizador y, por lo tanto, reducir la dosis necesaria, [24] [25] [26] o el uso de ligandos quelantes para aumentar aún más la concentración efectiva de Cu(I) y, por lo tanto, disminuir la dosis real. [27] [28] [29]
Aunque la variante catalizada por Cu(I) fue descrita por primera vez por Meldal y sus colaboradores para la síntesis de peptidotriazoles en un soporte sólido, sus condiciones estaban lejos del verdadero espíritu de la química clic y fueron superadas por Sharpless, más reconocida públicamente. Meldal y sus colaboradores también decidieron no etiquetar este tipo de reacción como "química clic", lo que supuestamente provocó que su descubrimiento fuera ignorado en gran medida por la sociedad química convencional. Fokin y Sharpless lo describieron de forma independiente como un proceso catalítico confiable que ofrece "un nivel sin precedentes de selectividad, confiabilidad y alcance para aquellos esfuerzos de síntesis orgánica que dependen de la creación de enlaces covalentes entre diversos bloques de construcción".
Los grupos Jia y Fokin informaron en 2005 sobre una reacción análoga de RuAAC catalizada por rutenio, en lugar de cobre, que permite la producción selectiva de isómeros 1,5. [30]
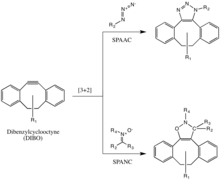
Cicloadición de azida-alquino promovida por tensión (SPAAC)
El grupo de Bertozzi desarrolló además una de las reacciones de clic sin cobre de Huisgen para superar la citotoxicidad de la reacción de CuAAC. [31] En lugar de utilizar Cu(I) para activar el alquino, el alquino se introduce en un difluorooctino deformado (DIFO), en el que los gem-fluorinos propargílicos que atraen electrones actúan junto con la deformación del anillo para desestabilizar en gran medida el alquino. [32] Esta desestabilización aumenta la fuerza impulsora de la reacción y el deseo del cicloalquino de aliviar su deformación del anillo.

Esta reacción se desarrolla como una cicloadición concertada [3+2] al triple enlace de un ciclooctino, siguiendo el mismo mecanismo que la cicloadición 1,3-dipolar de Huisgen. También se permiten sustituyentes distintos de los fluoruros, como los anillos de benceno, en el ciclooctino.
Esta reacción se ha utilizado con éxito para investigar azidas en sistemas vivos, aunque la velocidad de reacción es algo más lenta que la del CuAAC. Además, debido a que la síntesis de ciclooctinas a menudo da un bajo rendimiento, el desarrollo de sondas para esta reacción no ha sido tan rápido como para otras reacciones. Pero los derivados de ciclooctina como DIFO, dibencilciclooctina (DIBO o DBCO) y biarilazaciclooctinona (BARAC) se han utilizado con éxito en la reacción SPAAC para investigar azidas en sistemas vivos. [33] [34] [35]
Cicloadición de alquino-nitrona promovida por tensión (SPANC)
También se han utilizado ciclooctinas deformadas por diaril, incluida la dibencilciclooctina (DIBO), para reaccionar con 1,3-nitronas en cicloadiciones de alquino-nitrona promovidas por deformación (SPANC) para producir isoxazolinas N-alquiladas. [36]
Debido a que esta reacción no contiene metales y se produce con una cinética rápida (k2 tan rápido como 60 1/Ms, más rápido que el CuAAC o el SPAAC), el SPANC se puede utilizar para el marcaje de células vivas. Además, se tolera la sustitución tanto de los átomos de carbono como de nitrógeno del dipolo de nitrona, y de las nitronas acíclicas y endocíclicas. Esta gran tolerancia proporciona mucha flexibilidad para la incorporación de sondas o mangos de nitrona. [37]
Sin embargo, el producto isoxazolina no es tan estable como el producto triazol del CuAAC y el SpAAC, y puede sufrir reordenamientos en condiciones biológicas. De todas formas, esta reacción sigue siendo muy útil ya que tiene una cinética de reacción notablemente rápida. [36]
Las aplicaciones de esta reacción incluyen el marcado de proteínas que contienen serina como primer residuo: la serina se oxida a aldehído con NaIO 4 y luego se convierte en nitrona con p-metoxibencenotiol, N-metilhidroxilamina y p-ansidina, y finalmente se incuba con ciclooctina para dar un producto clic. El SPANC también permite el marcado multiplex. [38] [39]
Reacciones de alquenos tensados
Los alquenos deformados también utilizan el alivio de la tensión como fuerza impulsora que permite su participación en reacciones de clic. Los transcicloalquenos (normalmente ciclooctenos) y otros alquenos deformados como el oxanorbornadieno reaccionan en reacciones de clic con una serie de socios, entre ellos azidas, tetrazinas y tetrazoles. Estos socios de reacción pueden interactuar específicamente con el alqueno deformado, manteniéndose bioortogonales a los alquenos endógenos que se encuentran en lípidos, ácidos grasos, cofactores y otros productos naturales. [38]
Cicloadición de alquenos y azidas [3+2]
El oxanorbornadieno (u otro alqueno activado) reacciona con azidas, dando como producto triazoles. Sin embargo, estos triazoles no son aromáticos como lo son en las reacciones CuAAC o SPAAC, y como resultado no son tan estables. El doble enlace activado en el oxanobornadieno forma un intermediario triazolina que posteriormente experimenta espontáneamente una reacción retro Diels-alder para liberar furano y dar 1,2,3- o 1,4,5-triazoles. Aunque esta reacción es lenta, es útil porque el oxabornodieno es relativamente simple de sintetizar. Sin embargo, la reacción no es completamente quimioselectiva. [40]
Demanda inversa de Diels-Alder para alquenos y tetrazinas

Los ciclooctenos deformados y otros alquenos activados reaccionan con tetrazinas en una reacción de Diels-Alder con demanda inversa de electrones seguida de una cicloadición retro [4+2] (véase la figura). [41] Al igual que las otras reacciones del trans-cicloocteno, la liberación de la tensión del anillo es una fuerza impulsora para esta reacción. Por lo tanto, los cicloalquenos de tres y cuatro miembros, debido a su alta tensión del anillo, son sustratos ideales para alquenos. [41]
De manera similar a otras cicloadiciones [4+2], los sustituyentes donadores de electrones en el dienófilo y los sustituyentes atractores de electrones en el dieno aceleran la reacción de Diels-Alder de demanda inversa. El dieno, la tetrazina, en virtud de tener los nitrógenos adicionales, es un buen dieno para esta reacción. El dienófilo, el alqueno activado, a menudo se puede unir a grupos alquilo donadores de electrones en las moléculas objetivo, lo que hace que el dienófilo sea más adecuado para la reacción. [42]
Alqueno y tetrazolfotoclicreacción
La reacción de "fotoclic" de tetrazol-alqueno es otra adición dipolar que Huisgen introdujo por primera vez a fines de la década de 1960 ChemBioChem 2007, 8, 1504. (68) Clovis, JS; Eckell, A.; Huisgen, R.; Sustmann, R. Chem. Ber. 1967, 100, 60.) Los tetrazoles con grupos amino o estirilo que se pueden activar con luz UV a 365 nm (365 no daña las células) reaccionan rápidamente (de modo que la luz UV no tiene que estar encendida durante mucho tiempo, generalmente alrededor de 1 a 4 minutos) para producir productos de pirazolina fluorogénica. Este esquema de reacción es muy adecuado para el propósito de marcaje en células vivas, porque la luz UV a 365 nm daña las células mínimamente. Además, la reacción avanza rápidamente, de modo que la luz UV se puede administrar durante períodos cortos. Los rendimientos cuánticos para la luz ultravioleta de longitud de onda corta pueden ser superiores a 0,5. Esto permite que los tetrazoles se utilicen de forma selectiva en función de la longitud de onda en combinación con otra reacción de fotoligación, donde en la longitud de onda corta la reacción de ligación del tetrazol se produce casi exclusivamente y en la longitud de onda más larga se produce exclusivamente otra reacción (ligación mediante o-quinodimetanos). [43] Por último, los reactivos no fluorogénicos dan lugar a un producto fluorogénico, lo que dota a la reacción de un control espectrométrico integrado.
Tanto los tetrazoles como los grupos alquenos se han incorporado como controladores de proteínas como aminoácidos artificiales, pero este beneficio no es único. En cambio, la fotoinducibilidad de la reacción la convierte en una candidata principal para la especificidad espaciotemporal en sistemas vivos. Los desafíos incluyen la presencia de alquenos endógenos, aunque generalmente cis (como en los ácidos grasos) aún pueden reaccionar con el tetrazol activado. [44]
Aplicaciones
Los criterios para las reacciones de clic están diseñados para que la química sea biocompatible, para aplicaciones como el aislamiento y la selección de moléculas en entornos biológicos complejos. En tales entornos, los productos deben ser fisiológicamente estables y los subproductos no deben ser tóxicos (para sistemas in vivo ).
En muchas aplicaciones, las reacciones de clic unen una biomolécula y una molécula reportera u otra sonda molecular, un proceso llamado bioconjugación . [45] La posibilidad de unir fluoróforos y otras moléculas reporteras ha hecho de la química de clic una herramienta muy poderosa para identificar, localizar y caracterizar biomoléculas antiguas y nuevas.
Uno de los primeros y más importantes métodos de bioconjugación fue expresar un gen reportero, como el gen de la proteína fluorescente verde (GFP), en la misma secuencia genética que una proteína de interés. De esta manera, la proteína puede ser identificada en células y tejidos por la fluorescencia verde. Sin embargo, este enfoque presenta varias dificultades, ya que la GFP puede afectar la capacidad de la proteína para lograr su forma normal o dificultar su expresión y funciones normales. Además, utilizando este método, la GFP solo puede unirse a proteínas, dejando fuera de su alcance otras clases biomoleculares importantes ( ácidos nucleicos , lípidos , carbohidratos , etc.).
Para superar estos desafíos, los químicos han optado por identificar pares de compañeros de reacción bioortogonales , lo que permite el uso de pequeñas moléculas exógenas como sondas biomoleculares. Se puede unir un fluoróforo a una de estas sondas para generar una señal de fluorescencia al unirse la molécula indicadora al objetivo, de la misma manera que la GFP emite fluorescencia cuando se expresa con el objetivo.
Ahora surgen limitaciones de la química de la sonda hacia su objetivo. Para que esta técnica sea útil en sistemas biológicos, la química de clic debe funcionar en condiciones biológicas o cercanas a ellas, producir pocos subproductos y (idealmente) no tóxicos, tener (preferiblemente) productos únicos y estables en las mismas condiciones y avanzar rápidamente hacia un alto rendimiento en una sola etapa . Las reacciones existentes, como la ligación de Staudinger y la cicloadición 1,3-dipolar de Huisgen , se han modificado y optimizado para tales condiciones de reacción. Hoy en día, la investigación en este campo se ocupa no solo de comprender y desarrollar nuevas reacciones y reutilizar y volver a comprender las reacciones conocidas, sino también de expandir los métodos utilizados para incorporar socios de reacción en sistemas vivos, diseñar nuevos socios de reacción y desarrollar aplicaciones para la bioconjugación.
Al desarrollar reacciones bioortogonales específicas y controlables , los científicos han abierto la posibilidad de alcanzar objetivos particulares en lisados celulares complejos . Recientemente, los científicos han adaptado la química de clic para su uso en células vivas, por ejemplo, utilizando sondas de moléculas pequeñas que encuentran y se adhieren a sus objetivos mediante reacciones de clic. A pesar de los desafíos de la permeabilidad celular, la bioortogonalidad, el etiquetado de fondo y la eficiencia de la reacción, las reacciones de clic ya han demostrado ser útiles en una nueva generación de experimentos de pulldown (en los que se pueden aislar objetivos particulares utilizando, por ejemplo, moléculas reporteras que se unen a una cierta columna) y espectrometría de fluorescencia (en la que el fluoróforo se une a un objetivo de interés y el objetivo se cuantifica o localiza). Más recientemente, se han utilizado métodos novedosos para incorporar socios de reacción de clic sobre y dentro de biomoléculas , incluida la incorporación de aminoácidos no naturales que contienen grupos reactivos en proteínas y la modificación de nucleótidos . Estas técnicas representan una parte del campo de la biología química , en el que la química de clic juega un papel fundamental al acoplar intencional y específicamente unidades modulares a varios extremos.
La empresa de biotecnología Shasqi es una empresa que aprovecha la química del clic en humanos. [46] [47]
La química de clic no se limita a las condiciones biológicas: el concepto de reacción de "clic" se ha utilizado en aplicaciones de quimioproteómica , farmacológica, biomimética y de maquinaria molecular . [48]
La química del clic es una herramienta poderosa para investigar la localización celular de moléculas pequeñas. Saber dónde se ubican las moléculas pequeñas en la célula brinda información valiosa sobre sus mecanismos de acción. [49] Este enfoque se ha utilizado en numerosos estudios y los descubrimientos incluyen que la salinomicina se localiza en los lisosomas para iniciar la ferroptosis en las células madre cancerosas [50] y que los derivados de la metformina se acumulan en las mitocondrias para formar quelatos de cobre (II), lo que afecta el metabolismo y los cambios epigenéticos posteriores en los macrófagos inflamatorios. [51]
El potencial comercial de la química click es grande. El fluoróforo rodamina se ha acoplado al norborneno y se ha hecho reaccionar con tetrazina en sistemas vivos. [52] En otros casos, la SPAAC entre un fluoróforo modificado con ciclooctina y proteínas marcadas con azida permitió la selección de estas proteínas en lisados celulares. [53]
Los métodos para la incorporación de socios de reacción de clic en sistemas in vivo y ex vivo contribuyen al alcance de las reacciones posibles. El desarrollo de la incorporación de aminoácidos no naturales por los ribosomas ha permitido la incorporación de socios de reacción de clic como grupos laterales no naturales en estos aminoácidos no naturales. Por ejemplo, un UAA con un grupo lateral azida proporciona un acceso conveniente para los cicloalquinos a las proteínas marcadas con este aminoácido no natural "AHA". [54] En otro ejemplo, "CpK" tiene un grupo lateral que incluye un enlace alfa de ciclopropano a un enlace amida que sirve como socio de reacción para la tetrazina en una reacción inversa de Diels-Alder. [55]
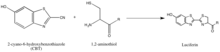
La síntesis de luciferina ejemplifica otra estrategia para aislar a los participantes en la reacción, que consiste en aprovechar grupos naturales que rara vez se encuentran, como el 1,2-aminotiol, que aparece solo cuando una cisteína es el aminoácido N' final en una proteína. Su selectividad natural y bioortogonalidad relativa son, por lo tanto, valiosas para desarrollar sondas específicas para estas etiquetas. La reacción anterior se produce entre un 1,2-aminotiol y un 2-cianobenzotiazol para formar luciferina, que es fluorescente. Esta fluorescencia de luciferina se puede cuantificar mediante espectrometría después de un lavado y se puede utilizar para determinar la presencia relativa de la molécula que contiene el 1,2-aminotiol. Si se desea cuantificar la proteína que no contiene 1,2-aminotiol, se puede escindir la proteína de interés para obtener un fragmento con un N' Cys que sea vulnerable al 2-CBT. [56]
Las aplicaciones adicionales incluyen:
- separación por electroforesis en gel bidimensional [57]
- Síntesis orgánica preparativa de triazoles 1,4-sustituidos
- Modificación de la función de los péptidos con triazoles
- Modificación de productos naturales y farmacéuticos.
- descubrimiento de productos naturales [58]
- descubrimiento de fármacos
- Macrociclaciones mediante acoplamientos de triazol catalizados con Cu(I)
- Modificación del ADN y de los nucleótidos mediante ligación de triazol.
- Química supramolecular : calixarenos , rotaxanos y catenanos
- diseño de dendrímero
- Agrupaciones de carbohidratos y conjugación de carbohidratos mediante reacciones de ligadura de triazol catalizadas por Cu(1)
- polímeros y biopolímeros [59]
- superficies [60]
- ciencia de los materiales
- nanotecnología, [61]
- bioconjugación, por ejemplo, azidocumarina , y
- biomateriales [62]
En combinación con la química combinatoria , el cribado de alto rendimiento y la creación de bibliotecas químicas , la química clic ha acelerado el descubrimiento de nuevos fármacos al hacer que cada reacción en una síntesis de varios pasos sea rápida, eficiente y predecible.
Licencia de tecnología
El Scripps Research Institute tiene una cartera de patentes de química de clic. [63] Los licenciatarios incluyen a Invitrogen , [64] Allozyne , [65] Aileron, [66] Integrated Diagnostics, [67] y la empresa de biotecnología baseclick, [68] una empresa derivada de BASF creada para vender productos fabricados con química de clic. [69] Además, baseclick posee una licencia exclusiva mundial para el mercado de investigación y diagnóstico en el campo de los ácidos nucleicos. Las azidas y alquinos fluorescentes también son producidos por empresas como Cyandye. [70]
Referencias
- ^ HC Kolb; MG Finn; KB Sharpless (2001). "Química del clic: función química diversa a partir de unas pocas reacciones buenas". Angewandte Chemie International Edition . 40 (11): 2004–2021. doi :10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5. PMID 11433435.
- ^ RA Evans (2007). "El auge de la cicloadición 'clic' dipolar de azida-alquino y su aplicación a la ciencia de polímeros y la modificación de superficies". Revista australiana de química . 60 (6): 384–395. doi :10.1071/CH06457.
- ^ Conferencia del Premio Nobel: Barry Sharpless, Premio Nobel de Química 2022 , consultado el 4 de enero de 2024
- ^ "El Premio Nobel de Química 2022". NobelPrize.org . Consultado el 5 de octubre de 2022 .
- ^ ab Wang, Xifan; Schmidt, Franziska; Hanaor, Dorian; Kamm, Paul H.; Li, Shuang; Gurlo, Aleksander (6 de mayo de 2019). "Fabricación aditiva de cerámica a partir de polímeros precerámicos: un enfoque estereolitográfico versátil asistido por la química de clic de tiol-eno". Fabricación aditiva . 27 : 80–90. arXiv : 1905.02060 . doi :10.1016/j.addma.2019.02.012. S2CID 104470679.
- ^ Spiteri, Christian; Moses, John E. (2010). "Cicloadición de azida-alquino catalizada por cobre: síntesis regioselectiva de 1,2,3-triazoles 1,4,5-trisustituidos". Angewandte Chemie International Edition . 49 (1): 31–33. doi :10.1002/anie.200905322. PMID 19921729.
- ^ Hoyle, Charles E.; Bowman, Christopher N. (2010). "Química de clic de tiol-eno". Angewandte Chemie International Edition . 49 (9): 1540–1573. doi :10.1002/anie.200903924. PMID 20166107.
- ^ Lowe, AB Química de polímeros 2010 , 1 (1), 17–36. DOI: 10.1039/B9PY00216B
- ^ Blackman, Melissa L.; Royzen Maksim; Fox, Joseph M. (2008). "Ligación de tetrazina: bioconjugación rápida basada en la reactividad de Diels-Alder con demanda inversa de electrones". Journal of the American Chemical Society . 130 (41): 13518–13519. doi :10.1021/ja8053805. PMC 2653060 . PMID 18798613.
- ^ Devaraj, Neal K.; Weissleder Ralph y Hilderbrand, Scott A. (2008). "Cicloaddiciones basadas en tetrazina: aplicación al etiquetado de células vivas preseleccionadas". Química de bioconjugados . 19 (12): 2297–2299. doi :10.1021/bc8004446. PMC 2677645 . PMID 19053305.
- ^ Stöckmann, Henning; Neves, Andre; Stairs, Shaun; Brindle, Kevin; Leeper, Finian (2011). "Explorando la química de clic basada en isonitrilo para la ligación con biomoléculas". Química orgánica y biomolecular . 9 (21): 7303–5. doi :10.1039/C1OB06424J. PMID 21915395.
- ^ Kashemirov, Boris A.; Bala, Joy LF; Chen, Xiaolan; Ebetino, FH; Xia, Zhidao; Russell, R. Graham G.; Coxon, Fraser P.; Roelofs, Anke J.; Rogers Michael J.; McKenna, Charles E. (2008). "Risedronato marcado con fluorescencia y análogos relacionados: síntesis de "enlazador mágico". Química de bioconjugados . 19 (12): 2308–2310. doi :10.1021/bc800369c. PMID 19032080.
- ^ Gregory C., Patton (8 de noviembre de 2004). "Desarrollo y aplicaciones de la química de clic" (PDF) . Departamento de Química. Facultad de Artes y Ciencias Liberales, Universidad de Illinois en Urbana-Champaign. Archivado desde el original (PDF) el 9 de julio de 2010.
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ Kolb, HC; Sharpless, BK (2003). "El creciente impacto de la química de clic en el descubrimiento de fármacos". Drug Discov Today . 8 (24): 1128–1137. doi : 10.1016/S1359-6446(03)02933-7 . PMID 14678739.
- ^ abc L. Liang y D. Astruc: "La reacción de "clic" de cicloadición de azida de alquino catalizada por cobre (I) (CuAAC) y sus aplicaciones. Una descripción general", 2011; 255, 23–24, 2933–2045, pág. 2934
- ^ Rostovtsev, Vsevolod V.; Green, Luke G; Fokin, Valery V.; Sharpless, K. Barry (2002). "Un proceso de cicloadición de Huisgen por pasos: "ligadura" regioselectiva catalizada por cobre (I) de azidas y alquinos terminales". Angewandte Chemie International Edition . 41 (14): 2596–2599. doi :10.1002/1521-3773(20020715)41:14<2596::aid-anie2596>3.0.co;2-4. PMID 12203546.
- ^ Tornoe, CW; Christensen, C.; Meldal, M. (2002). "Peptidotriazoles en fase sólida: [1,2,3]-triazoles por cicloadiciones 1,3-dipolares de alquinos terminales a azidas catalizadas por cobre(I) regioespecífico". Journal of Organic Chemistry . 67 (9): 3057–3064. doi :10.1021/jo011148j. PMID 11975567. S2CID 11957672.
- ^ K. Wang, X. Bi, S. Xing, P. Liao, Z. Fang, X. Meng, Q. Zhang, Q. Liu, Y. Ji Green Chem. , 13 (2011), pág. 562
- ^ BT Worrell, JA Malik, VV Fokin 2013, 340, 457–459; JE Hein, VV Fokin, Chem. Soc. Rev.39 (2010) 1302.
- ^ Rodionov, Valentin O.; Fokin, Valery V.; Finn, MG (8 de abril de 2005). "Mecanismo de la reacción de cicloadición de azida-alquino catalizada por CuI sin ligando". Angewandte Chemie International Edition . 44 (15): 2210–2215. doi :10.1002/anie.200461496. ISSN 1521-3773. PMID 15693051.
- ^ Iacobucci, Claudio; Reale, Samantha; Gal, Jean-François; De Angelis, Francesco (2015-03-02). "Intermediarios de cobre dinucleares en cicloadición azida-alquino catalizada por cobre (I) directamente observados por espectrometría de masas de ionización por electrospray". Angewandte Chemie International Edition . 54 (10): 3065–3068. doi :10.1002/anie.201410301. ISSN 1521-3773. PMID 25614295.
- ^ Özkılıç, Yılmaz; Tüzün, Nurcan Ş. (22 de agosto de 2016). "Un estudio DFT sobre la reacción binuclear CuAAC: mecanismo a la luz de nuevos experimentos". Organometálicos . 35 (16): 2589–2599. doi :10.1021/acs.organomet.6b00279. ISSN 0276-7333.
- ^ Ziegler, Miqueas S.; Lakshmi, KV; Tilley, T. Don (19 de abril de 2017). "Complejos de dicobre Cu (I) Cu (I) y Cu (I) Cu (II) en cicloadición de azida-alquino catalizada por cobre" (PDF) . Revista de la Sociedad Química Estadounidense . 139 (15): 5378–5386. doi :10.1021/jacs.6b13261. ISSN 0002-7863. PMID 28394586.
- ^ Brotherton, WS; Michaels, HA; Simmons, JT; Clark, RJ; Dalal, NS; Zhu, L. Org. Lett. 2009, 11, 4954.
- ^ Kuang, G.-C.; Michaels, HA; Simmons, JT; Clark, RJ; Zhu, L" J. Org. Chem. 2010; 75, 6540.
- ^ Uttamapinant, C.; Tangpeerachaikul, A.; Griego, S.; Clarke, S.; Singh, U.; Slade, P.; Vaya, KR; Ting, A. Y" Angew. Chem. Int. Ed. 2012; 51, 5852
- ^ Aliso, K.; Stein, G.; Finzenhagen, H. Justus Liebigs Ann.Chem 1931, 485, 211.
- ^ Alder, K.; Stein, G. Justus Liebigs Ann. Química. 1933, 501, 1.
- ^ Wittig, G.; Krebs, A. Química. 1961, 94, 3260.
- ^ Zhang, Li; Chen, Xinguo; Xue, Peng; Sun, Herman HY; Williams, Ian D.; Sharpless, K. Barry; Fokin, Valery V.; Jia, Guochen (noviembre de 2005). "Cicloadición de alquinos y azidas orgánicas catalizada por rutenio". Revista de la Sociedad Química Americana . 127 (46): 15998–15999. doi :10.1021/ja054114s. PMID 16287266.
- ^ Huisgen, R. Angew. Química. Ed. Engl. 1963, 2, 565
Agard, NJ; Baskin, JM; Prescher, JA; Lo, A.; Bertozzi, CR (2006). "Un estudio comparativo de reacciones bioortogonales con azidas". ACS Chem. Biol . 1 (10): 644–648. doi :10.1021/cb6003228. PMID 17175580.
- ^ Agard, NJ; Baskin, JM; Prescher, JA; Lo, A.; Bertozzi, CR (2006). "Un estudio comparativo de reacciones bioortogonales con azidas". ACS Chem. Biol . 1 (10): 644–648. doi :10.1021/cb6003228. PMID 17175580.
- ^ Codelli, JA; Baskin, JM; Agard, NJ; Bertozzi, CR (2008). "Ciclooctinas difluoradas de segunda generación para química de clic sin cobre". J. Am. Chem. Soc . 130 (34): 11486–11493. doi :10.1021/ja803086r. PMC 2646667. PMID 18680289 .
- ^ Ning, X.; Guo, J.; Wolfert, MA; Boons, G.-J. (2008). "Visualización de glicoconjugados metabólicamente marcados de células vivas mediante cicloadiciones rápidas de Huisgen sin cobre". Angew. Chem. Int. Ed . 47 (12): 2253–2255. doi :10.1002/anie.200705456. PMC 2835304. PMID 18275058 .
- ^ Gordon, CG; Mackey, JL; Jewett, JC; Sletten, EM; Houk, KN; Bertozzi, CR (2012). "Reactividad de biarylazacyclooctynonas en química de clic sin cobre". J. Am. Chem. Soc . 134 (22): 9199–9208. doi :10.1021/ja3000936. PMC 3368396. PMID 22553995 .
- ^ ab MacKenzie, DA; Sherratt, AR; Chigrinova, M; Cheung, LL; Pezacki, JP (agosto de 2014). "Cicloadiciones promovidas por deformación que involucran nitronas y alquinos: reacciones rápidas ajustables para el etiquetado bioortogonal". Curr Opin Chem Biol . 21 : 81–8. doi :10.1016/j.cbpa.2014.05.023. PMID 25022431.
- ^ (64) (a) Ning, X.; Temming, RP; Dommerholt, J.; Guo, J.; Ania, DB; Deudas, MF; Wolfert, MA; Bendiciones, G.-J.; van Delft, F. L" Angew. Chem. Int. Ed. 2010; 49, 3065. (b) McKay, CS; Moran, J.; Pezacki, JP Chem. Commun. (Cambridge, Reino Unido) 2010, 46, 931 (c) Debets, MF; van Berkel, SS; , M.; Blake, JA; Pezacki, JP Org.
- ^ ab Lang, K.; Chin, J. (2014). "Reacciones bioortogonales para el etiquetado de proteínas". ACS Chem. Biol . 9 (1): 16–20. doi :10.1021/cb4009292. PMID 24432752.
- ^ MacKenzie, DA; Pezacki, JP (2014). "Estudios cinéticos de cicloadiciones [3+2] de nitronas promovidas por deformación rápida con biciclo[6.1.0]nonino". Can J Chem . 92 (4): 337–340. doi :10.1139/cjc-2013-0577.
- ^ (67) (a) van Berkel, SS; Dirks, ATJ; Meeuwissen, SA; Pingen, DLL; Boerman, OC; Laverman, P.; van Delft, Florida; Cornelissen, JJLM; Rutjes, FPJT ChemBioChem 2008, 9, 1805. (b) van Berkel, SS; Dirks, ATJ; Deudas, MF; van Delft, Florida; Cornelissen, JJLM; Nolte, RJM; Rutjes, FPJT ChemBioChem 2007, 8, 150
- ^ ab Liu, Fang; Paton, Robert S.; Kim, Seonah; Liang, Yong; Houk, KN (2013). "Reactividades de Diels-Alder de cicloalquenos deformados y no deformados con dienos de demanda de electrones normal e inversa: barreras de activación y análisis de distorsión/interacción". J. Am. Chem. Soc . 135 (41): 15642–15649. doi :10.1021/ja408437u. PMID 24044412.
- ^ Rieder, Ulrike; Luedtke, Nathan W. (25 de agosto de 2014). "Ligamentación de alqueno-tetrazina para la obtención de imágenes de ADN celular". Angew Chem Int Ed Engl . 53 (35): 9168–9172. doi :10.1002/anie.201403580. PMID 24981416.
- ^ Menzel, enero P.; Feist, Florian; Tuten, Bryan; Bueno, Tanja; Blinco, James P.; Barner-Kowollik, Christopher (2019). "Formación de enlaces covalentes ortogonales controlados por luz en dos longitudes de onda diferentes". Edición internacional Angewandte Chemie . 58 (22): 7470–7474. doi : 10.1002/anie.201901275 . hdl : 21.11116/0000-0003-99B4-5 . PMID 30916368.
- ^ Ramil, Carlo P; Lin, Qing (agosto de 2014). "Química del fotoclic: una reacción de ligación in vivo activada por luz fluorogénica". Current Opinion in Chemical Biology . 21 : 89–95. doi :10.1016/j.cbpa.2014.05.024. PMC 4149939 . PMID 25022432.
- ^ B. Stump (2022). "Bioconjugación por clic: modificación de proteínas mediante química similar al clic". ChemBioChem . 23 (16): e202200016. doi :10.1002/cbic.202200016. PMID 35491526. S2CID 248494718.
- ^ "La revolución bioortogonal". Chemistry World . Consultado el 11 de noviembre de 2022 .
- ^ "Socios químicos en fase de luna de miel suministran un fármaco tóxico a los tumores". Revista Discover . Consultado el 11 de noviembre de 2022 .
- ^ Carroll, GT; Londres, G.; Fernández-Landaluce, T.; Rudolf, P.; Feringa, BL (2011). "Adhesión de motores moleculares impulsados por fotones a superficies mediante cicloadiciones 1,3-dipolares: efecto de las interacciones interfaciales en el movimiento molecular" (PDF) . ACS Nano . 5 (1): 622–630. doi :10.1021/nn102876j. PMID 21207983. S2CID 39105918.
- ^ Cañeque, Tatiana; Müller, Sebastian; Rodriguez, Raphaël (2018). "Visualización de pequeñas moléculas biológicamente activas en células mediante química de clic". Nature Reviews Chemistry . 2 (9): 202–215. doi :10.1038/s41570-018-0030-x. S2CID 91366817.
- ^ Mai, Trang Thi; Hamaï, Ahmed; Hienzsch, Antje; Cañeque, Tatiana; Müller, Sebastián; Wicinski, Julien; Cabaud, Olivier; Leroy, Cristina; David, Amandina; Acevedo, Verónica; Ryo, Akihide; Ginéstier, Christophe; Birnbaum, Daniel; Charafe-Jauffret, Emmanuelle; Codogno, Patrice; Mehrpour, Maryam; xRodríguez, Raphaël Rodríguez (octubre de 2017). "La salinomicina mata las células madre cancerosas secuestrando hierro en los lisosomas". Química de la Naturaleza . 9 (10): 1025-1033. doi :10.1038/nchem.2778. PMC 5890907 . PMID 28937680.
- ^ Solier, Stéphanie; Müller, Sebastián; Tatiana, Cañeque; Antonio, Versini; Arnaud, Mansart; Fabien, Sindikubwabo; Leeroy, barón; Laila, Emán; Pierre, Gestraud; G. Dan, Pantoș; Vicente, Gandón; Cristina, Gaillet; Ting-Di, Wu; Florent, Dingli; Damarys, Loew; Sylvain, Baulande; Sylvère, Durand; Valentín, Sencio; Cirilo, Robil; François, Trottein; David, Pericat; Emmanuelle, Näser; Céline, Cougoule; Etienne, Meunier; Anne-Laure, Bègue; Hélène, Salmón; Nicolás, Manel; Alain, Puisieux; Sara, Watson; Mark A., Dawson; Nicolás, sirviente; Guido, Kroemer; Djillali, Annane; Raphaël, Rodriguez (2023). "Una vía de señalización del cobre que impulsa la inflamación y que puede tratarse con fármacos". Nature . 617 (7960): 386–394. doi :10.1038/s41586-023-06017-4. PMC 10131557 . PMID 37100912.
- ^ Devaraj, Neal K.; Weissleder, Ralph; Hilderbrand, Scott A. (diciembre de 2008). "Cicloadiciones basadas en tetrazina: aplicación a la obtención de imágenes de células vivas preseleccionadas". Bioconjugate Chem . 19 (12): 2297–2299. doi :10.1021/bc8004446. PMC 2677645. PMID 19053305 .
- ^ Ding, H.; Demple, B (2000). "Transducción directa de la señal de óxido nítrico a través de la nitrosilación de centros de hierro-azufre en el activador de la transcripción SoxR". Proc. Natl. Sci. USA . 97 (10): 5146–5150. Bibcode :2000PNAS...97.5146D. doi : 10.1073/pnas.97.10.5146 . PMC 25796 . PMID 10805777.
- ^ Dieterich; et al. (2007). "Etiquetado, detección e identificación de proteomas recién sintetizados con marcado de aminoácidos no canónicos bioortogonales". Nature Protocols . 2 (3): 532–540. doi :10.1038/nprot.2007.52. PMID 17406607. S2CID 2833184.
- ^ Yu; et al. (2012). "El ciclopropeno codificado genéticamente dirige el etiquetado rápido de proteínas mediado por química de fotoclic en células de mamíferos". Angew Chem Int Ed Engl . 51 (42): 10600–10604. doi :10.1002/anie.201205352. PMC 3517012. PMID 22997015 .
- ^ (a) Liang, G.; Ren, H.; Rao, J. Nat. Chem. 2010, 2, 54. (b) Ren, H.; Xiao, F.; Zhan, K.; Kim, Y.-P.; Xie, H.; Xia, Z.; Rao, J. Angew.Chem., Int. Ed. 2009, 48, 9658.
- ^ Ilya A. Osterman; Alexei V. Ustinov; Denis V. Evdokimov; Vladimir A. Korshun; Petr V. Sergiev; Marina V. Serebryakova; Irina A. Demina; María A. Galyamina; Vadim M. Govorun; Olga A. Dontsova (enero de 2013). "Un estudio incipiente del proteoma que combina la química del clic con 2DE" (PDF) . Proteómica . 13 (1): 17–21. doi :10.1002/pmic.201200393. PMID 23161590. S2CID 9002232. Archivado desde el original (PDF) el 30 de junio de 2015 . Consultado el 11 de febrero de 2015 .
- ^ Cox, Courtney L.; Tietz, Jonathan I.; Sokolowski, Karol; Melby, Joel O.; Doroghazi, James R.; Mitchell, Douglas A. (17 de junio de 2014). "1,4-Adiciones nucleofílicas para el descubrimiento de productos naturales". ACS Chemical Biology . 9 (9): 2014–2022. doi :10.1021/cb500324n. PMC 4168802 . PMID 24937678.
- ^ Michael Floros; Alcides Leão; Suresh Narine (2014). "Química de clic" libre de catalizador y disolventes derivados de aceites vegetales en politriazoles termoplásticos". BioMed Research International . 2014 : 1–14. doi : 10.1155/2014/792901 . PMC 4085725 . PMID 25032224.
- ^ Londres, Gábor; Chen, Kuang-Yen; Carroll, Gregory T.; Feringa, Ben L. (2013). "Hacia el control dinámico de la mojabilidad mediante el uso de motores moleculares altitudinales funcionalizados en superficies sólidas". Química: una revista europea . 19 (32): 10690–10697. doi :10.1002/chem.201300500. PMID 23784916. S2CID 5759186.
- ^ John E. Moses; Adam D. Moorhouse (2007). "Las crecientes aplicaciones de la química de clic". Chem. Soc. Rev. 36 (8): 1249–1262. doi :10.1039/b613014n. PMID 17619685.
- ^ Jean-François Lutz; Zoya Zarafshani (2008). "Construcción eficiente de terapias, bioconjugados, biomateriales y superficies bioactivas utilizando la química de "clic" de azida-alquino". Advanced Drug Delivery Reviews . 60 (9): 958–970. doi :10.1016/j.addr.2008.02.004. PMID 18406491.
- ^ "Click Chemistry". Archivado desde el original el 15 de mayo de 2012. Consultado el 5 de junio de 2012 .
- ^ "Invitrogen obtiene la licencia exclusiva de nuevos ensayos de proliferación celular basados en química de clic de la Universidad de Harvard (NASDAQ:LIFE)". Archivado desde el original el 17 de diciembre de 2012. Consultado el 5 de junio de 2012 .
- ^ "Xconomy: Allozyne obtiene la licencia de Scripps Chemistry". 15 de julio de 2010.
- ^ "Xconomy: Aileron y Scripps firman acuerdo". 30 de noviembre de 2010.
- ^ "Licencias de Diagnóstico Integrado "Click Chemistry" del Scripps Research Institute, Fortaleciendo la Red de Socios". Archivado desde el original el 2012-04-30 . Consultado el 2012-06-05 .
- ^ "baseclick GmbH :: Hacemos posible la bioconjugación mediante etiquetado de ácidos nucleicos". baseclick GmbH . Consultado el 21 de marzo de 2022 .
- ^ http://www.basf.com/group/pressrelease/P-10-427 [ enlace muerto permanente ]
- ^ "CYANDYE". 3 de octubre de 2018. Archivado desde el original el 3 de octubre de 2018. Consultado el 21 de marzo de 2022 .
Enlaces externos
- Química: breve reseña y literatura reciente
- Fundación Nacional de la Ciencia: artículo "Lanzamiento de Click Chemistry"
- Noticias de química e ingeniería: artículo "Química in situ con clic"
- Noticias de química e ingeniería: artículo "Química de clic sin cobre"
- Revisión de la química de clic sin metales
- Click Chemistry: un número temático de Chem Soc Rev que destaca las últimas aplicaciones de la química de clics, editado por invitados por MG Finn y Valery Fokin. Publicado por la Royal Society of Chemistry
