Citometría de flujo
 Un citómetro de flujo con tubo de inyección de muestra. | |
| Clasificación | Citometría |
|---|---|
| Analitos | Células o partículas |
| Otras técnicas | |
| Relacionado | Contador Coulter |
La citometría de flujo ( CF ) es una técnica utilizada para detectar y medir las características físicas y químicas de una población de células o partículas. [1] [2] [3] [4]
En este proceso, una muestra que contiene células o partículas se suspende en un fluido y se inyecta en el instrumento del citómetro de flujo . La muestra se enfoca para que fluya idealmente una célula a la vez a través de un haz de láser, donde la luz dispersada es característica de las células y sus componentes. Las células suelen estar etiquetadas con marcadores fluorescentes para que la luz se absorba y luego se emita en una banda de longitudes de onda. Se pueden examinar rápidamente decenas de miles de células y los datos recopilados se procesan mediante una computadora. [5]
La citometría de flujo se utiliza de forma rutinaria en la investigación básica, la práctica clínica y los ensayos clínicos . Los usos de la citometría de flujo incluyen:
- Conteo de células
- Clasificación celular
- Determinación de las características y funciones celulares.
- Detección de microorganismos
- Detección de biomarcadores
- Detección de ingeniería de proteínas
- Diagnóstico de trastornos de salud como cánceres de la sangre.
- Medición del tamaño del genoma
Un analizador de citometría de flujo es un instrumento que proporciona datos cuantificables de una muestra. Otros instrumentos que utilizan la citometría de flujo incluyen los clasificadores de células que separan físicamente y, por lo tanto, purifican las células de interés en función de sus propiedades ópticas.
Historia
El primer dispositivo de citometría de flujo basado en impedancia , que utiliza el principio de Coulter , se describió en la patente estadounidense 2.656.508, otorgada en 1953 a Wallace H. Coulter . Mack Fulwyler fue el inventor del precursor de los citómetros de flujo actuales, en particular el clasificador de células. [6] Fulwyler desarrolló este en 1965 con su publicación en Science . [7] El primer dispositivo de citometría de flujo basado en fluorescencia (ICP 11) fue desarrollado en 1968 por Wolfgang Göhde de la Universidad de Münster , presentado para patente el 18 de diciembre de 1968 [8] y comercializado por primera vez en 1968/69 por el desarrollador y fabricante alemán Partec a través de Phywe AG en Göttingen . En ese momento, los métodos de absorción todavía eran ampliamente favorecidos por otros científicos sobre los métodos de fluorescencia . [9] Poco después, se desarrollaron instrumentos de citometría de flujo, entre ellos el Cytofluorograph (1971) de Bio/Physics Systems Inc. (posteriormente: Ortho Diagnostics), el PAS 8000 (1973) de Partec, el primer instrumento FACS (clasificación de células activada por fluorescencia) de Becton Dickinson (1974), el ICP 22 (1975) de Partec/Phywe y los Epics de Coulter (1977/78). Amphasys (2012) presentó el primer citómetro de flujo de impedancia de alta frecuencia sin etiquetas basado en un "laboratorio en chip" microfluídico patentado, el Ampha Z30. [ cita requerida ]
Nombre de la tecnología
El nombre original de la tecnología de citometría de flujo basada en fluorescencia fue "citofotometría de pulso" ( en alemán : Impulszytophotometrie ), basado en la primera solicitud de patente sobre citometría de flujo basada en fluorescencia. En la 5.ª Conferencia de la Fundación Americana de Ingeniería sobre Citología Automatizada en Pensacola (Florida) en 1976, ocho años después de la introducción del primer citómetro de flujo basado en fluorescencia (1968), se acordó utilizar comúnmente el nombre "citometría de flujo", un término que rápidamente se hizo popular. [10]
Citómetros de flujo
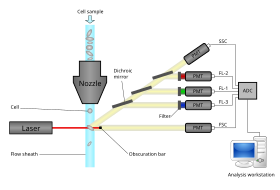
Los citómetros de flujo modernos pueden analizar miles de partículas por segundo, en "tiempo real" y, si se configuran como clasificadores de células, pueden separar y aislar activamente partículas con propiedades ópticas específicas a velocidades similares. Un citómetro de flujo es similar a un microscopio , excepto que, en lugar de producir una imagen de la célula, la citometría de flujo ofrece una cuantificación automatizada de alto rendimiento de parámetros ópticos específicos célula por célula. Para analizar tejidos sólidos , primero se debe preparar una suspensión de células individuales. [ cita requerida ]
Un citómetro de flujo tiene cinco componentes principales: una celda de flujo, un sistema de medición, un detector, un sistema de amplificación y una computadora para el análisis de las señales. La celda de flujo tiene una corriente de líquido (fluido envolvente), que transporta y alinea las células para que pasen en fila india a través del haz de luz para la detección. El sistema de medición utiliza comúnmente la medición de impedancia (o conductividad) y sistemas ópticos: lámparas ( mercurio , xenón ); láseres de alta potencia refrigerados por agua ( argón , criptón , láser de colorante); láseres de baja potencia refrigerados por aire (argón (488 nm), rojo-HeNe (633 nm), verde-HeNe, HeCd (UV)); láseres de diodo (azul, verde, rojo, violeta) que dan como resultado señales de luz. El detector y el sistema de conversión analógico-digital (ADC) convierten las mediciones analógicas de luz dispersa frontal (FSC) y luz dispersa lateral (SSC), así como las señales de fluorescencia específicas del colorante en señales digitales que pueden procesarse mediante una computadora. El sistema de amplificación puede ser lineal o logarítmico . [ cita requerida ]
El proceso de recolección de datos de muestras utilizando el citómetro de flujo se denomina "adquisición". La adquisición está mediada por una computadora conectada físicamente al citómetro de flujo y el software que maneja la interfaz digital con el citómetro. El software es capaz de ajustar parámetros (por ejemplo, voltaje, compensación) para la muestra que se está analizando y también ayuda a mostrar la información inicial de la muestra mientras se adquieren los datos de la muestra para garantizar que los parámetros se configuren correctamente. Los primeros citómetros de flujo eran, en general, dispositivos experimentales, pero los avances tecnológicos han permitido aplicaciones generalizadas para su uso en una variedad de propósitos tanto clínicos como de investigación. Debido a estos avances, se ha desarrollado un mercado considerable para la instrumentación, el software de análisis, así como los reactivos utilizados en la adquisición, como los anticuerpos marcados con fluorescencia .
Los instrumentos modernos suelen tener múltiples láseres y detectores de fluorescencia. El récord actual para un instrumento comercial es de diez láseres [11] y 30 detectores de fluorescencia [12] . Aumentar el número de láseres y detectores permite el etiquetado de múltiples anticuerpos y puede identificar con mayor precisión una población objetivo por sus marcadores fenotípicos . Algunos instrumentos pueden incluso tomar imágenes digitales de células individuales, lo que permite el análisis de la ubicación de la señal fluorescente dentro o sobre la superficie de las células. [ cita requerida ]
Hardware
Sistema fluídico de un citómetro de flujo
Las células deben pasar de manera uniforme a través del centro de los rayos láser enfocados para medir con precisión las propiedades ópticas de las células en cualquier citómetro de flujo. [13] [14] [15] El propósito del sistema fluídico es mover las células una por una a través del rayo láser y por todo el instrumento. La fluídica en un citómetro de flujo con capacidades de clasificación de células también utiliza la corriente para transportar las células clasificadas a los tubos o pocillos de recolección. [13]
Enfoque hidrodinámico
Para posicionar con precisión las células en un chorro de líquido, en la mayoría de los citómetros se utiliza el enfoque hidrodinámico. [13] [14] Las células en suspensión entran en el instrumento encerradas en un fluido envolvente externo. El núcleo de la muestra se mantiene en el centro del fluido envolvente. La velocidad de entrada de la muestra o la rapidez con la que las células fluyen hacia la interrogación láser se puede controlar mediante la presión del fluido envolvente sobre el núcleo de la muestra. En condiciones óptimas, la corriente de fluido central y el fluido envolvente no se mezclan. [ cita requerida ]
Enfoque hidrodinámico asistido acústicamente
En algunos citómetros de flujo se utiliza tecnología de enfoque acústico para facilitar el enfoque hidrodinámico. [13] [15] Las ondas acústicas (>2 MHz) enfocan previamente la muestra antes de introducirla en el fluido envolvente. A continuación, la muestra preenfocada se inyecta en el núcleo hidrodinámico y fluye a través del instrumento. Esto puede ayudar a aumentar la precisión de los datos con tasas de entrada de muestras elevadas.
Óptica y electrónica
Filtros ópticos
La luz emitida por los fluoróforos se encuentra en un espectro de longitudes de onda, por lo que la combinación de varios fluoróforos puede provocar una superposición. Para añadir especificidad, se utilizan filtros ópticos y espejos dicroicos para filtrar y mover la luz hacia los detectores, como tubos fotomultiplicadores (PMT) o fotodiodos de avalancha (APD). [13] Los filtros ópticos están diseñados como filtros de paso de banda (BP), de paso largo (LP) o de paso corto (SP). La mayoría de los citómetros de flujo utilizan espejos dicroicos y filtros de paso de banda para seleccionar bandas específicas del espectro óptico.
Prismas, rejillas y citometría de flujo espectral
La citometría de flujo espectral utiliza prismas o rejillas de difracción para dispersar la luz emitida por un marcador a través de una matriz de detectores. [13] [16] Esto permite medir los espectros completos de cada partícula. Los espectros medidos de células individuales se desmezclan posteriormente utilizando espectros de referencia de todos los colorantes utilizados y el espectro de autofluorescencia. Esto puede permitir un diseño de panel más amplio y la aplicación de nuevos marcadores biológicos. [ cita requerida ]
Citometría de flujo por imágenes
La citometría de flujo de imágenes (IFC) captura imágenes multicanal de células. [13] [17] Los detectores utilizados en plataformas de imágenes pueden estar equipados con un dispositivo de carga acoplada (CCD) o un semiconductor de óxido metálico complementario (CMOS) para capturar imágenes de células individuales.
Análisis de datos
Compensación
Cada fluorocromo tiene un amplio espectro de fluorescencia. Cuando se utiliza más de un fluorocromo, puede producirse una superposición entre fluorocromos. Esta situación se denomina superposición de espectros y debe corregirse. Por ejemplo, el espectro de emisión de FITC y PE es uno en el que la luz emitida por la fluoresceína se superpone a la misma longitud de onda al pasar por el filtro utilizado para PE. Esta superposición espectral se corrige eliminando una parte de la señal de FITC de las señales de PE o viceversa. Este proceso se denomina compensación de color, que calcula un fluorocromo como un porcentaje para medirse a sí mismo. [18]
La compensación es el proceso matemático mediante el cual se corrige la superposición espectral de datos de citometría de flujo multiparamétricos. Dado que los fluorocromos pueden tener un espectro de amplio alcance, pueden superponerse, lo que provoca el resultado no deseado de confusión durante el análisis de los datos. Esta superposición, conocida como desbordamiento y cuantificada en el coeficiente de desbordamiento, suele estar causada por detectores para un determinado fluorocromo que miden un pico significativo en la longitud de onda de un fluorocromo diferente. El álgebra lineal se utiliza con mayor frecuencia para realizar esta corrección. [18]
En general, cuando se muestran gráficos de uno o más parámetros, se hace para demostrar que los demás parámetros no contribuyen a la distribución mostrada. Especialmente cuando se utilizan parámetros que son más del doble, este problema es más grave. Actualmente, no se han descubierto herramientas para mostrar de manera eficiente parámetros multidimensionales. La compensación es muy importante para ver la distinción entre celdas.

[ cita requerida ]
Puerta de acceso
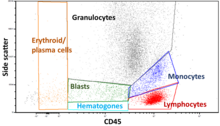
Los datos generados por los citómetros de flujo se pueden representar gráficamente en una sola dimensión para producir un histograma , o en gráficos de puntos bidimensionales, o incluso en tres dimensiones. Las regiones de estos gráficos se pueden separar secuencialmente, en función de la intensidad de fluorescencia , mediante la creación de una serie de extracciones de subconjuntos, denominadas "puertas". Existen protocolos de selección específicos para fines diagnósticos y clínicos, especialmente en relación con la hematología . Las células individuales se distinguen a menudo de los dobletes de células o agregados superiores por su "tiempo de vuelo" (denominado también "ancho de pulso") a través del haz láser estrechamente enfocado [19].
Los gráficos se suelen realizar en escalas logarítmicas. Debido a que los espectros de emisión de los diferentes colorantes fluorescentes se superponen, [20] [21] las señales en los detectores deben compensarse electrónicamente y computacionalmente. Los datos acumulados mediante el citómetro de flujo se pueden analizar mediante software. Una vez que se recopilan los datos, no es necesario permanecer conectado al citómetro de flujo y el análisis se realiza con mayor frecuencia en una computadora separada. [ cita requerida ] Esto es especialmente necesario en las instalaciones centrales donde el uso de estas máquinas tiene una gran demanda. [ cita requerida ]
Análisis computacional
Los recientes avances en la identificación automatizada de poblaciones mediante métodos computacionales han ofrecido una alternativa a las estrategias de selección tradicionales. Los sistemas de identificación automatizada podrían ayudar potencialmente a encontrar poblaciones raras y ocultas. Los métodos automatizados representativos incluyen FLOCK [22] en Immunology Database and Analysis Portal (ImmPort), [23] SamSPECTRAL [24] y flowClust [25] [26] [27] en Bioconductor , y FLAME [28] en GenePattern . T-Distributed Stochastic Neighbor Embedding (tSNE) es un algoritmo diseñado para realizar una reducción de dimensionalidad , para permitir la visualización de datos multidimensionales complejos en un "mapa" bidimensional. [29] Los esfuerzos de colaboración han dado como resultado un proyecto abierto llamado FlowCAP (Flow Cytometry: Critical Assessment of Population Identification Methods, [30] ) para proporcionar una forma objetiva de comparar y evaluar los métodos de agrupamiento de datos de citometría de flujo, y también para establecer una guía sobre el uso y la aplicación adecuados de estos métodos.
Controles FMO
Los controles de fluorescencia menos uno (FMO) son importantes para la interpretación de datos cuando se crean paneles multicolores, en los que una célula se tiñe con múltiples fluorocromos simultáneamente. Los controles FMO proporcionan una medida del derrame de fluorescencia en un canal determinado y permiten la compensación. Para generar un control FMO, una muestra se tiñe con todos los fluorocromos excepto el que se está probando, lo que significa que si está utilizando 4 fluorocromos diferentes, su control FMO debe contener solo 3 de ellos (ejemplo: fluorocromos: A, B, C, D; FMO: ABC_, AB_D, A_CD, _BCD). [ cita requerida ]
Clasificación celular mediante citometría de flujo
La clasificación celular es un método para purificar poblaciones celulares en función de la presencia o ausencia de características físicas específicas. [13] [15] [31] En los citómetros de flujo con capacidades de clasificación, el instrumento detecta células utilizando parámetros que incluyen el tamaño celular, la morfología y la expresión de proteínas, y luego la tecnología de gotas para clasificar las células y recuperar los subconjuntos para uso posterior al experimento. [13] [15]
El primer prototipo de clasificador fue construido en el Laboratorio Nacional de Los Álamos (LANL) en 1965 por el físico Mack J. Fulwyler uniendo un sensor de volumen Coulter con la recién inventada impresora de inyección de tinta. [32] El clasificador de células vivas o clasificador de células activado por fluorescencia (FACS) [a] fue generado por Len Herzenberg , quien posteriormente ganó el Premio Kyoto en 2006 por su trabajo seminal. [34]
_B.jpg/440px-Fluorescence_Assisted_Cell_Sorting_(FACS)_B.jpg)
Los separadores de células por citometría de flujo tienen un sistema de recolección diferente a los analizadores de citometría de flujo. El proceso de recolección comienza cuando se inyecta una muestra en una corriente de fluido envolvente que pasa a través de la celda de flujo y el láser la intercepta. [35] Luego, la corriente lleva la célula a través de una boquilla vibratoria que genera gotitas, la mayoría de las cuales contienen una célula o ninguna célula. Se coloca un anillo de carga eléctrica justo en el punto donde la corriente se rompe en gotitas y se coloca una carga en el anillo inmediatamente antes de que se mida la intensidad de fluorescencia; la carga opuesta queda atrapada en la gotita cuando se rompe de la corriente y, por lo tanto, las gotitas se cargan. Las gotitas cargadas luego caen a través de un sistema de deflexión electrostática que desvía las gotitas hacia contenedores según su carga. En algunos sistemas, la carga se aplica directamente a la corriente y la gotita que se rompe retiene la carga del mismo signo que la corriente. Luego, la corriente se devuelve a neutral después de que la gotita se rompe. Después de la recolección, estas células se pueden cultivar, manipular y estudiar más. [ cita requerida ]
Etiquetas

La citometría de flujo utiliza las propiedades de la luz dispersada por las células o partículas para la identificación o medición cuantitativa de propiedades físicas. Se pueden utilizar marcadores, colorantes y tinciones para el análisis multiparamétrico (para comprender más propiedades de una célula). La inmunofenotipificación es el análisis de poblaciones heterogéneas de células utilizando anticuerpos marcados [36] y otros reactivos que contienen fluoróforos, como colorantes y tinciones.
Etiquetas fluorescentes
Se puede utilizar una amplia gama de fluoróforos como marcadores en la citometría de flujo. [20] Los fluoróforos, o simplemente "flúores", [ cita requerida ] normalmente se unen a un anticuerpo que reconoce una característica diana sobre o en la célula; también pueden estar unidos a una entidad química con afinidad por la membrana celular u otra estructura celular. Cada fluoróforo tiene una excitación máxima característica y una longitud de onda de emisión , y los espectros de emisión a menudo se superponen. En consecuencia, la combinación de marcadores que se pueden utilizar depende de la longitud de onda de la(s) lámpara(s) o láser(es) utilizados para excitar los fluorocromos y de los detectores disponibles. [37] La citometría de flujo utiliza la fluorescencia como una herramienta cuantitativa; la máxima sensibilidad de la citometría de flujo no tiene comparación con otras plataformas de detección fluorescente como la microscopía confocal . La sensibilidad absoluta de la fluorescencia es generalmente menor en la microscopía confocal porque las señales fuera de foco son rechazadas por el sistema óptico confocal y porque la imagen se construye en serie a partir de mediciones individuales en cada ubicación a lo largo de la célula, lo que reduce la cantidad de tiempo disponible para recolectar la señal. [38]
Puntos cuánticos
A veces se utilizan puntos cuánticos en lugar de fluoróforos tradicionales debido a sus picos de emisión más estrechos. [ cita requerida ]
Marcado de isótopos
La citometría de masas supera el límite del marcaje fluorescente al utilizar isótopos de lantánidos unidos a anticuerpos. Este método podría permitir teóricamente el uso de 40 a 60 marcadores distinguibles y se ha demostrado para 30 marcadores. [39] La citometría de masas es fundamentalmente diferente de la citometría de flujo: las células se introducen en un plasma , se ionizan y los isótopos asociados se cuantifican mediante espectrometría de masas de tiempo de vuelo . Aunque este método permite el uso de una gran cantidad de marcadores, actualmente tiene una capacidad de rendimiento menor que la citometría de flujo. También destruye las células analizadas, lo que impide su recuperación mediante clasificación. [39]
Matriz de perlas citométricas
Además de la capacidad de etiquetar e identificar células individuales a través de anticuerpos fluorescentes, también se pueden medir productos celulares como citocinas, proteínas y otros factores. De manera similar a los ensayos sándwich ELISA , los ensayos de matriz de perlas citométricas ( CBA ) utilizan múltiples poblaciones de perlas, típicamente diferenciadas por tamaño y diferentes niveles de intensidad de fluorescencia para distinguir múltiples analitos en un solo ensayo. La cantidad de analito capturado se detecta a través de un anticuerpo biotinilado contra un epítopo secundario de la proteína, seguido de un tratamiento con estreptavidina-R-ficoeritrina. La intensidad fluorescente de R-ficoeritrina en las perlas se cuantifica en un citómetro de flujo equipado con una fuente de excitación de 488 nm. Las concentraciones de una proteína de interés en las muestras se pueden obtener comparando las señales fluorescentes con las de una curva estándar generada a partir de una dilución en serie de una concentración conocida del analito. Comúnmente también se lo conoce como matriz de perlas de citocinas (CBA).
Citometría de flujo de impedancia
Los sistemas de análisis de células individuales basados en impedancia se conocen comúnmente como contadores Coulter . Representan un método bien establecido para contar y dimensionar prácticamente cualquier tipo de células y partículas. La tecnología sin etiquetas se ha mejorado recientemente mediante un enfoque basado en " laboratorio en un chip " y mediante la aplicación de corriente alterna (CA) de alta frecuencia en el rango de radiofrecuencia (de 100 kHz a 30 MHz) en lugar de una corriente continua (CC) estática o un campo de CA de baja frecuencia. [40] [41] Esta tecnología patentada permite un análisis celular de alta precisión y proporciona información adicional como la capacitancia y viabilidad de la membrana . El tamaño relativamente pequeño y la robustez permiten el uso in situ con alimentación por batería.
Parámetros mensurables
Los factores mensurables en el análisis celular y la citometría de flujo incluyen un conjunto diverso de características e indicadores que brindan información importante sobre la biología y la función celular. Las técnicas de citometría de flujo pueden cuantificar y evaluar estos factores, lo que permite a los investigadores investigar y analizar varios aspectos de las células. A continuación, se presentan algunos parámetros cuantificables importantes que se investigan con frecuencia:
- Apoptosis: La apoptosis se puede cuantificar mediante citometría de flujo midiendo la destrucción del ADN, el potencial de membrana mitocondrial, las alteraciones de la permeabilidad y la actividad de la caspasa. Estas mediciones revelan detalles importantes sobre la muerte celular planificada.
- Adherencia celular: la citometría de flujo se puede utilizar para investigar la adherencia celular, como la adherencia entre patógenos y células hospedadoras. Los investigadores pueden cuantificar y analizar los eventos de adhesión celular utilizando marcadores específicos o etiquetas fluorescentes.
- Pigmentos celulares: La clorofila y la ficoeritrina son pigmentos que se encuentran en ciertas células. La presencia y cantidad de estos pigmentos se puede medir mediante citometría de flujo, lo que proporciona información sobre el metabolismo celular y los estados fisiológicos.
- Antígenos de superficie celular: La citometría de flujo se utiliza a menudo para identificar y cuantificar los antígenos de superficie celular, también conocidos como marcadores de grupo de diferenciación (CD). Los investigadores pueden clasificar las poblaciones celulares en función de la expresión de antígenos de superficie marcando las células con anticuerpos específicos.
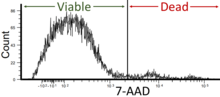
- Viabilidad celular: La citometría de flujo se puede utilizar como un ensayo de viabilidad celular mediante el uso de colorantes o marcadores fluorescentes que distinguen entre células vivas y muertas. Este parámetro es fundamental para determinar la salud celular y la respuesta a entornos experimentales o terapéuticos. La viabilidad de las células en la citometría de flujo debe ser de alrededor del 95% pero no menos del 90%. [42]
- Células tumorales circulantes: la citometría de flujo es esencial para aislar y purificar células tumorales circulantes (CTC) de muestras de sangre. Las CTC se pueden descubrir y examinar mediante la identificación de determinados marcadores o características, lo que ayuda en el diagnóstico, el pronóstico y el seguimiento del tratamiento del cáncer.
- Caracterización de la resistencia a múltiples fármacos (MDR): la citometría de flujo se puede utilizar para caracterizar la resistencia a múltiples fármacos (MDR) en células cancerosas mediante la evaluación del eflujo de colorantes fluorescentes o marcadores particulares asociados con los mecanismos de resistencia a fármacos. Este conocimiento ayuda a comprender y combatir la resistencia a los medicamentos en el tratamiento del cáncer.
- Análisis y clasificación de cromosomas: la citometría de flujo puede ayudar con el análisis y la clasificación de cromosomas, permitiendo la creación de bibliotecas y la identificación de cromosomas específicos o anomalías cromosómicas.
- Variación del número de copias de ADN: la variación del número de copias de ADN se puede medir mediante técnicas de citometría de flujo, como la tecnología Flow-FISH o BACs-on-Beads. Estas tecnologías arrojan luz sobre los cambios genéticos relacionados con enfermedades como el cáncer.
- Expresión y modificaciones de proteínas: Mediante el uso de anticuerpos o sondas marcados con fluorescencia, la citometría de flujo permite evaluar los niveles de expresión de proteínas y alteraciones como la fosforilación. Este parámetro contribuye a una mejor comprensión de la función de las proteínas y de las redes de señalización.
- Fluidez de la membrana: la citometría de flujo puede detectar la fluidez de la membrana mediante el uso de sondas fluorescentes sensibles a las características de la membrana. Este parámetro proporciona información sobre la dinámica y la función de las membranas celulares.
- Contenido total de ADN y ARN: la citometría de flujo puede medir el contenido total de ADN y ARN en las células. Estos datos son útiles para los análisis del ciclo celular, las investigaciones de proliferación y la determinación de cambios en la expresión génica.
- Monitoreo de parámetros intracelulares: Los factores intracelulares pueden medirse mediante citometría de flujo, incluyendo el pH, los niveles intracelulares de calcio y magnesio ionizados, el potencial de membrana, los niveles de glutatión y el estallido oxidativo. Estos datos brindan información sobre el metabolismo celular, la señalización y el estrés oxidativo.
- Dispersión de luz: las medidas de dispersión frontal (FSC) y dispersión lateral (SSC) se utilizan en la citometría de flujo para evaluar el volumen celular y la complejidad morfológica, respectivamente. Estas métricas describen el tamaño, la granularidad y la forma de las células.
- Productos transgénicos: La citometría de flujo es útil para evaluar productos transgénicos in vivo, en particular proteínas fluorescentes como la proteína verde fluorescente (GFP) o variaciones similares. Esto permite a los científicos investigar la expresión genética, la localización de proteínas y la dinámica celular.
- Varias combinaciones: La citometría de flujo permite integrar muchos datos mensurables, como antígenos de superficie/ADN, para adquirir una comprensión integral de las características y funciones biológicas. [43]
Aplicaciones
La tecnología tiene aplicaciones en varios campos, incluyendo biología molecular , patología , inmunología , virología, [44] biología vegetal y biología marina . [45] Tiene una amplia aplicación en medicina , especialmente en trasplantes, hematología, inmunología tumoral y quimioterapia, diagnóstico prenatal, genética y clasificación de espermatozoides para preselección de sexo . La citometría de flujo se aplica ampliamente para detectar anomalías en los espermatozoides asociadas con la fragmentación del ADN [46] en ensayos de fertilidad masculina . [47] Además, se utiliza ampliamente en la investigación para la detección de daños en el ADN , [48] [49] escisión de caspasa y apoptosis . [50] La citometría de flujo fotoacústica se utiliza en el estudio de bacterias resistentes a múltiples fármacos (más comúnmente MRSA) para detectar, diferenciar y cuantificar bacterias en la sangre marcadas con bacteriófagos teñidos. [51] En neurociencia , también se puede analizar la coexpresión de la superficie celular y los antígenos intracelulares. [52] En microbiología, se puede utilizar para examinar y clasificar bibliotecas de mutantes de transposones construidas con un transposón que codifica GFP (TnMHA), [53] o para evaluar la viabilidad. [54] En ingeniería de proteínas, la citometría de flujo se utiliza junto con la visualización de levaduras y la visualización bacteriana para identificar variantes de proteínas mostradas en la superficie celular con propiedades deseadas. Las principales ventajas de la citometría de flujo sobre la histología y la IHC son la posibilidad de medir con precisión las cantidades de antígenos y la posibilidad de teñir cada célula con múltiples anticuerpos-fluoróforos; en los laboratorios actuales, alrededor de 10 anticuerpos pueden unirse a cada célula. Esto es mucho menos que el citómetro de masas, donde actualmente se pueden medir hasta 40, pero a un precio más alto y a un ritmo más lento.
Investigación acuática
En los sistemas acuáticos, la citometría de flujo se utiliza para el análisis de células autofluorescentes o células que están marcadas con fluorescencia con tinciones añadidas. Esta investigación comenzó en 1981 cuando Clarice Yentsch utilizó la citometría de flujo para medir la fluorescencia en una marea roja que producía dinoflagelados. [55] El año siguiente, los investigadores publicaron mediciones citométricas de flujo de múltiples especies de algas que podían distinguirse en función de sus características de fluorescencia. [56] En 1983, los investigadores marinos estaban ensamblando sus propios citómetros de flujo [57] o utilizando citómetros de flujo disponibles comercialmente en muestras de agua de mar recogidas en Bermudas para demostrar que las células de fitoplancton podían distinguirse del material no vivo y que las cianobacterias podían separarse de una comunidad mixta y posteriormente cultivarse en el laboratorio. [58] La citometría de flujo también permitió a los investigadores marinos distinguir entre Prochlorococcus de fluorescencia tenue y microorganismos heterotróficos, una distinción que es difícil con las evaluaciones basadas en microscopía. [59] Los avances en la tecnología ahora permiten a los científicos acuáticos utilizar citómetros de flujo de forma continua durante los cruceros de investigación [60] y los citómetros de flujo se utilizan para proporcionar imágenes de células individuales de fitoplancton. [61] [62] Los científicos marinos utilizan la capacidad de clasificación de los citómetros de flujo para realizar mediciones discretas de la actividad y diversidad celular, [63] [64] para realizar investigaciones sobre las relaciones mutualistas entre microorganismos que viven en estrecha proximidad, [65] y para medir las tasas biogeoquímicas de múltiples procesos en el océano. [66]
Ensayo de proliferación celular
La proliferación celular es la función principal del sistema inmunológico. A menudo es necesario analizar la naturaleza proliferativa de las células para sacar algunas conclusiones. Uno de estos ensayos para determinar la proliferación celular es el colorante de seguimiento carboxifluoresceína diacetato succinimidil éster (CFSE). Ayuda a controlar las células proliferativas. Este ensayo proporciona datos cuantitativos y cualitativos durante los experimentos de series temporales. [67] Este colorante se une covalentemente con las moléculas de larga duración presentes en el interior de la célula. Cuando las células se dividen, las moléculas también se dividen y las células hijas poseen la mitad del colorante que la población parental. Esta disminución de la intensidad se puede visualizar mediante citometría de flujo. [68] En la literatura, esta poderosa técnica de citometría de flujo y CFSE se ha utilizado para encontrar la eficiencia de las células T en la eliminación de las células diana en el cáncer, como la leucemia. Para visualizar la muerte de la célula diana, tanto rápida como lenta, los científicos han utilizado el marcado CFSE con tinción de anticuerpos de ciertos tipos de células y microesferas marcadas con fluorescencia. Esto también proporcionó información sobre la proliferación de las células objetivo tras el tratamiento de ciertas citocinas. [69]
Medición del tamaño del genoma
La citometría de flujo se ha utilizado para medir el tamaño del genoma o, más precisamente, la cantidad de ADN en una célula o núcleo . Aunque los genomas se pueden analizar con mayor precisión mediante la secuenciación genómica , esto suele ser difícil debido a una gran fracción de microcromosomas o secuencias repetitivas que pueden pasarse por alto durante la secuenciación (o que se filtran durante el paso de análisis cuando no se pueden asignar a los cromosomas ). Sin embargo, la citometría de flujo tampoco es perfecta. Los tamaños de genoma resultantes pueden diferir según el colorante utilizado. Un análisis de genomas de peces dio como resultado tamaños de genoma significativamente diferentes cuando se utilizó yoduro de propidio (PI) y DAPI , respectivamente. Por ejemplo, se encontró que el genoma de Anguilla japonica contenía 1,09 pg de ADN con PI frente a 1,25 pg con DAPI. De manera similar, se encontró que el genoma de Myxocyprinus asiaticus contenía 2,75 pg de ADN (PI) frente a 3,08 pg (DAPI). Es decir, las diferencias fueron del orden del 12-14%. [70]
Véase también
- Citometría Tisular , técnica que lleva el concepto de citometría de flujo a la sección de tejido, in situ, y ayuda a realizar la cuantificación de marcadores manteniendo el contexto espacial.
- El ensayo de afinidad de anexina A5 , una prueba para células en apoptosis, a menudo utiliza citometría de flujo.
- Análisis del ciclo celular
- Contador Coulter
- Citometría
- Dielectroforesis
- Flujo euro
- Estándar de citometría de flujo
- Citometría de masas
- Microfluorimetría
- Ensayo de viabilidad
Notas
- ^ El acrónimo FACS es una marca registrada y propiedad de BD Biosciences-Immunocytometry Systems, una división de Becton-Dickinson, que obtuvo la licencia de las patentes de Stanford. [31] [33]
Referencias
- ^ Picot J, Guerin CL, Le Van Kim C, Boulanger CM (marzo de 2012). "Citometría de flujo: retrospectiva, fundamentos e instrumentación reciente". Cytotechnology . 64 (2): 109–30. doi :10.1007/s10616-011-9415-0. PMC 3279584 . PMID 22271369.
- ^ "citometría de flujo". TheFreeDictionary.com . Consultado el 18 de septiembre de 2018 .
- ^ Shapiro HM (2003). Citometría de flujo práctica (4.ª ed.). Nueva York: Wiley-Liss. ISBN 978-0-471-41125-3.
- ^ Givan AL (2011). "Citometría de flujo: una introducción". En Hawley T, Hawley R (eds.). Protocolos de citometría de flujo . Métodos en biología molecular. Vol. 699. Humana Press. págs. 1–29. doi :10.1007/978-1-61737-950-5_1. ISBN 978-1-61737-949-9. Número de identificación personal 21116976.
- ^ O'Neill K, Aghaeepour N, Spidlen J, Brinkman R (diciembre de 2013). "Bioinformática de citometría de flujo". PLOS Comput Biol . 9 (12): e1003365. Bibcode :2013PLSCB...9E3365O. doi : 10.1371/journal.pcbi.1003365 . PMC 3867282 . PMID 24363631.
- ^ US 3380584, Mack Fulwyler, "Separador de partículas", publicado el 1 de junio de 1965
- ^ Fulwyler MJ (noviembre de 1965). "Separación electrónica de células biológicas por volumen". Science . 150 (3698): 910–1. Bibcode :1965Sci...150..910F. doi :10.1126/science.150.3698.910. PMID 5891056. S2CID 459342.
- ^ DE 1815352, Dittrich W, Göhde W, "Cámara de flujo continuo para fotómetros para medir y contar partículas en un medio de dispersión", publicado el 21 de diciembre de 1977
- ^ Osborn RA (1970). "Automatización de la citología". En Evans DM (ed.). Actas del segundo simposio sobre tenovus . 24-25 de octubre de 1968. Edimburgo y Londres: E. & S. Livingstone (publicado en 1971). doi :10.1016/S0031-3025(16)39506-X. S2CID 58286041.
Kamentsky LA (1973). "Automatización de la citología". Avances en física biológica y médica . 14 : 93-161. doi :10.1016/B978-0-12-005214-1.50007-8. ISBN . 9780120052141. Número de identificación personal 4579761. - ^ Saco U, Tárnok A, Rothe G (2006). Zelluläre Diagnostik [ Diagnóstico celular ] (en alemán). Editores Karger. ISBN 978-3-318-01217-0.
- ^ "Recursos y equipamiento". Instituto Centenario .
- ^ "BD Biosciences – Productos de pedido especial".
- ^ abcdefghi Cossarizza A, Chang HD, Radbruch A, Akdis M, Andrä I, Annunziato F, et al. (octubre de 2017). "Directrices para el uso de la citometría de flujo y la clasificación celular en estudios inmunológicos". Revista Europea de Inmunología . 47 (10): 1584–1797. doi : 10.1002/eji.201646632 . PMC 9165548 . PMID 29023707. S2CID 25591889.
- ^ ab "Sistema de fluidos: guía de citometría de flujo". Bio-Rad . Consultado el 18 de septiembre de 2018 .
- ^ abcd "Cómo funciona un citómetro de flujo". Thermo Fisher Scientific . Consultado el 18 de septiembre de 2018 .
- ^ Nolan JP, Condello D (enero de 2013). "Citometría de flujo espectral". Protocolos actuales en citometría . Capítulo 1 (1): 1.27.1–1.27.13. doi :10.1002/0471142956.cy0127s63. ISBN 978-0471142959. PMC 3556726 . PMID 23292705.
- ^ Han Y, Gu Y, Zhang AC, Lo YH (noviembre de 2016). "Revisión: tecnologías de imágenes para citometría de flujo". Lab on a Chip . 16 (24): 4639–4647. doi :10.1039/c6lc01063f. PMC 5311077 . PMID 27830849.
- ^ ab Roederer M (noviembre de 2001). "Compensación espectral para citometría de flujo: artefactos de visualización, limitaciones y advertencias". Cytometry . 45 (3): 194–205. doi : 10.1002/1097-0320(20011101)45:3<194::aid-cyto1163>3.0.co;2-c . PMID 11746088.
- ^ Sharpless T, Traganos F, Darzynkiewicz Z, Melamed MR (1975). "Citofluorimetría de flujo: discriminación entre células individuales y agregados celulares mediante mediciones directas del tamaño". Acta Cytologica . 19 (6): 577–81. PMID 1108568.
- ^ ab "Tabla de fluorocromos (herramientas)". Red de citometría de flujo .
- ^ "Tabla de Fluorocromos". Archivado desde el original el 20 de octubre de 2014.
- ^ Qian Y, Wei C, Eun-Hyung Lee F, Campbell J, Halliley J, Lee JA, et al. (2010). "Elucidación de diecisiete subconjuntos de células B de sangre periférica humana y cuantificación de la respuesta al tétanos utilizando un método basado en la densidad para la identificación automatizada de poblaciones celulares en datos de citometría de flujo multidimensional". Cytometry Part B . 78 (Suppl 1): S69-82. doi :10.1002/cyto.b.20554. PMC 3084630 . PMID 20839340.
- ^ "Portal de análisis y bases de datos de inmunología". Archivado desde el original el 26 de julio de 2011. Consultado el 3 de septiembre de 2009 .
- ^ Zare H, Shooshtari P, Gupta A, Brinkman RR (julio de 2010). "Reducción de datos para agrupamiento espectral para analizar datos de citometría de flujo de alto rendimiento". BMC Bioinformatics . 11 : 403. doi : 10.1186/1471-2105-11-403 . PMC 2923634 . PMID 20667133.
- ^ "flowClust" . Consultado el 3 de septiembre de 2009 .
- ^ Lo K, Brinkman RR, Gottardo R (abril de 2008). "Control automático de los datos de citometría de flujo mediante agrupamiento robusto basado en modelos". Cytometry Part A . 73 (4): 321–32. doi : 10.1002/cyto.a.20531 . PMID 18307272.
- ^ Lo K, Hahne F, Brinkman RR, Gottardo R (mayo de 2009). "flowClust: un paquete Bioconductor para la selección automatizada de datos de citometría de flujo". BMC Bioinformatics . 10 : 145. doi : 10.1186/1471-2105-10-145 . PMC 2701419 . PMID 19442304.
- ^ "Análisis de flujo con estimación multivariante automatizada (FLAME)". Archivado desde el original el 21 de agosto de 2009. Consultado el 3 de septiembre de 2009 .
- ^ Wattenberg M, Viégas F, Johnson I (13 de octubre de 2016). "Cómo utilizar t-SNE de forma eficaz". Distill . 1 (10). doi : 10.23915/distill.00002 .
- ^ "FlowCAP – Citometría de flujo: evaluación crítica de los métodos de identificación de poblaciones" . Consultado el 3 de septiembre de 2009 .
- ^ ab Perkel J (19 de julio de 2004). "Clasificador de células activado por fluorescencia". The Scientist . Consultado el 18 de septiembre de 2018 .
- ^ "Unidad de registro 9554, La historia de las entrevistas de clasificadores de células". Archivos del Instituto Smithsoniano . Fulwyler, Mack Jett. entrevistado, Herzenberg, Leonard A. entrevistado, Bach, Bruce Allen. entrevistado, Krasnow, Mark A. entrevistado, Mhatre, Nagesh S. entrevistado. 1991. Consultado el 18 de septiembre de 2018 .
{{cite web}}: Mantenimiento de CS1: otros ( enlace ) - ^ Bushnell T (4 de mayo de 2016). "12 términos y definiciones de citometría de flujo que la mayoría de los científicos entienden mal". Expert Cytometry . Consultado el 18 de septiembre de 2018 .
- ^ Julius MH, Masuda T, Herzenberg LA (julio de 1972). "Demostración de que las células que se unen a antígenos son precursoras de células productoras de anticuerpos después de la purificación con un clasificador de células activado por fluorescencia". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 69 (7): 1934–8. Bibcode :1972PNAS...69.1934J. doi : 10.1073/pnas.69.7.1934 . PMC 426835 . PMID 4114858.
- ^ "Clasificación celular: instalación de citometría de flujo de la Facultad de Medicina". flowcytometry.utoronto.ca . Consultado el 18 de septiembre de 2018 .
- ^ "Conjugación de anticuerpos monoclonales". www.drmr.com . Consultado el 18 de septiembre de 2018 .
- ^ Loken MR (1990). Técnicas de inmunofluorescencia en citometría de flujo y clasificación (2.ª ed.). Wiley. págs. 341–53.
- ^ Basiji DA, Ortyn WE, Liang L, Venkatachalam V, Morrissey P (septiembre de 2007). "Análisis de imágenes celulares y obtención de imágenes mediante citometría de flujo". Clinics in Laboratory Medicine . 27 (3): 653–70, viii. doi :10.1016/j.cll.2007.05.008. PMC 2034394 . PMID 17658411.
- ^ ab Ornatsky O, Bandura D, Baranov V, Nitz M, Winnik MA, Tanner S (septiembre de 2010). "Análisis altamente multiparamétrico por citometría de masas". Journal of Immunological Methods . 361 (1–2): 1–20. doi :10.1016/j.jim.2010.07.002. PMID 20655312.
- ^ Sun T, Morgan H (abril de 2010). "Citometría de impedancia microfluídica de células individuales: una revisión". Microfluídica y nanofluídica . 8 (4): 423–443. doi :10.1007/s10404-010-0580-9. S2CID 95631023.
- ^ Cheung KC, Di Berardino M, Schade-Kampmann G, Hebeisen M, Pierzchalski A, Bocsi J, et al. (julio de 2010). "Citometría de flujo basada en impedancia microfluídica". Cytometry Part A . 77 (7): 648–66. doi : 10.1002/cyto.a.20910 . PMID 20583276.
- ^ "Protocolo de tinción de citometría de flujo (FACS) (tinción de la superficie celular)". Facultad de Medicina de Yale – Citometría de flujo de Yale . Consultado el 17 de octubre de 2023 .
- ^ "Citometría de flujo: tipos, finalidad, reactivos, ejemplos, aplicación". microbiologynote.com . 2022-10-18 . Consultado el 2023-06-27 .
- ^ Zamora JL, Aguilar HC (febrero de 2018). "Virometría de flujo como herramienta para el estudio de virus". Métodos . 134–135: 87–97. doi :10.1016/j.ymeth.2017.12.011. PMC 5815898 . PMID 29258922.
- ^ Murphy RW, Lowcock LA, Smith C, Darevsky IS, Orlov N, MacCulloch RD, Upton DE (1997). "Citometría de flujo en estudios de biodiversidad: métodos, utilidad y limitaciones". Amphibia-Reptilia . 18 : 1–13. doi :10.1163/156853897x00260.
- ^ Gorczyca W, Traganos F, Jesionowska H, Darzynkiewicz Z (julio de 1993). "Presencia de roturas de cadenas de ADN y aumento de la sensibilidad del ADN in situ a la desnaturalización en células espermáticas humanas anormales: analogía con la apoptosis de células somáticas". Experimental Cell Research . 207 (1): 202–5. doi :10.1006/excr.1993.1182. PMID 8391465.
- ^ Evenson DP (septiembre de 2017). "La evaluación de la estructura de la cromatina de los espermatozoides y las roturas de las cadenas de ADN es una parte importante de la evaluación clínica de la fertilidad masculina". Andrología y Urología Traslacional . 6 (Supl 4): S495–S500. doi : 10.21037/tau.2017.07.20 . PMC 5643675 . PMID 29082168.
- ^ Tanaka T, Halicka HD, Huang X, Traganos F, Darzynkiewicz Z (septiembre de 2006). "Fosforilación constitutiva de la histona H2AX y activación de ATM, los indicadores del daño del ADN por oxidantes endógenos". Cell Cycle . 5 (17): 1940–5. doi :10.4161/cc.5.17.3191. PMC 3488278 . PMID 16940754.
- ^ MacPhail SH, Banáth JP, Yu Y, Chu E, Olive PL (junio de 2003). "Expresión dependiente del ciclo celular de la histona H2AX fosforilada: expresión reducida en células de fase G1 no irradiadas pero no irradiadas con rayos X". Radiation Research . 159 (6): 759–67. Bibcode :2003RadR..159..759M. doi :10.1667/rr3003. PMID 12751958. S2CID 26093456.
- ^ Darzynkiewicz Z, Juan G, Li X, Gorczyca W, Murakami T, Traganos F (enero de 1997). "Citometría en necrobiología celular: análisis de la apoptosis y muerte celular accidental (necrosis)". Citometría . 27 (1): 1–20. doi : 10.1002/(SICI)1097-0320(19970101)27:1<1::AID-CYTO2>3.0.CO;2-L . PMID 9000580.
- ^ Edgar RH, Noel C, Minard A, Fernandez R, Fitzpatrick M, Sajewski A, et al. (2019-02-27). "Identificación de infección por SAMR en sangre mediante citometría de flujo fotoacústica". En Wang L, Oraevsky AA (eds.). Photons Plus Ultrasound: Imaging and Sensing 2019 . Vol. 10878. Sociedad Internacional de Óptica y Fotónica. p. 1087860. Código Bibliográfico :2019SPIE10878E..60E. doi :10.1117/12.2510210. ISBN 9781510623989.S2CID86428267 .
- ^ Menon V, Thomas R, Ghale AR, Reinhard C, Pruszak J (diciembre de 2014). "Protocolos de citometría de flujo para análisis de antígenos de superficie e intracelulares de tipos de células neuronales". Journal of Visualized Experiments (94): e52241. doi :10.3791/52241. PMC 4396953. PMID 25549236 .
- ^ Antypas H, Veses-Garcia M, Weibull E, Andersson-Svahn H, Richter-Dahlfors A (junio de 2018). "Una plataforma universal para la selección y el cribado fenotípico de alta resolución de mutantes bacterianos utilizando el portaobjetos nanowell". Lab on a Chip . 18 (12): 1767–1777. doi :10.1039/c8lc00190a. PMC 5996734 . PMID 29781496.
- ^ Davey HM (agosto de 2011). "Vida, muerte y lo intermedio: significados y métodos en microbiología". Microbiología aplicada y ambiental . 77 (16): 5571–6. Bibcode :2011ApEnM..77.5571D. doi :10.1128/AEM.00744-11. PMC 3165249 . PMID 21705550.
- ^ Yentsch CM (1981). "Análisis citométrico de flujo de la saxitoxina celular en el dinoflagelado Gonyaulax tamarensis var. excavata". Toxicon . 19 (5): 611–21. doi :10.1016/0041-0101(81)90099-4. PMID 7197816.
- ^ Trask, BJ; Engh, GJ van den; Elgershuizen, JHBW (1982). "Análisis del fitoplancton mediante citometría de flujo". Citometría . 2 (4): 258–264. doi : 10.1002/cyto.990020410 . ISSN 1097-0320. PMID 6799265.
- ^ Olson, Robert J.; Frankel, Sheila L.; Chisholm, Sallie W.; Shapiro, Howard M. (8 de abril de 1983). "Un citómetro de flujo económico para el análisis de señales de fluorescencia en fitoplancton: distribuciones de clorofila y ADN". Revista de biología y ecología marina experimental . 68 (2): 129–144. doi :10.1016/0022-0981(83)90155-7. ISSN 0022-0981.
- ^ Yentsch CM, Horan PK, Muirhead K, Dortch Q, Haugen E, Legendre L, et al. (1983). "Citometría de flujo y clasificación celular: una técnica para el análisis y clasificación de partículas acuáticas1". Limnología y Oceanografía . 28 (6): 1275–1280. Bibcode :1983LimOc..28.1275Y. doi : 10.4319/lo.1983.28.6.1275 . ISSN 1939-5590.
- ^ Chisholm SW, Olson RJ, Zettler ER, Goericke R, Waterbury JB, Welschmeyer NA (julio de 1988). "Una nueva proclorofita de vida libre abundante en la zona eufótica oceánica". Nature . 334 (6180): 340–343. Bibcode :1988Natur.334..340C. doi :10.1038/334340a0. S2CID 4373102.
- ^ Swalwell JE, Ribalet F, Armbrust EV (2011). "SeaFlow: Un nuevo citómetro de flujo en marcha para observaciones continuas de fitoplancton en el océano". Limnología y Oceanografía: Métodos . 9 (10): 466–477. Bibcode :2011LimOM...9..466S. doi : 10.4319/lom.2011.9.466 . ISSN 1541-5856.
- ^ Olson RJ, Sosik HM (2007). "Un instrumento sumergible de obtención de imágenes en flujo para analizar nano y microplancton: Imaging FlowCytobot". Limnología y Oceanografía: Métodos . 5 (6): 195–203. Bibcode :2007LimOM...5..195O. doi : 10.4319/lom.2007.5.195 .
- ^ Jakobsen HH, Carstensen J (2011). "FlowCAM: Dimensionamiento de células y comprensión del impacto de las distribuciones de tamaño en el biovolumen de la estructura de la comunidad planctónica". Ecología microbiana acuática . 65 (1): 75–87. doi : 10.3354/ame01539 . ISSN 0948-3055.
- ^ Longnecker K, Sherr BF, Sherr EB (diciembre de 2005). "Actividad y diversidad filogenética de células bacterianas con alto y bajo contenido de ácidos nucleicos y actividad del sistema de transporte de electrones en un ecosistema de surgencia". Applied and Environmental Microbiology . 71 (12): 7737–49. Bibcode :2005ApEnM..71.7737L. doi :10.1128/AEM.71.12.7737-7749.2005. PMC 1317353 . PMID 16332746.
- ^ Stepanauskas R, Sieracki ME (mayo de 2007). "Coincidencia de filogenia y metabolismo en bacterias marinas no cultivadas, una célula a la vez". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 104 (21): 9052–7. Bibcode :2007PNAS..104.9052S. doi : 10.1073/pnas.0700496104 . PMC 1885626 . PMID 17502618.
- ^ Thompson AW, Foster RA, Krupke A, Carter BJ, Musat N, Vaulot D, et al. (septiembre de 2012). "Cianobacteria unicelular simbiótica con un alga eucariota unicelular". Science . 337 (6101): 1546–50. Bibcode :2012Sci...337.1546T. doi :10.1126/science.1222700. PMID 22997339. S2CID 7071725.
- ^ Lomas, Michael W.; Bronk, Deborah A.; van den Engh, Ger (15 de enero de 2011). "Uso de la citometría de flujo para medir las tasas y los procesos biogeoquímicos en el océano". Revista anual de ciencias marinas . 3 (1): 537–566. Bibcode :2011ARMS....3..537L. doi :10.1146/annurev-marine-120709-142834. ISSN 1941-1405. PMID 21329216.
- ^ Hawkins ED, Hommel M, Turner ML, Battye FL, Markham JF, Hodgkin PD (2007). "Medición de la proliferación, supervivencia y diferenciación de linfocitos mediante datos de series temporales de CFSE". Nature Protocols . 2 (9): 2057–67. doi :10.1038/nprot.2007.297. PMID 17853861. S2CID 13550456.
- ^ Quah BJ, Parish CR (octubre de 2010). "El uso de éster succinimidílico de diacetato de carboxifluoresceína (CFSE) para controlar la proliferación de linfocitos". Journal of Visualized Experiments (44). doi :10.3791/2259. PMC 3185625. PMID 20972413 .
- ^ Jedema I, van der Werff NM, Barge RM, Willemze R, Falkenburg JH (abril de 2004). "Nuevo ensayo basado en CFSE para determinar la susceptibilidad a la lisis por parte de células T citotóxicas de células precursoras leucémicas dentro de una población heterogénea de células diana". Blood . 103 (7): 2677–82. doi : 10.1182/blood-2003-06-2070 . PMID 14630824. S2CID 1984056.
- ^ Zhu, Dongmei; Song, Wen; Yang, Kun; Cao, Xiaojuan; Gul, Yasmeen; Wang, Weiming (2012). "Determinación del tamaño del genoma de ocho especies de peces de importancia comercial en China mediante citometría de flujo". Biología celular y del desarrollo in vitro. Animal . 48 (8): 507–517. doi :10.1007/s11626-012-9543-7. ISSN 1071-2690. JSTOR 23279365. PMID 22956044. S2CID 255351169.
Lectura adicional
- Carey JL, McCoy Jr JP, Keren DF (2007). Citometría de flujo en el diagnóstico clínico (4.ª ed.). Chicago, IL: American Society for Clinical Pathology (ASCP) Press. ISBN 978-0-89189-548-0.
- Darzynkiewicz Z, Roederer M, Tanke HJ, eds. (2004). Métodos en biología celular, citometría . Vol. 75 (4.ª ed.). Elsevier/Academic Press. ISBN 0-12-480283-4.
- Darzynkiewicz Z, Robinson JP, Roederer M (2009). Métodos esenciales de citometría (1.ª ed.). Ámsterdam: Elsevier/Academic Press. ISBN 978-0-12-375045-7.
- Darzynkiewicz Z, et al., eds. (2011). Avances recientes en citometría. Parte A. Métodos en biología celular. Vol. 102. Elsevier/Academic Press. ISBN 978-0-12-374912-3.
- Darzynkiewicz Z, et al., eds. (2011). Avances recientes en citometría. Parte B. Métodos en biología celular. Vol. 103. Elsevier/Academic Press. ISBN 978-0-12-385493-3.
- Lloyd D (1993). Citometría de flujo en microbiología . Londres: Springer-Verlag. ISBN. 978-3-540-19796-6.
- Ormerod MG (1999). Citometría de flujo (2.ª ed.). Oxford, Reino Unido: Bios Scientific Publishers. ISBN 978-1-85996-107-0.
- Ormerod MG, ed. (2000). Citometría de flujo: un enfoque práctico (3.ª ed.). Oxford [Inglaterra]: Oxford University Press. ISBN 978-0-19-963824-6.
- Ormerod MG (2008). Citometría de flujo: una introducción básica. Colina Roja: MG Ormerod. ISBN 978-0-9559812-0-3.
- Robinson JP, et al. (1993). Manual de métodos de citometría de flujo . Nueva York: Wiley-Liss. ISBN 978-0-471-59634-9.
- Shapiro HM (2003). Citometría de flujo práctica (4.ª ed.). Nueva York: Wiley-Liss. ISBN 978-0-471-41125-3.
- Sklar LA (2005). Citometría de flujo para biotecnología . Nueva York: Oxford University Press. ISBN 978-0-19-515234-0.
Enlaces externos
 Medios relacionados con Citometría de flujo en Wikimedia Commons
Medios relacionados con Citometría de flujo en Wikimedia Commons- Citometría de flujo en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.

