Química del organoarsénico
La química del organoarsénico es la química de los compuestos que contienen un enlace químico entre el arsénico y el carbono . Algunos compuestos organoarsénicos, también llamados "organoarsenicales", se producen industrialmente con usos como insecticidas , herbicidas y fungicidas . En general, estas aplicaciones están disminuyendo al ritmo de las crecientes preocupaciones sobre su impacto en el medio ambiente y la salud humana. Los compuestos originales son el arsénico y el ácido arsénico . A pesar de su toxicidad, las biomoléculas de organoarsénico son bien conocidas.
Historia

Sorprendentemente para un área que ahora se considera de menor importancia, la química del organoarsénico jugó un papel destacado en la historia de la química. El compuesto organoarsénico más antiguo conocido, el maloliente cacodilo, fue descrito en "cacodyl" (1760) y a veces se clasifica como el primer compuesto organometálico sintético . El compuesto Salvarsan fue uno de los primeros productos farmacéuticos, lo que le valió un premio Nobel a Paul Ehrlich . Varios otros compuestos organoarsénicos se utilizaron anteriormente como antibióticos (Solarson) u otros usos médicos. [2]
Síntesis y clasificación
El arsénico se presenta típicamente en los estados de oxidación (III) y (V), ilustrados por los haluros AsX 3 (X = F, Cl, Br, I) y AsF 5 . En consecuencia, los compuestos organoarsénicos se encuentran comúnmente en estos dos estados de oxidación. [3]
Los compuestos de hidroxiarsénico son conocidos: [3]
- ácidos arsenosos (RAs(OH) 2 ), raros ( el ácido arsenioso (As(OH) 3 ) es bien conocido)
- ácidos arsínicos (R 2 AsOH), raros
- ácidos arsínicos (R 2 As(O)OH), comunes, ilustrados por el ácido cacodílico (R = CH 3 )
- ácidos arsónicos (RAs(O)(OH) 2 ), comunes, ilustrados por el ácido fenilarsónico (R = C 6 H 5 )
Compuestos organoarsénicos (V) y sus usos
Los compuestos de arsénico(V) suelen presentar los grupos funcionales RAsO(OH) 2 o R2AsO (OH) (R = alquilo o arilo). El ácido cacodílico, fundamental para la química del arsénico, surge de la metilación del óxido de arsénico(III). (En cambio, el ácido dimetilfosfónico es menos significativo en la química correspondiente del fósforo). Se puede acceder a los ácidos fenilarsónicos mediante la reacción del ácido arsénico con anilinas , la llamada reacción de Bechamp .
El ácido monometilado, ácido metanearsónico ( CH3AsO (OH) 2 ), es un precursor de los fungicidas (nombre comercial Neoasozin) en el cultivo de arroz y algodón. Los derivados del ácido fenilarsónico (C6H5AsO ( OH ) 2 ) se utilizan como aditivos alimentarios para el ganado, incluidos el ácido 4-hidroxi-3-nitrobencenoarsónico (3-NHPAA o Roxarsone), el ácido ureidofenilarsónico y el ácido p -arsanílico . Estas aplicaciones son controvertidas ya que introducen formas solubles de arsénico en el medio ambiente.
Los compuestos de arsénico (V) que contienen sólo ligandos orgánicos son raros, siendo el miembro preeminente el derivado de pentafenilo As(C 6 H 5 ) 5 . [4]
Compuestos de organoarsénico (III) y usos
Muchos compuestos de organoarsénico se preparan mediante alquilación de AsCl 3 y sus derivados utilizando organolitio y reactivos de Grignard . [4] Por ejemplo, se conocen las series trimetilarsina ((CH 3 ) 3 As), cloruro de dimetilarsénico ((CH 3 ) 2 AsCl) y dicloruro de metilarsénico (CH 3 AsCl 2 ). La reducción de los derivados de cloruro con reactivos reductores de hidruro proporciona los hidruros correspondientes, como dimetilarsina ((CH 3 ) 2 AsH) y metilarsina (CH 3 AsH 2 ). Se aplican manipulaciones similares a otros compuestos de cloruro de organoarsénico.
De manera similar al proceso directo en la química del organosilicio , los haluros de metilo reaccionan con As elemental, como se ilustra en la siguiente ecuación idealizada: [5]
- 3 CH 3 Br + 2 As → (CH 3 ) 2 AsBr + CH 3 AsBr 2
Estas reacciones requieren catalizadores de cobre y se llevan a cabo cerca de 360 °C.
Otra ruta para obtener compuestos de dimetilarsénico comienza con la reducción del compuesto As V, ácido cacodílico :
- (CH3 ) 2AsO2H + 2Zn +4HCl → ( CH3 ) 2AsH + 2ZnCl2 + 2H2O
- (CH 3 ) 2 AsO 2 H + SO 2 + HI → (CH 3 ) 2 AsI + SO 3 + H 2 O
Se conocen diversos heterociclos que contienen arsénico (III), entre ellos el arsol , el análogo arsénico del pirrol , y el arsabenceno , el análogo arsénico de la piridina .
Los compuestos organoarsénicos(III) simétricos, por ejemplo, la trimetilarsina y la trifenilarsina , se utilizan habitualmente como ligandos en la química de coordinación . Se comportan como ligandos de fosfina, pero son menos básicos. La diarsina C6H4 ( As(CH3 ) 2 ) 2 , conocida como diars , es un ligando quelante . La torina es un indicador de varios metales.
Compuestos organoarsénicos de orden inferior y usos
Según la regla del doble enlace , los compuestos con enlaces As=As, As=C y As≡C son poco frecuentes. Se observan en fase gaseosa, pero se requiere una protección estérica considerable para inhibir su conversión a oligómeros en forma de líquidos o sólidos.
Los oligómeros con enlaces As-As incluyen los fármacos antisifílicos Salvarsan y Neosalvarsan . [ cita requerida ] Por lo general, son tricoordinados en As y tienen un estado de oxidación formal As I . Los sustituyentes pequeños, como en (MeAs) n , se equilibran entre anillos de tres, cuatro y cinco miembros, pero los sustituyentes más voluminosos generalmente se asientan en una configuración de cuatro miembros. La síntesis se realiza típicamente por deshalogenación reductora con un metal. [6] : 563–565
Reacciones
Las arsinas próticas se oxidan a oligómeros. [6] : 318 Por ejemplo, la metilarsina se oxida primero a ciclo -metilarsina (I):
- MeAsH 2 + O → H 2 O + (MeAs) n
Estos compuestos tienen estructuras similares a los sulfuros de fósforo .
Los enlaces arsénico-arsénico son muy débiles y los compuestos oligoméricos de arsénico son incluso más propensos a oxidarse que sus precursores hidrogenados. [6] : 318–320 Sin embargo, la siguiente reacción se puede preparar mediante reducción electroquímica en una celda de sulfato de zinc. [6] : 473 La oxidación primero forma arsénicos poliméricos, por ejemplo:
- MeAs + O → MeAsO
Una oxidación posterior los despolimeriza y los convierte en ácidos arsínicos. [6] : 318
Los compuestos de arsina (III) se suman a los enlaces múltiples como nucleófilos , pero los anillos de arsina (I) pueden, en cambio, insertar el enlace en el anillo. [6] : 319, 573, 843 En general, las arsinas son menos básicas de Brønsted que las fosfinas (pero más que las estibinas ). [6] : 322–326
Los iluros de arsina son generalmente menos estables que los iluros de fosfina , y se descomponen espontáneamente en ausencia de un carbonilo vecinal. Los iluros estabilizados se olefinan a una mezcla de estereoisómeros, mientras que los iluros no estabilizados tienden a epoxidarse (como un reactivo de Corey-Chaykovsky ). Con las enonas , se olefinan o se ciclopropanan. Con los compuestos nitrosos , forman iminas o nitronas . [6] : 662–672
Guerra química
Los compuestos organoarsénicos, especialmente los que presentan enlaces As-Cl, se han utilizado como armas químicas , especialmente durante la Primera Guerra Mundial . Entre los ejemplos más conocidos se encuentran la " Lewisita " (dicloruro de clorovinil-2-arsénico) y el "Clark I" ( clorodifenilarsina ). La fenildicloroarsina es otro ejemplo.
En la naturaleza
Como el arsénico es tóxico para la mayoría de las formas de vida y se presenta en concentraciones elevadas en algunas áreas, se han desarrollado varias estrategias de desintoxicación. El arsénico inorgánico y sus compuestos, al ingresar a la cadena alimentaria , se metabolizan progresivamente a una forma menos tóxica de arsénico a través de un proceso de metilación . [7] Los compuestos organoarsénicos surgen a través de la biometilación de compuestos de arsénico inorgánico, [8] a través de procesos mediados por enzimas relacionadas con la vitamina B 12 . [9] Por ejemplo, el moho Scopulariopsis brevicaulis produce cantidades significativas de trimetilarsina si está presente arsénico inorgánico. [10] La biometilación de compuestos de arsénico comienza con la formación de metanoarsonatos . Por lo tanto, los compuestos de arsénico inorgánico trivalentes se metilan para dar metanoarsonato. La S -adenosilmetionina es el donante de metilo. Los metanoarsonatos son los precursores de los dimetilarsonatos, nuevamente por el ciclo de reducción (a ácido metilarsónico) seguido de una segunda metilación. [11] Este compuesto dimetilo es el ácido cacodílico ((CH 3 ) 2 AsO 2 H),
El compuesto orgánico arsenobetaína , una betaína , se encuentra en algunos alimentos marinos como el pescado y las algas, y también en los hongos en concentraciones mayores. La ingesta promedio de una persona es de aproximadamente 10-50 μg/día. No es inusual que se obtengan valores de aproximadamente 1000 μg después del consumo de pescado o hongos. Pero hay poco peligro en comer pescado porque este compuesto de arsénico es casi no tóxico. [12] La arsenobetaína se identificó por primera vez en la langosta occidental [13] [14]
Los sacáridos unidos al arsénico, conocidos colectivamente como arsenoazúcares , se encuentran especialmente en las algas marinas . También se conocen lípidos que contienen arsénico. [15] Aunque el arsénico y sus compuestos son tóxicos para los humanos, uno de los primeros antibióticos sintéticos fue el Salvarsan , cuyo uso se ha interrumpido desde hace mucho tiempo.
El único compuesto de poliarsénico aislado de una fuente natural es la arsenicina A , que se encuentra en la esponja marina de Nueva Caledonia Echinochalina bargibanti . [16]
Los compuestos organoarsénicos pueden suponer riesgos importantes para la salud, dependiendo de su especiación. El ácido arsénico (As(OH) 3 ) tiene una DL50 de 34,5 mg/kg (ratones), mientras que para la betaína (CH 3 ) 3 As + CH 2 CO 2 − la DL50 supera los 10 g/kg. [12]
Compuestos representativos
En la siguiente tabla se enumeran algunos compuestos organoarsénicos ilustrativos:
| Nombre | Sustituyentes | Estructura | Masa molar | Número CAS | Propiedades |
|---|---|---|---|---|---|
| 10,10'-oxibis-10 H -Fenoxarsina | Arilo |  | 502.2318 | 58-36-6 | |
| Trifenilarsina | Fenilo |  | 306.23 | 603-32-7 | Se derrite a 58-61 °C |
| Fenildicloroarsina | Fenilo , cloro | 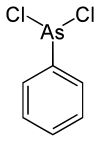 | 222,93 | 696-28-6 | |
| Roxarsona | Fenilo , oxígeno | 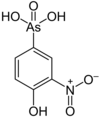 | 263.04 | 121-19-7 | |
| Arsenobetaína | Metilo | 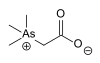 | 64436-13-1 | ||
| Arsénico A | Metilo , oxígeno | ![2,4,6-Trioxa-1,3,5,7-tetraarsatriciclo[3.3.1.13,7]decano](http://upload.wikimedia.org/wikipedia/commons/thumb/4/42/Arsenicin_A.png/100px-Arsenicin_A.png) | 389,76 | 925705-41-5 | Se derrite a 182–184 °C (360–363 °F) |
Véase también
Referencias
- ^ Seyferth, Dietmar (2001). "Líquido arsenical fumante de Cadet y compuestos cacodilo de Bunsen". Organometallics . 20 (8): 1488–1498. doi : 10.1021/om0101947 .
- ^ Singh, R. Drogas sintéticas. Mittal Publications (2002). ISBN 817099831X
- ^ ab Grund, Carolina del Sur; Hanusch, K.; Wolf, HU "Arsénico y compuestos de arsénico". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a03_113.pub2. ISBN 978-3527306732.
- ^ ab Elschenbroich, C. "Organometálicos" (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ Maier, L.; Rochow, EG; Fernelius, WC (1961). "La síntesis directa de compuestos de organoarsénico y organoantimonio". Journal of Inorganic and Nuclear Chemistry . 16 (3–4): 213–218. doi :10.1016/0022-1902(61)80492-2.
- ^ abcdefgh Patai, Saul, ed. (1994). La química de los compuestos orgánicos de arsénico, antimonio y bismuto . Química de los grupos funcionales. Chichester, Reino Unido: Wiley. doi :10.1002/0470023473. ISBN 047193044X.
- ^ Reimer, KJ; Koch, I.; Cullen, WR (2010). "Organoarsenicales. Distribución y transformación en el medio ambiente". Iones metálicos en las ciencias de la vida . 7 . Cambridge: RSC publishing: 165–229. doi :10.1039/9781849730822-00165. ISBN 978-1-84755-177-1. Número de identificación personal 20877808.
- ^ Dopp, E.; Kligerman, AD; Diaz-Bone, RA (2010). "Organoarsenicales. Absorción, metabolismo y toxicidad". Iones metálicos en las ciencias de la vida . 7 . Cambridge: RSC publishing: 231–265. doi :10.1515/9783110436600-012. ISBN 978-1-84755-177-1. Número de identificación personal 20877809.
- ^ Toshikazu Kaise; Mitsuo Ogura; Takao Nozaki; Kazuhisa Saitoh; Teruaki Sakurai; Chiyo Matsubara; Chuichi Watanabe; Ken'ichi Hanaoka (1998). "Biometilación de arsénico en un entorno de agua dulce rico en arsénico". Química Organometálica Aplicada . 11 (4): 297–304. doi : 10.1002/(SICI)1099-0739(199704)11:4<297::AID-AOC584>3.0.CO;2-0 .
- ^ Bentley, Ronald; Chasteen, Thomas G. (2002). "Metilación microbiana de metaloides: arsénico, antimonio y bismuto". Microbiology and Molecular Biology Reviews . 66 (2): 250–271. doi :10.1128/MMBR.66.2.250-271.2002. PMC 120786 . PMID 12040126.
- ^ Styblo, M.; Del Razo, LM; Vega, L.; Germolec, DR; LeCluyse, EL; Hamilton, GA; Reed, W.; Wang, C.; Cullen, WR; Thomas, DJ (2000). "Toxicidad comparativa de arsenicales inorgánicos y metilados trivalentes y pentavalentes en células de rata y humanas". Archivos de toxicología . 74 (6): 289–299. doi :10.1007/s002040000134. PMID 11005674. S2CID 1025140.
- ^ ab Cullen, William R.; Reimer, Kenneth J. (1989). "Especiación del arsénico en el medio ambiente". Chemical Reviews . 89 (4): 713–764. doi :10.1021/cr00094a002. hdl : 10214/2162 .
- ^ Francesconi, Kevin A.; Edmonds, John S. (1998). "Especies de arsénico en muestras marinas" (PDF) . Croatica Chemica Acta . 71 (2): 343–359. Archivado desde el original (PDF) el 2008-03-09.
- ^ John S. Edmonds; Kevin A. Francesconi; Jack R. Cannon; Colin L. Raston ; Brian W. Skelton y Allan H. White (1977). "Aislamiento, estructura cristalina y síntesis de arsenobetaína, el componente arsénico de la langosta occidental Panulirus longipes cygnus George". Tetrahedron Letters . 18 (18): 1543–1546. doi :10.1016/S0040-4039(01)93098-9.
- ^ Alice Rumpler; John S. Edmonds; Mariko Katsu; Kenneth B. Jensen; Walter Goessler; Georg Raber; Helga Gunnlaugsdottir; Kevin A. Francesconi (2008). "Ácidos grasos de cadena larga que contienen arsénico en el aceite de hígado de bacalao: ¿un resultado de la infidelidad biosintética?". Angew. Chem. Int. Ed . 47 (14): 2665–2667. doi :10.1002/anie.200705405. PMID 18306198.
- ^ ab Mancini, Inés; Guella, Graziano; Frostin, Maryvonne; Hnawia, Eduardo; Laurent, Dominique; Débitus, Cecile; Pietra, Francesco (2006). "Sobre el primer compuesto orgánico poliarsénico de la naturaleza: arsenicina a de la esponja marina de Nueva Caledonia Echinochalina bargibanti". Química: una revista europea . 12 (35): 8989–94. doi :10.1002/chem.200600783. PMID 17039560.
- ^ "Inicio". sigmaaldrich.com .