Reactivo de organolitio
En química organometálica , los reactivos de organolitio son compuestos químicos que contienen enlaces carbono - litio (C–Li) . Estos reactivos son importantes en la síntesis orgánica y se utilizan con frecuencia para transferir el grupo orgánico o el átomo de litio a los sustratos en pasos sintéticos, a través de adición nucleofílica o desprotonación simple . [1] Los reactivos de organolitio se utilizan en la industria como iniciadores para la polimerización aniónica , que conduce a la producción de varios elastómeros . También se han aplicado en síntesis asimétrica en la industria farmacéutica. [2] Debido a la gran diferencia de electronegatividad entre el átomo de carbono y el átomo de litio, el enlace C−Li es altamente iónico . Debido a la naturaleza polar del enlace C−Li, los reactivos de organolitio son buenos nucleófilos y bases fuertes. Para la síntesis orgánica de laboratorio, muchos reactivos de organolitio están disponibles comercialmente en forma de solución. Estos reactivos son altamente reactivos y, a veces, son pirofóricos .


Historia y desarrollo
Los estudios sobre reactivos de organolitio comenzaron en la década de 1930 y fueron iniciados por Karl Ziegler , Georg Wittig y Henry Gilman . En comparación con los reactivos de Grignard (magnesio) , los reactivos de organolitio a menudo pueden realizar las mismas reacciones con mayores velocidades y rendimientos, como en el caso de la metalación . [3] Desde entonces, los reactivos de organolitio han superado a los reactivos de Grignard en el uso común. [4]
Estructura
Aunque las especies de alquil-litio simples a menudo se representan como monómero RLi, existen como agregados ( oligómeros ) o polímeros. [5] El grado de agregación depende del sustituyente orgánico y de la presencia de otros ligandos. [6] [7] Estas estructuras se han dilucidado mediante una variedad de métodos, en particular la espectroscopia de RMN de 6Li , 7Li y 13C y el análisis de difracción de rayos X. [1] La química computacional respalda estas asignaciones. [5]
Naturaleza del enlace carbono-litio

Las electronegatividades relativas del carbono y el litio sugieren que el enlace C−Li será altamente polar. [8] [9] [10] Sin embargo, ciertos compuestos de organolitio poseen propiedades como la solubilidad en solventes no polares que complican el asunto. [8] Si bien la mayoría de los datos sugieren que el enlace C−Li es esencialmente iónico, ha habido un debate sobre cuánto carácter covalente existe en él. [9] [10] Una estimación sitúa el porcentaje de carácter iónico de los compuestos de alquillitio entre el 80 y el 88 %. [11]
En los compuestos de alil litio, el catión litio se coordina con la cara del enlace π de carbono en forma η 3 en lugar de un centro carbaniónico localizado, por lo que los alil litios suelen estar menos agregados que los alquil litios. [6] [12] En los complejos de aril litio, el catión litio se coordina con un único centro carbaniónico a través de un enlace de tipo Li−C σ. [6] [13]
Estructura de estado sólido

Al igual que otras especies que consisten en subunidades polares, las especies de organolitio se agregan. [7] [14] La formación de agregados está influenciada por interacciones electrostáticas , la coordinación entre el litio y las moléculas de solvente circundantes o aditivos polares y efectos estéricos. [7]
Un bloque de construcción básico para construir estructuras más complejas es un centro carbaniónico que interactúa con un triángulo Li 3 en una forma η 3 -. [5] En reactivos de alquil-litio simples, estos triángulos se agregan para formar estructuras de tetraedro u octaedro. Por ejemplo, el metil-litio , el etil-litio y el terc -butil-litio existen todos en el tetrámero [RLi] 4 . El metil-litio existe como tetrámeros en un grupo de tipo cubano en estado sólido, con cuatro centros de litio formando un tetraedro. Cada metanuro en el tetrámero en metil-litio puede tener interacción agóstica con cationes de litio en tetrámeros adyacentes. [5] [7] El etil-litio y el terc -butil-litio, por otro lado, no exhiben esta interacción y, por lo tanto, son solubles en solventes de hidrocarburos no polares. Otra clase de alquil-litio adopta estructuras hexaméricas, como el n -butillitio , el isopropil-litio y el ciclohexanil-litio. [5]
Las amidas de litio comunes, por ejemplo, la bis(trimetilsilil)amida de litio y la diisopropilamida de litio , también están sujetas a agregación. [15] Las amidas de litio adoptan estructuras de tipo escalera polimérica en disolventes no coordinantes en estado sólido, y generalmente existen como dímeros en disolventes etéreos. En presencia de ligandos fuertemente donantes, se forman centros de litio tri- o tetraméricos. [16] Por ejemplo, la LDA existe principalmente como dímeros en THF. [15] Las estructuras de las amidas de litio comunes, como la diisopropilamida de litio (LDA) y la hexametildisilazida de litio (LiHMDS), han sido ampliamente estudiadas por Collum y colaboradores utilizando espectroscopia de RMN . [17] Otra clase importante de reactivos son los silillitios, ampliamente utilizados en la síntesis de complejos organometálicos y dendrímeros de polisilano . [7] [18] En estado sólido, a diferencia de los reactivos de alquil-litio, la mayoría de los silil-litios tienden a formar estructuras monoméricas coordinadas con moléculas de disolventes como el THF, y solo unos pocos silil-litios se han caracterizado como agregados superiores. [7] Esta diferencia puede surgir del método de preparación de los silil-litios, el impedimento estérico causado por los sustituyentes alquilo voluminosos en el silicio y la naturaleza menos polarizada de los enlaces Si-Li. La adición de ligandos fuertemente donadores, como TMEDA y (-)- esparteína , puede desplazar las moléculas de disolventes coordinantes en los silil-litios. [7]
Estructura de la solución
Es posible que los reactivos de organolitio adopten estructuras en solución que difieren del estado sólido. [6] [19] La espectroscopia de RMN ha surgido como una herramienta poderosa para los estudios de agregados de organolitio en solución. Para las especies de alquil-litio, el acoplamiento C−Li J se puede utilizar a menudo para determinar la cantidad de litio que interactúa con un centro de carbanión y si estas interacciones son estáticas o dinámicas. [6] Las señales de RMN separadas también pueden diferenciar la presencia de múltiples agregados de una unidad monomérica común. [20]
Los compuestos de organolitio se unen a bases de Lewis como tetrahidrofurano (THF), éter dietílico (Et2O ) , tetrametiletilendiamina (TMEDA) o hexametilfosforamida (HMPA). [5] El metil-litio es un caso especial: su estructura tetramérica no se ve afectada por el éter o incluso por el HMPA. [7] Por otro lado, el THF desagrega el butil-litio hexamérico: el tetrámero es la especie principal y ΔG para la interconversión entre tetrámero y dímero es de alrededor de 11 kcal/mol. [21] El TMEDA también puede quelatarse con los cationes de litio en n -butillitio y formar dímeros solvatados como [(TMEDA)LiBu-n)] 2 . [5] [6] Se ha demostrado que el fenil-litio existe como un tetrámero distorsionado en el solvato de éter cristalizado y como una mezcla de dímero y tetrámero en solución de éter. [6]
| Grupo alquilo | Solvente | Estructura |
|---|---|---|
| metilo | Teoría de la relatividad | tetrámero |
| éter/HMPA | tetrámero | |
| n- butilo | pentano | hexámero |
| éter | tetrámero | |
| Teoría de la relatividad | Tetrámero-dímero | |
| sec- butilo | pentano | hexámero-tetrámero |
| isopropilo | pentano | hexámero-tetrámero |
| terc- butilo | pentano | tetrámero |
| Teoría de la relatividad | monómero | |
| fenilo | éter | Tetrámero-dímero |
| éter/HMPA | dímero |
Estructura y reactividad
A medida que las estructuras de los reactivos de organolitio cambian según su entorno químico, también lo hacen su reactividad y selectividad. [7] [22] Una pregunta en torno a la relación estructura-reactividad es si existe una correlación entre el grado de agregación y la reactividad de los reactivos de organolitio. Originalmente se propuso que los agregados inferiores, como los monómeros, son más reactivos en los alquil-litios. [23] Sin embargo, también se han descubierto vías de reacción en las que el dímero u otros oligómeros son las especies reactivas, [24] y para las amidas de litio como LDA, las reacciones basadas en dímeros son comunes. [25] Una serie de estudios de cinética de solución de reacciones mediadas por LDA sugieren que los agregados inferiores de enolatos no conducen necesariamente a una mayor reactividad. [17]
Además, algunas bases de Lewis aumentan la reactividad de los compuestos de organolitio. [26] [27] Sin embargo, no siempre está claro si estos aditivos funcionan como fuertes ligandos quelantes y cómo el aumento observado en la reactividad se relaciona con los cambios estructurales en los agregados causados por estos aditivos. [26] [27] Por ejemplo, TMEDA aumenta las velocidades y las eficiencias en muchas reacciones que involucran reactivos de organolitio. [7] Hacia los reactivos de alquillitio, TMEDA funciona como un ligando donante, reduce el grado de agregación, [5] y aumenta la nucleofilia de estas especies. [28] Sin embargo, TMEDA no siempre funciona como un ligando donante para el catión litio, especialmente en presencia de centros aniónicos de oxígeno y nitrógeno. Por ejemplo, solo interactúa débilmente con LDA y LiHMDS incluso en solventes de hidrocarburos sin ligandos donantes competitivos. [29] En la litiación de iminas, mientras que el THF actúa como un fuerte ligando donante de LiHMDS, el TMEDA débilmente coordinado se disocia fácilmente de LiHMDS, lo que lleva a la formación de dímeros de LiHMDS que son las especies más reactivas. Por lo tanto, en el caso de LiHMDS, el TMEDA no aumenta la reactividad al reducir el estado de agregación. [30] Además, a diferencia de los compuestos de alquillitio simples, el TMEDA no desagrega el acetofenolato de litio en solución de THF. [6] [31] La adición de HMPA a amidas de litio como LiHMDS y LDA a menudo da como resultado una mezcla de agregados de dímero/monómero en THF. Sin embargo, la relación de especies de dímero/monómero no cambia con el aumento de la concentración de HMPA, por lo tanto, el aumento observado en la reactividad no es el resultado de la desagregación. El mecanismo de cómo estos aditivos aumentan la reactividad aún se está investigando. [22]
Reactividad y aplicaciones
El enlace C−Li en los reactivos de organolitio está altamente polarizado. Como resultado, el carbono atrae la mayor parte de la densidad electrónica en el enlace y se asemeja a un carbanión. Por lo tanto, los reactivos de organolitio son fuertemente básicos y nucleófilos. Algunas de las aplicaciones más comunes de los reactivos de organolitio en síntesis incluyen su uso como nucleófilos, bases fuertes para la desprotonación, iniciadores para la polimerización y material de partida para la preparación de otros compuestos organometálicos.
Como nucleófilo
Reacciones de carbolitiación
Como nucleófilos, los reactivos de organolitio experimentan reacciones de carbolitiación, mediante las cuales el enlace carbono-litio se agrega a través de un enlace doble o triple carbono - carbono, formando nuevas especies de organolitio. [32] Esta reacción es la reacción más ampliamente empleada de compuestos de organolitio. La carbolitiación es clave en los procesos de polimerización aniónica, y el n -butillitio se utiliza como catalizador para iniciar la polimerización de estireno , butadieno o isopreno o mezclas de los mismos. [33] [34]
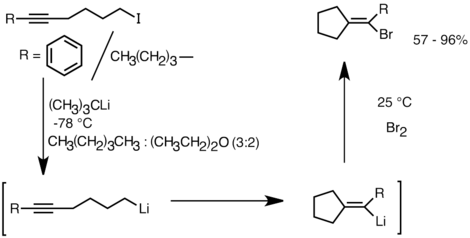
Otra aplicación que aprovecha esta reactividad es la formación de compuestos carbocíclicos y heterocíclicos por carbolitiación intramolecular . [32] Como una forma de ciclización aniónica, las reacciones de carbolitiación intramolecular ofrecen varias ventajas sobre la ciclización radical . En primer lugar, es posible que las especies de organolitio cíclico del producto reaccionen con electrófilos, mientras que a menudo es difícil atrapar un intermedio radical de la estructura correspondiente. En segundo lugar, las ciclizaciones aniónicas son a menudo más regio- y estereoespecíficas que la ciclización radical, particularmente en el caso de 5-hexenillitios. La carbolitiación intramolecular permite la adición del alquil-, vinil-litio a triples enlaces y dobles enlaces mono-alquil sustituidos. Los aril-litios también pueden experimentar adición si se forma un anillo de 5 miembros. Las limitaciones de la carbolitiación intramolecular incluyen la dificultad de formar anillos de 3 o 4 miembros, ya que las especies de organolitio cíclico intermedio a menudo tienden a experimentar aperturas de anillo. [32] A continuación se muestra un ejemplo de reacción de carbolitiación intramolecular. Las especies de litio derivadas del intercambio litio-halógeno se ciclaron para formar el vinil-litio a través del cierre del anillo 5-exo-trig. Las especies de vinil-litio reaccionan además con electrófilos y producen compuestos de ciclopentilideno funcionalizados. [35]
Adición a compuestos carbonílicos
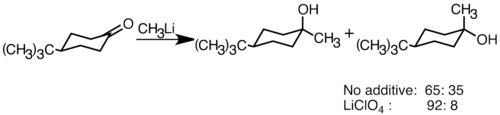
Los reactivos de organolitio nucleófilos pueden sumarse a los dobles enlaces carbonílicos electrofílicos para formar enlaces carbono - carbono. Pueden reaccionar con aldehídos y cetonas para producir alcoholes . La adición se produce principalmente mediante adición polar, en la que las especies de organolitio nucleófilo atacan desde la dirección ecuatorial y producen el alcohol axial. [36] La adición de sales de litio como LiClO 4 puede mejorar la estereoselectividad de la reacción. [37]
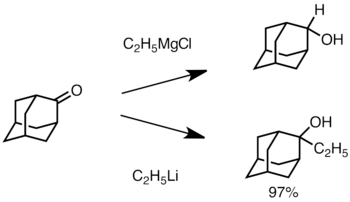
Cuando la cetona está impedida estéricamente, el uso de reactivos de Grignard a menudo conduce a la reducción del grupo carbonilo en lugar de la adición. [36] Sin embargo, los reactivos de alquil-litio tienen menos probabilidades de reducir la cetona y pueden usarse para sintetizar alcoholes sustituidos. [38] A continuación se muestra un ejemplo de adición de etil-litio a adamantona para producir alcohol terciario. [39]
Los reactivos de organolitio también son mejores que los reactivos de Grignard en su capacidad de reaccionar con ácidos carboxílicos para formar cetonas. [36] Esta reacción se puede optimizar controlando cuidadosamente la cantidad de adición de reactivo de organolitio, o usando cloruro de trimetilsililo para extinguir el exceso de reactivo de litio. [40] Una forma más común de sintetizar cetonas es mediante la adición de reactivos de organolitio a amidas de Weinreb ( N -metoxi- N -metilamidas). Esta reacción proporciona cetonas cuando los reactivos de organolitio se usan en exceso, debido a la quelación del ion litio entre el oxígeno N -metoxi y el oxígeno carbonílico, que forma un intermedio tetraédrico que colapsa durante el procesamiento ácido. [41]
Los reactivos de organolitio también reaccionan con dióxido de carbono para formar, después del tratamiento, ácidos carboxílicos . [42]
En el caso de los sustratos de enona , donde son posibles dos sitios de adición nucleofílica (adición 1,2 al carbono carbonílico o adición conjugada 1,4 al carbono β), la mayoría de las especies de organolitio altamente reactivas favorecen la adición 1,2; sin embargo, existen varias formas de impulsar a los reactivos de organolitio para que experimenten una adición conjugada. En primer lugar, dado que el aducto 1,4 es probablemente la especie más favorable termodinámicamente, la adición conjugada se puede lograr a través del equilibrio (isomerización de los dos productos), especialmente cuando el nucleófilo de litio es débil y la adición 1,2 es reversible. En segundo lugar, la adición de ligandos donantes a la reacción forma especies de litio estabilizadas por heteroátomos que favorecen la adición conjugada 1,4. En un ejemplo, la adición de un nivel bajo de HMPA al disolvente favorece la adición 1,4. En ausencia de un ligando donante, el catión litio está estrechamente coordinado con el átomo de oxígeno; sin embargo, cuando el catión litio se solvata con HMPA, la coordinación entre el oxígeno del carbonilo y el ion litio se debilita. Este método generalmente no se puede utilizar para afectar la regioselectividad de los reactivos de alquil- y aril-litio. [43] [44]
Los reactivos de organolitio también pueden realizar una adición nucleofílica enantioselectiva al carbonilo y sus derivados, a menudo en presencia de ligandos quirales. Esta reactividad se aplica ampliamente en las síntesis industriales de compuestos farmacéuticos. Un ejemplo es la síntesis de Merck y Dupont de Efavirenz , un potente inhibidor de la transcriptasa inversa del VIH . Se añade acetiluro de litio a una cetona proquiral para producir un producto de alcohol quiral. La estructura del intermedio de reacción activo se determinó mediante estudios de espectroscopia de RMN en el estado de solución y cristalografía de rayos X del estado sólido como un tetrámero cúbico 2:2. [45]
Snorte2 reacciones de tipo
Los reactivos de organolitio pueden servir como nucleófilos y llevar a cabo reacciones de tipo S N 2 con haluros de alquilo o alílicos. [46] Aunque se consideran más reactivos que los reactivos de Grignard en la alquilación, su uso aún está limitado debido a las reacciones secundarias competitivas, como las reacciones radicalarias o el intercambio metal - halógeno. La mayoría de los reactivos de organolitio utilizados en alquilaciones son más estabilizados, menos básicos y menos agregados, como los reactivos de aril- o alillitio estabilizados con heteroátomos. [6] Se ha demostrado que el HMPA aumenta la velocidad de reacción y los rendimientos del producto, y la reactividad de los reactivos de aril-litio a menudo se mejora mediante la adición de alcóxidos de potasio. [36] Los reactivos de organolitio también pueden llevar a cabo ataques nucleofílicos con epóxidos para formar alcoholes.
Como base
Los reactivos de organolitio proporcionan una amplia gama de basicidad . El terc -butillitio , con tres grupos alquilo que donan electrones débiles, es la base más fuerte disponible comercialmente ( pKa = 53). Como resultado, los protones ácidos en −OH, −NH y −SH a menudo están protegidos en presencia de reactivos de organolitio. Algunas bases de litio comúnmente utilizadas son especies de alquil-litio como n -butillitio y dialquilamidas de litio (LiNR 2 ). Los reactivos con grupos R voluminosos como diisopropilamida de litio (LDA) y bis(trimetilsilil)amida de litio (LiHMDS) a menudo están impedidos estéricamente para la adición nucleofílica y, por lo tanto, son más selectivos hacia la desprotonación. Las dialquilamidas de litio (LiNR 2 ) se utilizan ampliamente en la formación de enolato y la reacción aldólica . [47] La reactividad y selectividad de estas bases también están influenciadas por solventes y otros contraiones.
Metalación
La metalación con reactivos de organolitio, también conocida como litiación o intercambio litio-hidrógeno, se logra cuando un reactivo de organolitio, más comúnmente un alquil-litio, abstrae un protón y forma una nueva especie de organolitio.
| ( 1 ) |
Los reactivos de metalación comunes son los butillitios. El terc -butillitio y el sec -butillitio son generalmente más reactivos y tienen mejor selectividad que el n -butillitio, sin embargo, también son más caros y difíciles de manejar. [47] La metalación es una forma común de preparar reactivos de organolitio versátiles. La posición de metalación está controlada principalmente por la acidez del enlace CH. La litiación a menudo ocurre en una posición α con respecto a los grupos atractores de electrones, ya que son buenos para estabilizar la densidad electrónica del anión. Los grupos directores en compuestos aromáticos y heterociclos proporcionan sitios regioselectivos de metalación; la ortometalación dirigida es una clase importante de reacciones de metalación. Las sulfonas metaladas, los grupos acilo y las amidas α-metaladas son intermediarios importantes en la síntesis química. La metalación del éter alílico con alquillitio o LDA forma un anión α con respecto al oxígeno y puede proceder a la transposición 2,3-Wittig . La adición de ligandos donantes como TMEDA y HMPA puede aumentar la tasa de metalación y ampliar el alcance del sustrato. [48] Se puede acceder a los reactivos de organolitio quirales a través de la metalación asimétrica. [49]
La metalación orto dirigida es una herramienta importante en la síntesis de compuestos aromáticos sustituidos regioespecíficos . Este enfoque de litiación y posterior extinción de las especies intermedias de litio con electrófilos es a menudo mejor que la sustitución aromática electrófila debido a su alta regioselectividad. Esta reacción procede a través de la desprotonación por reactivos de organolitio en las posiciones α al grupo de metalación directa (DMG) en el anillo aromático. El DMG es a menudo un grupo funcional que contiene un heteroátomo que es básico de Lewis y puede coordinarse con el catión de litio ácido de Lewis. Esto genera un efecto de proximidad inducido por complejo, que dirige la desprotonación en la posición α para formar una especie de aril-litio que puede reaccionar aún más con electrófilos. Algunos de los DMG más eficaces son las amidas, los carbamatos , las sulfonas y las sulfonamidas . Son grupos fuertes que atraen electrones y aumentan la acidez de los protones alfa en el anillo aromático. En presencia de dos DMG, la metalación a menudo ocurre en orto con respecto al grupo director más fuerte, aunque también se observan productos mixtos. Varios heterociclos que contienen protones ácidos también pueden sufrir ortometalación. Sin embargo, para heterociclos pobres en electrones, generalmente se utilizan bases de amida de litio como LDA, ya que se ha observado que el alquil-litio realiza una adición a los heterociclos pobres en electrones en lugar de una desprotonación. En ciertos complejos de metal de transición-areno, como el ferroceno , el metal de transición atrae la densidad electrónica del areno, lo que hace que los protones aromáticos sean más ácidos y estén listos para la ortometalación. [50]
Superbases
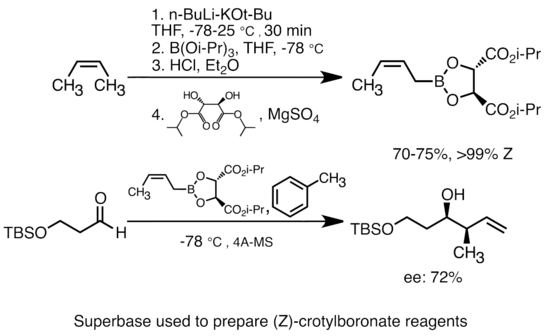
La adición de alcóxido de potasio al alquil-litio aumenta en gran medida la basicidad de las especies de organolitio. [51] La "superbase" más común se puede formar mediante la adición de KOtBu al butillitio, a menudo abreviado como reactivos "LiCKOR". Estas "superbases" son reactivos altamente reactivos y a menudo estereoselectivos. En el ejemplo siguiente, la base LiCKOR genera una especie de crotilboronato estereoespecífico a través de la metalación y el posterior intercambio de litio-metaloide. [52]
Metalación asimétrica
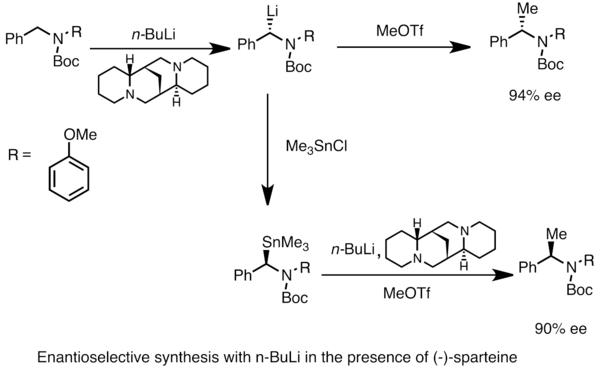
Las especies de organolitio enantioenriquecidas se pueden obtener mediante metalación asimétrica de sustratos proquirales. La inducción asimétrica requiere la presencia de un ligando quiral como (-)- esparteína . [49] La relación enantiomérica de las especies de litio quirales a menudo está influenciada por las diferencias en las tasas de desprotonación. En el ejemplo siguiente, el tratamiento de N -Boc- N -bencilamina con n -butillitio en presencia de (-)-esparteína proporciona un enantiómero del producto con un alto exceso enantiomérico . La transmetalación con cloruro de trimetilestaño proporciona el enantiómero opuesto. [53]
Formación de enolato
Los enolatos de litio se forman a través de la desprotonación de un enlace C−H α al grupo carbonilo por una especie de organolitio. Los enolatos de litio se utilizan ampliamente como nucleófilos en reacciones de formación de enlaces carbono - carbono, como la condensación aldólica y la alquilación. También son un intermediario importante en la formación de éter enólico de sililo .
La formación de enolato de litio se puede generalizar como una reacción ácido - base, en la que el protón α relativamente ácido del grupo carbonilo (pK = 20-28 en DMSO) reacciona con una base de organolitio. Generalmente, se utilizan bases fuertes, no nucleófilas, especialmente amidas de litio como LDA, LiHMDS y LiTMP. El THF y el DMSO son disolventes comunes en las reacciones de enolato de litio. [54]
La estereoquímica y el mecanismo de formación de enolatos han despertado mucho interés en la comunidad química. Muchos factores influyen en el resultado de la estereoquímica de los enolatos, como los efectos estéricos, el disolvente, los aditivos polares y los tipos de bases de organolitio. Entre los muchos modelos utilizados para explicar y predecir la selectividad en la estereoquímica de los enolatos de litio se encuentra el modelo de Ireland. [55]
En este supuesto, un LDA monomérico reacciona con el sustrato carbonílico y forma un estado de transición cíclico de tipo Zimmerman-Traxler . El (E)-enolato se ve favorecido debido a una interacción sin-pentano desfavorable en el estado de transición (Z)-enolato. [54]

Modelo de Irlanda para la estereoselectividad del enolato de litio. En este ejemplo, se favorece el enolato (E).
La adición de aditivos polares como HMPA o DMPU favorece la formación de enolatos (Z). El modelo de Ireland sostiene que estos ligandos donantes se coordinan con los cationes de litio, como resultado, la interacción entre el oxígeno del carbonilo y el litio se reduce, y el estado de transición no está tan fuertemente unido como una silla de seis miembros. El porcentaje de enolatos (Z) también aumenta cuando se utilizan bases de litio con cadenas laterales más voluminosas (como LiHMDS). [54] Sin embargo, el mecanismo de cómo estos aditivos revierten la estereoselectividad aún está siendo debatido.
El modelo de Irlanda ha tenido algunos desafíos, ya que representa la especie de litio como un monómero en el estado de transición. En realidad, a menudo se observa una variedad de agregados de litio en soluciones de enolatos de litio y, dependiendo del sustrato específico, el solvente y las condiciones de reacción, puede ser difícil determinar qué agregado es la especie reactiva real en solución. [54]
Intercambio de litio y halógeno
El intercambio de litio-halógeno implica un intercambio de heteroátomos entre un organohaluro y una especie de organolitio.
| ( 2 ) |
El intercambio de litio-halógeno es muy útil para preparar nuevos reactivos de organolitio. La aplicación del intercambio de litio-halógeno se ilustra mediante la ciclización de Parham. [56]
Transmetalación
Los reactivos de organolitio se utilizan a menudo para preparar otros compuestos organometálicos mediante transmetalación. Los compuestos de organocobre, organoestaño , organosilicio, organoboro, organofosforado, organocerio y organoazufre se preparan con frecuencia haciendo reaccionar reactivos de organolitio con electrófilos apropiados.
| ( 3 ) |
Los tipos comunes de transmetalación incluyen el intercambio Li/Sn, Li/Hg y Li/Te, que son rápidos a baja temperatura. [47] La ventaja del intercambio Li/Sn es que los precursores de tri-alquilestannano experimentan pocas reacciones secundarias, ya que los subproductos n-Bu3Sn resultantes no son reactivos con los reactivos de alquil-litio. [47] En el siguiente ejemplo, el vinilestannano, obtenido por hidrostannilación de un alquino terminal, forma vinil-litio a través de la transmetalación con n-BuLi. [57]
El organolitio también se puede utilizar para preparar compuestos de organozinc mediante transmetalación con sales de zinc. [58]
Los diorganocupratos de litio se pueden formar mediante la reacción de especies de alquil litio con haluro de cobre (I). Los organocupratos resultantes son generalmente menos reactivos hacia los aldehídos y las cetonas que los reactivos de organolitio o los reactivos de Grignard. [59]
Preparación
La mayoría de los reactivos de alquil-litio más simples y las amidas de litio más comunes están disponibles comercialmente en una variedad de solventes y concentraciones. Los reactivos de organolitio también se pueden preparar en el laboratorio. A continuación, se presentan algunos métodos comunes para preparar reactivos de organolitio.
Reacción con litio metálico
La reducción de haluro de alquilo con litio metálico puede producir reactivos de organolitio de alquilo y arilo simples. [36]
| ( 4 ) |
La preparación industrial de reactivos de organolitio se logra utilizando este método al tratar el cloruro de alquilo con litio metálico que contiene 0,5 – 2% de sodio . La conversión es altamente exotérmica . El sodio inicia la vía radical y aumenta la velocidad. [60] La reducción procede a través de una vía radical. A continuación se muestra un ejemplo de la preparación de un reactivo de litio funcionalizado utilizando la reducción con litio metálico. [61] A veces, el litio metálico en forma de polvos finos se utiliza en la reacción con ciertos catalizadores como el naftaleno o el 4,4'-di-t-butilbifenilo (DTBB). Otro sustrato que se puede reducir con litio metálico para generar reactivos de alquil-litio son los sulfuros. La reducción de sulfuros es útil en la formación de reactivos de organolitio funcionalizados como éteres de alfa-litio, sulfuros y silanos. [62]
Metalación
Un segundo método para preparar reactivos de organolitio es la metalación (intercambio de hidrógeno y litio). La acidez relativa de los átomos de hidrógeno controla la posición de la litiación.
Este es el método más común para preparar reactivos de alquinil-litio, porque el hidrógeno terminal unido al carbono sp es muy ácido y se desprotona fácilmente. [36] Para los compuestos aromáticos, la posición de litiación también está determinada por el efecto director de los grupos sustituyentes. [63] Algunos de los grupos sustituyentes directores más eficaces son alcoxi, amido, sulfóxido, sulfonilo. La metalación a menudo ocurre en la posición orto a estos sustituyentes. En los compuestos heteroaromáticos, la metalación generalmente ocurre en la posición orto al heteroátomo. [36] [63]
Intercambio de litio y halógeno
Véase intercambio de litio-halógeno (en Reactividad y aplicaciones)
Un tercer método para preparar reactivos de organolitio es mediante el intercambio de halógeno y litio.
El terc- butillitio o el n- butillitio son los reactivos más utilizados para generar nuevas especies de organolitio a través del intercambio de litio-halógeno. El intercambio de litio-halógeno se utiliza principalmente para convertir yoduros y bromuros de arilo y alquenilo con carbonos sp2 en los compuestos de organolitio correspondientes. La reacción es extremadamente rápida y, a menudo, se produce a una temperatura de -60 a -120 °C. [48]
Transmetalación
El cuarto método para preparar reactivos de organolitio es mediante transmetalación. Este método se puede utilizar para preparar vinil-litio.
Reacción de Shapiro
En la reacción de Shapiro , dos equivalentes de una base fuerte de alquil-litio reaccionan con compuestos de p-tosilhidrazona para producir el vinil-litio o, al extinguirse, el producto de olefina.
Manejo
Los compuestos de organolitio son especies altamente reactivas y requieren técnicas de manipulación especializadas. A menudo son corrosivos, inflamables y, a veces, pirofóricos (ignición espontánea cuando se exponen al aire o la humedad). [64] Los reactivos de alquil-litio también pueden sufrir descomposición térmica para formar las especies de alquilo correspondientes y el hidruro de litio. [65] Los reactivos de organolitio se almacenan normalmente por debajo de los 10 °C. Las reacciones se llevan a cabo utilizando técnicas sin aire . [64] La concentración de reactivos de alquil-litio a menudo se determina por titulación . [66] [67] [68]
Los reactivos de organolitio reaccionan, a menudo lentamente, con éteres, que no obstante se utilizan a menudo como disolventes. [69]
| Solvente | Temperatura | n-BuLi | s-BuLi | t-BuLi | MeLi | CH2 =C(OEt) -Li | CH2 =C( SiMe3 ) -Li |
|---|---|---|---|---|---|---|---|
| Teoría de la relatividad | -40 °C | 338 minutos | |||||
| Teoría de la relatividad | -20 °C | 42 minutos | |||||
| Teoría de la relatividad | 0 °C | 17 horas | |||||
| Teoría de la relatividad | 20 °C | 107 minutos | >15 horas | 17 horas | |||
| Teoría de la relatividad | 35 °C | 10 minutos | |||||
| THF/TMEDA | -20 °C | 55 horas | |||||
| THF/TMEDA | 0 °C | 340 minutos | |||||
| THF/TMEDA | 20 °C | 40 minutos | |||||
| Éter | -20 °C | 480 minutos | |||||
| Éter | 0 °C | 61 minutos | |||||
| Éter | 20 °C | 153 horas | <30 minutos | 17 días | |||
| Éter | 35 °C | 31 horas | |||||
| Éter/TMEDA | 20 °C | 603 minutos | |||||
| DME | -70 °C | 120 minutos | 11 minutos | ||||
| DME | -20 °C | 110 minutos | 2 minutos | ≪2 minutos | |||
| DME | 0 °C | 6 minutos |
Véase también
Lectura adicional
- Reich, HJ; Borst, J. P; Dykstra, RR; Green, PD (1993). "Una técnica espectroscópica de resonancia magnética nuclear para la caracterización de estructuras de pares de iones de litio en THF y solución de THF/HMPA". J. Am. Chem. Soc. 115 (19): 8728–8741. doi :10.1021/ja00072a028.
Referencias
- ^ ab Zabicky, Jacob (2009). "Aspectos analíticos de los compuestos de organolitio". Química de grupos funcionales de PATAI . John Wiley & Sons, Ltd. doi :10.1002/9780470682531.pat0304. ISBN 9780470682531.
- ^ Wu, G.; Huang, M. (2006). "Reactivos de organolitio en procesos farmacéuticos asimétricos". Chem. Rev. 106 ( 7): 2596–2616. doi :10.1021/cr040694k. PMID 16836294.
- ^ Eisch, John J. (2002). "Henry Gilman: pionero estadounidense en el auge de la química organometálica en la ciencia y la tecnología modernas†". Organometallics . 21 (25): 5439–5463. doi :10.1021/om0109408. ISSN 0276-7333.
- ^ Rappoport, Z.; Marek, I., eds. (2004). La química de los compuestos de organolitio (2 partes) . John Wiley & Sons, Ltd. ISBN 978-0-470-84339-0.
- ^ abcdefghi Stey, Thomas; Stalke, Dietmar (2009). "Estructuras de plomo en la química orgánica del litio". PATAI'S Chemistry of Functional Groups . John Wiley & Sons, Ltd. doi :10.1002/9780470682531.pat0298. ISBN 9780470682531.
- ^ abcdefghij Reich, Hans J. (2013). "El papel de los agregados de organolitio y los agregados mixtos en los mecanismos de organolitio". Chemical Reviews . 113 (9): 7130–7178. doi :10.1021/cr400187u. PMID 23941648.
- ^ abcdefghij Strohmann, C; et al. (2009). "Principios de formación de estructuras y reactividad de compuestos de organolitio" (PDF) . Chem. Eur. J . 15 (14): 3320–3334. doi :10.1002/chem.200900041. PMID 19260001.
- ^ ab Jemmis, ED; Gopakumar, G. (2009). "Estudios teóricos en química de organolitio". Química de grupos funcionales de PATAI . John Wiley & Sons, Ltd. doi :10.1002/9780470682531.pat0297. ISBN 9780470682531.
- ^ ab Streiwieser, A. (2009). "Perspectivas sobre química orgánica computacional". J. Org. Chem . 74 (12): 4433–4446. doi : 10.1021/jo900497s. PMC 2728082. PMID 19518150.
- ^ ab Bickelhaupt, FM; et al. (2006). "Covalencia en enlaces altamente polares. Estructura y enlace de oligómeros de metilalcalimetales (CH3M)n (M = Li−Rb; n = 1, 4)". J. Chem. Theory Comput . 2 (4): 965–980. doi :10.1021/ct050333s. PMID 26633056.
- ^ Weiss, Erwin (noviembre de 1993). "Estructuras de complejos organometálicos alcalinos y compuestos relacionados". Angewandte Chemie International Edition en inglés . 32 (11): 1501–1523. doi :10.1002/anie.199315013. ISSN 0570-0833.
- ^ Fraenkel, G.; Qiu, Fayang (1996). "Observación de un litio alílico parcialmente deslocalizado y la dinámica de su desplazamiento sigmatrópico de 1,3 litio". J. Am. Chem. Soc . 118 (24): 5828–5829. doi :10.1021/ja960440j.
- ^ Fraenkel. G; et al. (1995). "El enlace carbono-litio en arl-litio monomérico: dinámica de intercambio, relajación y rotación". J. Am. Chem. Soc . 117 (23): 6300–6307. doi :10.1021/ja00128a020.
- ^ Power, PP; Hope H. (1983). "Aislamiento y estructuras cristalinas de los complejos de eterato de fenil-litio ricos y libres de haluros [(PhLi.Et2O)4] y [(PhLi.Et2O)3.LiBr]". Revista de la Sociedad Química Americana . 105 (16): 5320–5324. doi :10.1021/ja00354a022.
- ^ ab Williard, PG; Salvino, JM (1993). "Síntesis, aislamiento y estructura de un complejo LDA-THF". Journal of Organic Chemistry . 58 (1): 1–3. doi :10.1021/jo00053a001.
- ^ Hilmersson, Goran; Granander, Johan (2009). "Estructura y dinámica de las amidas de litio quirales". Química de grupos funcionales de PATAI . John Wiley & Sons, Ltd. doi :10.1002/9780470682531.pat0342. ISBN 9780470682531.
- ^ ab Collum, DB; et al. (2007). "Diisopropilamida de litio: cinética de la solución e implicaciones para la síntesis orgánica". Angew. Chem. Int. Ed . 49 (17): 3002–3017. doi :10.1002/anie.200603038. PMID 17387670.
- ^ Sekiguchi, Akira.; et al. (2000). "Litiosilanos y su aplicación a la síntesis de dendrímeros de polisilano". Coord. Chem. Rev. 210 : 11–45. doi :10.1016/S0010-8545(00)00315-5.
- ^ Collum, DB; et al. (2008). "Estructuras en solución de enolatos, fenolatos, carboxilatos y alcóxidos de litio en presencia de N,N,N′,N′-tetrametiletilendiamina: una prevalencia de dímeros cíclicos". J. Org. Chem . 73 (19): 7743–7747. doi :10.1021/jo801532d. PMC 2636848. PMID 18781812 .
- ^ Reich, HJ; et al. (1998). "Agregación y reactividad de soluciones de fenil-litio". J. Am. Chem. Soc . 120 (29): 7201–7210. doi :10.1021/ja980684z.
- ^ McGarrity, JF; Ogle, CA (1985). "Estudio de RMN de protones de alto campo de la agregación y complexación de n-butillitio en tetrahidrofurano". J. Am. Chem. Soc . 107 (7): 1805–1810. doi :10.1021/ja00293a001.
- ^ ab Reich, HJ (2012). "¿Qué está pasando con estos reactivos de litio?". J. Org. Chem . 77 (13): 5471–5491. doi :10.1021/jo3005155. PMID 22594379.
- ^ Wardell, JL (1982). "Capítulo 2". En Wilinson, G.; Stone, FGA; Abel, EW (eds.). Química organometálica integral, vol. 1 (1.ª ed.). Nueva York: Pergamon. ISBN 978-0080406084.
- ^ Strohmann, C.; Gessner, VH (2008). "Estructuras cristalinas de aductos de n-BuLi con (R,R)-TMCDA y las consecuencias para la desprotonación del benceno". J. Am. Chem. Soc . 130 (35): 11719–11725. doi :10.1021/ja8017187. PMID 18686951.
- ^ Collum, DB; et al. (2007). "Diisopropilamida de litio: cinética de la solución e implicaciones para la síntesis orgánica". Angew. Chem. Int. Ed . 46 (17): 3002–3017. doi :10.1002/anie.200603038. PMID 17387670.
- ^ ab Chalk, AJ; Hoogeboom, TJ (1968). "Metalación del anillo de tolueno por butillitio en presencia de N,N,N′,N′-tetrametiletilendiamina". J. Organomet. Chem . 11 : 615–618. doi :10.1016/0022-328x(68)80091-9.
- ^ ab Reich, HJ; Green, DP (1989). "Estudios espectroscópicos y de reactividad de complejos de litio reactivo-HMPA". Revista de la Sociedad Química Estadounidense . 111 (23): 8729–8731. doi :10.1021/ja00205a030.
- ^ Williard, PG; Nichols, MA (1993). "Estructuras en estado sólido de complejos de n-butil-litio-TMEDA, -THF y -DME". Revista de la Sociedad Química Americana . 115 (4): 1568–1572. doi :10.1021/ja00057a050.
- ^ Collum, DB (1992). "¿Es la N,N,N,N-tetrametiletilendiamina un buen ligando para el litio?". Acc. Chem. Res . 25 (10): 448–454. doi :10.1021/ar00022a003.
- ^ Bernstein, MP; Collum, DB (1993). "Tasas de metalaciones de iminas dependientes del solvente y del sustrato por diisopropilamida de litio: comprensión de los mecanismos subyacentes a krel". J. Am. Chem. Soc . 115 (18): 8008–8010. doi :10.1021/ja00071a011.
- ^ Seebach, D (1988). "Estructura y reactividad de los enolatos de litio. Desde la pinacolona hasta las alquilaciones selectivas de péptidos en C. Dificultades y oportunidades que ofrecen las estructuras complejas" (PDF) . Angew. Chem. Int. Ed . 27 (12): 1624–1654. doi :10.1002/anie.198816241.
- ^ abc Fananas, Francisco; Sanz, Roberto (2009). "Reacciones de carbolitiación intramolecular". PATAI'S Chemistry of Functional Groups . John Wiley & Sons, Ltd. doi :10.1002/9780470682531.pat0341. ISBN 9780470682531.
- ^ Heinz-Dieter Brandt, Wolfgang Nentwig1, Nicola Rooney, Ronald T. LaFlair, Ute U. Wolf, John Duffy, Judit E. Puskas, Gabor Kaszas, Mark Drewitt, Stephan Glander "Caucho, 5. Cauchos en solución" en la Enciclopedia de Ullmann de Química industrial, 2011, Wiley-VCH, Weinheim. doi :10.1002/14356007.o23_o02
- ^ Baskaran, D.; Müller, AH (2010). "Polimerización aniónica de vinilo". Polimerizaciones controladas y vivas: de los mecanismos a las aplicaciones . Weinheim, Alemania: Wiley-VCH Verlag GmbH & Co. KGaA. doi :10.1002/9783527629091.ch1. ISBN . 9783527629091.
- ^ Bailey, WF; et al. (1989). "Preparación y ciclización fácil de 5-alquin-1-il-litios". Tetrahedron Lett . 30 (30): 3901–3904. doi :10.1016/S0040-4039(00)99279-7.
- ^ abcdefg Carey, Francis A. (2007). "Compuestos organometálicos de metales del grupo I y II". Química orgánica avanzada: reacción y síntesis, parte B (edición Kindle). Springer. ISBN 978-0-387-44899-2.
- ^ Ashby, EC; Noding, SR (1979). "Los efectos de las sales añadidas en la estereoselectividad y la velocidad de adición de compuestos organometálicos a cetonas". J. Org. Chem . 44 (24): 4371–4377. doi :10.1021/jo01338a026.
- ^ Yamataka, Hiroshi (2009). "Adición de reactivos de organolitio a enlaces dobles". PATAI'S Chemistry of Functional Groups . John Wiley & Sons, Ltd. doi :10.1002/9780470682531.pat0310. ISBN 9780470682531.
- ^ Landa, S.; et al. (1967). "Über adamantan und dessen derivado IX. En derivado sustituyente de 2 estrellas". Colección de comunicaciones químicas checoslovacas . 72 (2): 570–575. doi :10.1135/cccc19670570.
- ^ Rubottom, GM; Kim, C (1983). "Preparación de metilcetonas mediante el tratamiento secuencial de ácidos carboxílicos con metillitio y clorotrimetilsilano". J. Org. Chem . 48 (9): 1550–1552. doi :10.1021/jo00157a038.
- ^ Zadel, G.; Breitmaier, E. (1992). "Síntesis en un solo recipiente de cetonas y aldehídos a partir de dióxido de carbono y compuestos de organolitio". Angew. Chem. Int. Ed . 31 (8): 1035–1036. doi :10.1002/anie.199210351.
- ^ Ronald, RC (1975). "Éteres metoximetílicos. Un grupo activador para la metalación rápida y regioselectiva". Tetrahedron Lett . 16 (46): 3973–3974. doi :10.1016/S0040-4039(00)91212-7.
- ^ Hunt, DA (1989). "Adición de compuestos de organolitio por Michael. Una revisión". Org. Prep. Proc. Int . 21 (6): 705–749. doi :10.1080/00304948909356219.
- ^ Reich, HJ; Sikorski, WH (1999). "Regioselectividad de la adición de reactivos de organolitio a enonas: el papel de HMPA". J. Org. Chem . 64 (1): 14–15. doi :10.1021/jo981765g. PMID 11674078.
- ^ Collum, DB; et al. (2001). "Investigaciones espectroscópicas de RMN de agregados mixtos subyacentes a adiciones 1,2 altamente enantioselectivas de ciclopropilacetiluro de litio a quinazolinonas". J. Am. Chem. Soc . 123 (37): 9135–9143. doi :10.1021/ja0105616. PMID 11552822.
- ^ Sommmer, LH; Korte, WD (1970). "Reacciones de acoplamiento estereoespecíficas entre reactivos de organolitio y haluros secundarios". J. Org. Chem . 35 : 22–25. doi :10.1021/jo00826a006.
- ^ abcd Reactivos de organolitio Reich, HJ 2002 https://organicchemistrydata.org/hansreich/resources/organolithium/organolithium_data/orgli-primer.pdf
- ^ ab La preparación de reactivos y productos intermedios de organolitio Leroux.F., Schlosser.M., Zohar.E., Marek.I., Wiley, Nueva York. 2004. ISBN 978-0-470-84339-0
- ^ ab Hoppe, Dieter; Christoph, Guido (2009). "Desprotonación asimétrica con alquillitio– (−)-esparteína". Química de grupos funcionales de PATAI . John Wiley & Sons, Ltd. doi :10.1002/9780470682531.pat0313. ISBN 9780470682531.
- ^ Clayden, Jonathan (2009). "Metalización dirigida de compuestos aromáticos". Química de grupos funcionales de PATAI . John Wiley & Sons, Ltd. doi :10.1002/9780470682531.pat0306. ISBN 9780470682531.
- ^ Schlosser, M (1988). "Superbases para síntesis orgánica". Pure Appl. Chem . 60 (11): 1627–1634. doi : 10.1351/pac198860111627 .
- ^ Roush, WR; et al. (1988). "Síntesis enantioselectiva utilizando (E)- y (Z)-crotilboronatos modificados con tartrato de diisopropilo: reacciones con aldehídos aquirales". Tetrahedron Lett . 29 (44): 5579–5582. doi :10.1016/S0040-4039(00)80816-3.
- ^ Park, YS; et al. (1996). "α-Litiación de N-Boc-N-(p-metoxifenil)bencilamina mediada por (−)-esparteína: síntesis enantioselectiva de N-Boc-bencilaminas mono y disustituidas (S) y (R)". J. Am. Chem. Soc . 118 (15): 3757–3758. doi :10.1021/ja9538804.
- ^ abcd Valnot, Jean-Yves; Maddaluno, Jacques (2009). "Aspectos de la síntesis, estructura y reactividad de los enolatos de litio". Química de grupos funcionales de PATAI . John Wiley & Sons, Ltd. doi :10.1002/9780470682531.pat0345. ISBN 9780470682531.
- ^ Irlanda. RE; et al. (1976). "Reordenamiento de Claisen del éster enolato. Control estereoquímico a través de la formación estereoselectiva de enolato". J. Am. Chem. Soc . 98 (10): 2868–2877. doi :10.1021/ja00426a033.
- ^ Parham, WP; Bradsher, CK (1982). "Reactivos de organolitio aromáticos con grupos electrófilos. Preparación por intercambio halógeno-litio". Acc. Chem. Res . 15 (10): 300–305. doi :10.1021/ar00082a001.
- ^ Corey, EJ; Wollenberg, RH (1975). "Nuevos reactivos organometálicos útiles para la síntesis de alcoholes alílicos mediante vinilación nucleofílica". J. Org. Chem . 40 (15): 2265–2266. doi :10.1021/jo00903a037.
- ^ Reeder, MR; et al. (2003). "Un método mejorado para la reacción de acoplamiento cruzado de paladio de derivados de oxazol-2-ilzinc con bromuros de arilo". Org. Process Res. Dev . 7 (5): 696–699. doi :10.1021/op034059c.
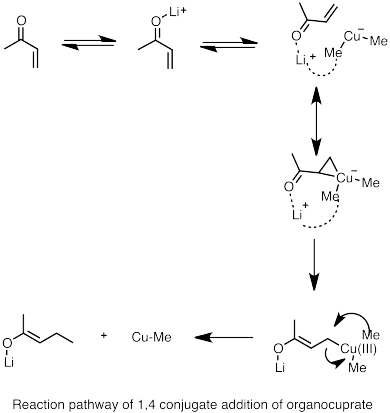
- ^ Nakamura, E.; et al. (1997). "Vía de reacción de la adición conjugada de grupos de organocuprato de litio a la acroleína". J. Am. Chem. Soc . 119 (21): 4900–4910. doi :10.1021/ja964209h.
- ^ "Organometálicos en síntesis orgánica", Schlosser, M., Ed, Wiley: Nueva York, 1994. ISBN 0-471-93637-5
- ^ Si-Fodil, M.; et al. (1998). "Obtención de 2,2-(dietoxi) vinil litio y 2-metil-4-etoxi butadienil litio mediante litiación catalizada por areno de los derivados clorados correspondientes. Aplicaciones sintéticas". Tetrahedron Lett . 39 (49): 8975–8978. doi :10.1016/S0040-4039(98)02031-0.
- ^ Cohen, T; Bhupathy. M (1989). "Compuestos organoalcalinos mediante metalación reductora inducida por aniones radicales de tioéteres de fenilo". Acc. Chem. Res . 22 (4): 152–161. doi :10.1021/ar00160a006.
- ^ ab Snieckus, V (1990). "Ortometalación dirigida. Directores terciarios de amida y O-carbamato en estrategias sintéticas para aromáticos polisustituidos". Chem. Rev. 90 ( 6): 879–933. doi :10.1021/cr00104a001.
- ^ ab Schwindeman, James A.; Woltermann, Chris J.; Letchford, Robert J. (2002). "Manipulación segura de compuestos de organolitio en el laboratorio". Salud y seguridad química . 9 (3): 6–11. doi :10.1016/S1074-9098(02)00295-2. ISSN 1074-9098.
- ^ Gellert, H; Ziegler, K. (1950). "Compuestos organoalcalinos. XVI. La estabilidad térmica de los alquilos de litio". Liebigs Ann. Chem . 567 : 179–185. doi :10.1002/jlac.19505670110.
- ^ Juaristi, E.; Martínez-Richa, A.; García-Rivera, A.; Cruz-Sánchez, JS (1983). "Uso de 4-bifenilmetanol, ácido 4-bifenilacético y ácido 4-bifenilcarboxílico/trifenilmetano como indicadores en la titulación de alquilos de litio. Estudio del dianión de 4-bifenilmetanol". The Journal of Organic Chemistry . 48 (15): 2603–2606. doi :10.1021/jo00163a038.
- ^ "Titulación de reactivos solubles RM, R2NM y ROM" (PDF) . Consultado el 4 de junio de 2014 .
- ^ "Métodos para estandarizar reactivos de alquil-litio (bibliografía hasta 2006)" (PDF) . Consultado el 4 de junio de 2014 .
- ^ Stanetty, P.; Koller, H.; Mihovilovic, M. (1992). "Orto-litiación dirigida del éster 1,1-dimetiletílico del ácido fenilcarbámico (N-Boc-anilina). Revisión y mejoras". J. Org. Chem. 57 (25): 6833–6837. doi :10.1021/jo00051a030.