Bencilamina
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Fenilmetanamina | |
| Otros nombres α-aminotolueno Bencilamina Fenilmetilamina | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 741984 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Banco de medicamentos | |
| Tarjeta informativa de la ECHA | 100.002.595 |
| Número CE |
|
| 49783 | |
| BARRIL | |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 2735 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C7H9N | |
| Masa molar | 107,156 g·mol −1 |
| Apariencia | Líquido incoloro |
| Olor | débil, parecido al amoniaco |
| Densidad | 0,981 g/ml [1] |
| Punto de fusión | 10 °C (50 °F; 283 K) [2] |
| Punto de ebullición | 185 °C (365 °F; 458 K) [2] |
| Miscible [2] | |
| Solubilidad | miscible en etanol , éter dietílico, muy soluble en acetona, soluble en benceno , cloroformo |
| Acidez (p K a ) | 9.34 [3] |
| Basicidad (p K b ) | 4.66 |
| -75,26·10 −6 cm3 / mol | |
Índice de refracción ( n D ) | 1.543 |
| Estructura | |
| 1,38 D | |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Inflamable y corrosivo |
| Etiquetado SGA : | |
  | |
| Peligro | |
| H302 , H312 , H314 | |
| P260 , P264 , P270 , P280 , P301+P312 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P312 , P321 , P322 , P330 , P363 , P405 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | 65 °C (149 °F; 338 K) [2] [1] |
| Ficha de datos de seguridad (FDS) | Científico fischer |
| Compuestos relacionados | |
Aminas relacionadas | anilina |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La bencilamina es un compuesto químico orgánico con la fórmula estructural condensada C6H5CH2NH2 ( a veces abreviada como PhCH2NH2 o BnNH2 ) . Consiste en un grupo bencilo , C6H5CH2 , unido a un grupo funcional amina , NH2 . Este líquido incoloro soluble en agua es un precursor común en química orgánica y se utiliza en la producción industrial de muchos productos farmacéuticos . La sal de clorhidrato se utilizó para tratar el mareo en la misión Mercury-Atlas 6 en la que el astronauta de la NASA John Glenn se convirtió en el primer estadounidense en orbitar la Tierra.
Fabricación
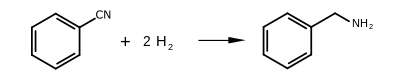
La bencilamina se puede producir por varios métodos, siendo la principal vía industrial la reacción del cloruro de bencilo y el amoníaco . También se produce por reducción del benzonitrilo y aminación reductora del benzaldehído , ambas realizadas sobre níquel Raney . [4]
Fue producido por primera vez accidentalmente por Rudolf Leuckart en la reacción de benzaldehído con formamida en un proceso ahora conocido como la reacción de Leuckart , [5] un proceso general en el que la aminación reductora de aldehídos o cetonas produce la amina correspondiente . [6] [7]
Bioquímica
La bencilamina se produce biológicamente a partir de la acción de la enzima formamida deformilasa N -sustituida , que es producida por la bacteria Arthrobacter pascens . [8] Esta hidrolasa cataliza la conversión de N-bencilformamida en bencilamina con formato como subproducto. [9] La bencilamina se degrada biológicamente por la acción de la enzima monoaminooxidasa B , [10] dando como resultado benzaldehído. [11]
Usos
La bencilamina se utiliza como fuente enmascarada de amoniaco , ya que después de la N - alquilación , el grupo bencilo se puede eliminar por hidrogenólisis : [12]
- C6H5CH2NH2 + 2RBr → C6H5CH2NR2 + 2HBr
- C6H5CH2NR2 + H2 → C6H5CH3 + R2NH
Normalmente se utiliza una base en el primer paso para absorber el HBr (o un ácido relacionado para otros tipos de agentes alquilantes).
La bencilamina reacciona con cloruro de acetilo para formar N -bencilacetamida.
Las isoquinolinas se pueden preparar a partir de bencilamina y acetal de glioxal mediante un enfoque análogo conocido como modificación de Schlittler-Müller de la reacción de Pomeranz-Fritsch. Esta modificación también se puede utilizar para preparar isoquinolinas sustituidas. [13]
La bencilamina se utiliza en la fabricación de otros productos farmacéuticos, entre ellos alniditan , [14] lacosamida , [15] [16] moxifloxacino , [17] y nebivolol . [18]
La bencilamina también se utiliza para fabricar el explosivo militar hexanitrohexaazaisowurtzitano (HNIW), que es superior a los antiguos explosivos de nitroamina como el HMX y el RDX . Como ilustración de la tendencia a la desbencilación de las bencilaminas, cuatro de los grupos bencilo se eliminan del hexabencilhexaazaisowurtzitano mediante hidrogenólisis catalizada por paladio sobre carbono . [19]
Sales
La sal de clorhidrato de bencilamina, C 6 H 5 CH 2 NH 3 Cl o C 6 H 5 CH 2 NH 2 ·HCl, [20] se prepara haciendo reaccionar bencilamina con ácido clorhídrico , y se puede utilizar en el tratamiento del mareo por movimiento . El astronauta de la NASA John Glenn recibió clorhidrato de bencilamina para este propósito para la misión Mercury-Atlas 6. [21] El catión en esta sal se llama bencilamonio y es una fracción que se encuentra en productos farmacéuticos como el agente antihelmíntico hidroxinaftoato de befenio , utilizado en el tratamiento de la ascariasis . [22]
Se ha demostrado que otros derivados de la bencilamina y sus sales tienen propiedades antieméticas , incluidos aquellos con la fracción N -(3,4,5-trimetoxibenzoil)bencilamina. [23] Los agentes contra el mareo disponibles comercialmente, como la cinarizina y la meclizina, son derivados de la bencilamina.
Otras bencilaminas
La 1-feniletilamina es un derivado metilado de la bencilamina que es quiral ; las formas enantiopuras se obtienen mediante la resolución de los racematos . Su forma racémica a veces se conoce como (±)-α-metilbencilamina. [24] Tanto la bencilamina como la 1-feniletilamina forman sales de amonio estables e iminas debido a su basicidad relativamente alta .
Seguridad y medio ambiente
La bencilamina presenta una toxicidad oral moderada en ratas, con una DL50 de 1130 mg/kg. Se biodegrada fácilmente. [4]
Referencias
- ^ ab "Bencilamina". Sigma-Aldrich . Consultado el 28 de diciembre de 2015 .
- ^ abcd Registro en la base de datos de sustancias GESTIS del Instituto de Seguridad y Salud Ocupacional
- ^ Hall, HK (1957). "Correlación de las fuerzas de base de las aminas". J. Am. Chem. Soc. 79 (20): 5441–5444. doi :10.1021/ja01577a030.
- ^ ab Heuer, L. (2006). "Bencilaminas". Ullmann's Encyclopedia of Industrial Chemistry . Wiley-VCH . doi :10.1002/14356007.a04_009.pub2. ISBN 3527306730.
- ^ Crossley, FS; Moore, ML (1944). "Estudios sobre la reacción de Leuckart". J. Org. Chem. 9 (6): 529–536. doi :10.1021/jo01188a006.
- ^ Webers, VJ; Bruce, WF (1948). "La reacción de Leuckart: un estudio del mecanismo". J. Am. Chem. Soc. 70 (4): 1422–1424. doi :10.1021/ja01184a038. PMID 18915755.
- ^ Pollard, CB; Young, DC (1951). "El mecanismo de la reacción de Leuckart". J. Org. Chem. 16 (5): 661–672. doi :10.1021/jo01145a001.
- ^ Schomburg, D.; Schomburg, I.; Chang, A., eds. (2009). "3.5.1.91 N-substituted formamide deformylase". Hidrolasas de clase 3: EC 3.4.22–3.13 . Springer Handbook of Enzymes (2.ª ed.). Springer Science & Business Media . págs. 376–378. ISBN 9783540857051.
- ^ Fukatsu, H.; Hashimoto, Y.; Goda, M.; Higashibata, H.; Kobayashi, M. (2004). "Enzima sintetizadora de aminas formamida deformilasa N-sustituida: cribado, purificación, caracterización y clonación de genes". Proc. Natl. Sci. 101 (38): 13726–13731. Bibcode :2004PNAS..10113726F. doi : 10.1073/pnas.0405082101 . PMC 518824 . PMID 15358859.
- ^ "MAOB: Monoaminooxidasa B – Homo sapiens". Centro Nacional de Información Biotecnológica . 6 de diciembre de 2015. Consultado el 29 de diciembre de 2015 .
- ^ Tipton, KF; Boyce, S.; O'Sullivan, J.; Davey, GP; Healy, J. (2004). "Monoaminooxidasas: Certezas e incertidumbres". Curr. Med. Chem. 11 (15): 1965–1982. doi :10.2174/0929867043364810. PMID 15279561.
- ^ Gatto, VJ; Miller, SR; Gokel, GW (1993). "4,13-Diaza-18-Crown-6". Síntesis orgánicas; Volúmenes recopilados , vol. 8, pág. 152. (ejemplo de alquilación de bencilamina seguida de hidrogenólisis).
- ^ Li, JJ (2014). "Modificación de Schlittler-Müller". Reacciones de nombres: una colección de mecanismos detallados y aplicaciones sintéticas (5.ª ed.). Springer . pág. 492. ISBN 9783319039794.
- ^ Lommen, G.; De Bruyn, M.; Schroven, M.; Verschueren, W.; Janssens, W.; Verrelst, J.; Leysen, J. (1995). "El descubrimiento de una serie de nuevos agonistas 5HT 1D no indol ". Bioorg. Medicina. Química. Letón. 5 (22): 2649–2654. doi :10.1016/0960-894X(95)00473-7.
- ^ Choi, D.; Stables, JP; Kohn, H. (1996). "Síntesis y actividades anticonvulsivas de derivados de N -bencil-2-acetamidopropionamida". J. Med. Chem. 39 (9): 1907–1916. doi :10.1021/jm9508705. PMID 8627614.
- ^ Morieux, P.; Stables, JP; Kohn, H. (2008). "Síntesis y actividades anticonvulsivas de derivados de propionamida N-bencil-(2R)-2-acetamido-3-oxisustituidos". Bioorg. Med. Chem. 16 (19): 8968–8975. doi :10.1016/j.bmc.2008.08.055. PMC 2701728 . PMID 18789868.
- ^ Peterson, U. (2006). "Antibióticos quinolónicos: el desarrollo de la moxifloxacina". En IUPAC ; Fischer, J.; Ganellin, CR (eds.). Descubrimiento de fármacos basados en análogos . John Wiley & Sons . págs. 338–342. ISBN 9783527607495.
- ^ Patente estadounidense 4654362, Van Lommen, GRE; De Bruyn, MFL & Schroven, MFJ, "Derivatives of 2,2'-iminobisetanol", publicado el 31 de marzo de 1987, asignado a Janssen Pharmaceutica, NV . Texto completo
- ^ Nair, UR; Sivabalan, R.; Gore, GM; Geetha, M.; Asthana, SN; Singh, H. (2005). "Fórmulas basadas en hexanitrohexaazaisowurtzitane (CL-20) y CL-20 (revisión)". Combust. Explos. Shock Waves . 41 (2): 121–132. doi :10.1007/s10573-005-0014-2. S2CID 95545484.
- ^ "Clorhidrato de bencilamina". Sigma-Aldrich . Consultado el 28 de diciembre de 2015 .
- ^ Swenson, LS; Grimwood, JM; Alexander, CC "13: Misión a Mercurio cumplida (13.1 Preparando a un hombre para orbitar)". Este nuevo océano: una historia del Proyecto Mercurio . nasa.gov . págs. 413–418.
- ^ Hellgren, U.; Ericsson, Ö.; Aden Abdi, Y.; Gustafsson, LL (2003). "Hidroxinaftoato de befenio". Manual de fármacos para infecciones parasitarias tropicales (2.ª ed.). CRC Press . págs. 33–35. ISBN 9780203211519.
- ^ Patente estadounidense 2879293, Sidney, T. & Goldberg, MW , "Derivados de bencilamina", publicada el 24 de marzo de 1959, concedida el 24 de marzo de 1959, asignada a Hoffmann La Roche . Texto completo
- ^ PubChem Public Chemical Database (26 de diciembre de 2015). «1-feniletilamina». Centro Nacional de Información Biotecnológica . Consultado el 29 de diciembre de 2015 .