Clorito
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Clorito | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química |
|
| Tarjeta informativa de la ECHA | 100.123.477 |
| Número CE |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| ClO− 2 | |
| Masa molar | 67.452 |
| Ácido conjugado | Ácido cloroso |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
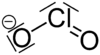
El ion clorito , o anión dióxido de cloro , es la halita con la fórmula química de ClO−
2Un clorito (compuesto) es un compuesto que contiene este grupo, con cloro en el estado de oxidación +3. Los cloritos también se conocen como sales del ácido cloroso .
Compuestos
El ácido libre, ácido cloroso HClO 2 , es el oxoácido menos estable del cloro y sólo se ha observado como una solución acuosa a bajas concentraciones. Como no se puede concentrar, no es un producto comercial. Los compuestos de metales alcalinos y alcalinotérreos son todos incoloros o de color amarillo pálido, siendo el clorito de sodio (NaClO 2 ) el único clorito comercialmente importante. Los cloritos de metales pesados (Ag + , Hg + , Tl + , Pb 2+ , y también Cu 2+ y NH+
4) son inestables y se descomponen explosivamente con el calor o el choque. [1]
El clorito de sodio se deriva indirectamente del clorato de sodio , NaClO 3 . Primero, el dióxido de cloro , gas explosivamente inestable , ClO 2 se produce reduciendo el clorato de sodio con un agente reductor adecuado como metanol, peróxido de hidrógeno, ácido clorhídrico o dióxido de azufre.
Estructura y propiedades
El ion clorito adopta una geometría molecular curvada , debido a los efectos de los pares solitarios en el átomo de cloro, con un ángulo de enlace O-Cl-O de 111° y longitudes de enlace Cl-O de 156 pm. [1] El clorito es el oxidante más fuerte de los oxianiones de cloro sobre la base de los potenciales de semicelda estándar . [2]
| Ion | Reacción ácida | Este (V) | Reacción neutra/básica | Este (V) |
|---|---|---|---|---|
| Hipoclorito | H + + HOCl + e − → 1 ⁄ 2 Cl 2 ( g ) + H 2 O | 1.63 | ClO − + H 2 O + 2 e − → Cl − + 2 OH − | 0,89 |
| Clorito | 3 H + + HOClO + 3 e − → 1 ⁄ 2 Cl 2 ( g ) + 2 H 2 O | 1.64 | ClO− 2+ 2 H 2 O + 4 e − → Cl − + 4 OH − | 0,78 |
| Clorato | 6H ++ ClO− 3+ 5 e − → 1 ⁄ 2 Cl 2 ( g ) + 3 H 2 O | 1.47 | ClO− 3+ 3 H 2 O + 6 e − → Cl − + 6 OH − | 0,63 |
| Perclorato | 8H ++ ClO− 4+ 7 e − → 1 ⁄ 2 Cl 2 ( g ) + 4 H 2 O | 1.42 | ClO− 4+ 4 H2O + 8 e− → Cl− + 8 OH− | 0,56 |
Usos
El clorito más importante es el clorito de sodio (NaClO 2 ), que se utiliza en el blanqueo de textiles, pulpa y papel. Sin embargo, a pesar de su naturaleza fuertemente oxidante, a menudo no se utiliza directamente, sino que se emplea para generar la especie neutra dióxido de cloro (ClO 2 ), normalmente a través de una reacción con HCl:
- 5 NaClO 2 + 4 HCl → 5 NaCl + 4 ClO 2 + 2 H 2 O
Riesgos para la salud
En 2009, la Oficina de Evaluación de Riesgos para la Salud Ambiental de California , u OEHHA, publicó un objetivo de salud pública de mantener cantidades inferiores a 50 partes por mil millones de clorito en el agua potable [3] después de que los científicos del estado informaran que la exposición a niveles más altos de clorito afecta la función de los espermatozoides y la tiroides, causa úlceras de estómago y causó daño a los glóbulos rojos en animales de laboratorio. [4] Algunos estudios han indicado que en ciertos niveles el clorito también puede ser cancerígeno. [5]
El límite legal federal en los Estados Unidos permite niveles de clorito de hasta 1.000 partes por mil millones en el agua potable, 20 veces más clorito que el objetivo de salud pública de California. [6]
Otros oxianiones
Existen varios oxianiones de cloro, en los que puede asumir estados de oxidación de −1, +1, +3, +5 o +7 dentro de los aniones correspondientes Cl − , ClO − , ClO−
2, ClO−
3, o ClO−
4, conocidos comúnmente como cloruro, hipoclorito, clorito, clorato y perclorato, respectivamente. Forman parte de una familia más grande de otros óxidos de cloro .
| estado de oxidación | -1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| anión nombrado | cloruro | hipoclorito | clorito | clorato | perclorato |
| fórmula | Cl − | ClO − | ClO− 2 | ClO− 3 | ClO− 4 |
| estructura |  |  |  |  |  |
Véase también
- Tetraclorodecaóxido , un fármaco a base de clorito
- Clorilo , ClO+
2
Referencias
- ^ ab Greenwood, NN; Earnshaw, A. (2006). Química de los elementos (2.ª ed.). Oxford: Butterworth-Heinemann. pág. 861. ISBN 0750633654.
- ^ Algodón, F. Albert ; Wilkinson, Geoffrey (1988), Química inorgánica avanzada (5.ª ed.), Nueva York: Wiley-Interscience, pág. 564, ISBN 0-471-84997-9
- ^ "Objetivo final de salud pública para el clorito". oehha.ca.gov . Consultado el 8 de agosto de 2023 .
- ^ Grupo de Trabajo Ambiental. "Base de datos de agua del grifo de EWG: contaminantes en el agua". www.ewg.org . Consultado el 8 de agosto de 2023 .
{{cite web}}:|last=tiene nombre genérico ( ayuda ) - ^ "Objetivo de salud pública para el clorito en el agua potable" (PDF) . oehha.ca.gov . Consultado el 8 de agosto de 2023 .
- ^ US EPA, OW (13 de octubre de 2015). "Reglas sobre desinfectantes y subproductos de desinfección de etapa 1 y etapa 2". www.epa.gov . Consultado el 8 de agosto de 2023 .
- Enciclopedia concisa de química Kirk-Othmer , Martin Grayson, editor, John Wiley & Sons, Inc., 1985
