Ciclohexenona
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Ciclohex-2-en-1-ona | |||
| Otros nombres 1-Ciclohex-2-enona | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 3DMet |
| ||
| 1280477 | |||
| EBICh | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.012.021 | ||
| Número CE |
| ||
| 2792 | |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C6H8O | |||
| Masa molar | 96,129 g·mol −1 | ||
| Apariencia | Líquido transparente e incoloro | ||
| Densidad | 0,993 g/ml [1] | ||
| Punto de fusión | -53 °C (-63 °F; 220 K) [1] | ||
| Punto de ebullición | 171 a 173 °C (340 a 343 °F; 444 a 446 K) [1] | ||
| 41,3 g/L (25 °C) | |||
| Peligros | |||
| Etiquetado SGA : | |||
   | |||
| Peligro | |||
| H226 , H301 , H310 , H319 , H330 , H331 | |||
| P210 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P262 , P264 , P270 , P271 , P280 , P284 , P301+P310 , P302+P350 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P311 , P320 , P321 , P322 , P330 , P337+P313 , P361 , P363 , P370+P378 , P403+P233 , P403+P235 , P405 , P501 | |||
| NFPA 704 (rombo cortafuegos) | |||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 220 mg kg −1 (rata, oral) | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
La ciclohexenona es un compuesto orgánico que es un intermedio versátil utilizado en la síntesis de una variedad de productos químicos como productos farmacéuticos y fragancias. [2] Es un líquido incoloro, pero las muestras comerciales suelen ser amarillas.
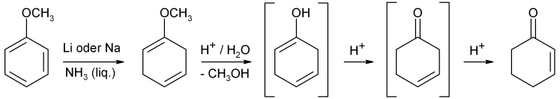
Industrialmente, la ciclohexenona se prepara a partir de fenol mediante reducción de Birch . [3]
La ciclohexenona es una cetona , o más precisamente, una enona . Las reacciones más comunes incluyen la adición conjugada nucleofílica con reactivos de organocobre , las reacciones de Michael y las anulaciones de Robinson . [4] [5]
Síntesis
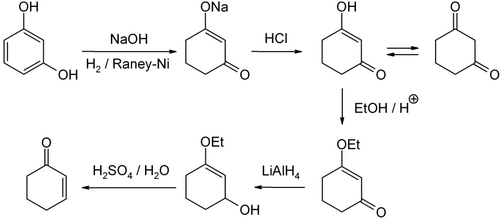
Existen varias vías para la producción de ciclohexenona. A escala de laboratorio, se puede producir a partir de resorcinol mediante 1,3-ciclohexanodiona. [6]
La ciclohexenona se obtiene por reducción de Birch del anisol seguida de hidrólisis ácida.
Se puede obtener a partir de ciclohexanona mediante α-bromación seguida de tratamiento con una base. La hidrólisis del 3-clorociclohexeno seguida de oxidación del ciclohexenol es otra vía.
La ciclohexenona se produce industrialmente mediante oxidación catalítica del ciclohexeno, por ejemplo con peróxido de hidrógeno y catalizadores de vanadio . Varias patentes describen diversos agentes oxidantes y catalizadores.
Reacciones
La ciclohexenona es un componente básico ampliamente utilizado en la química de síntesis orgánica, ya que ofrece muchas formas diferentes de ampliar los marcos moleculares.
Como enona , la ciclohexenona se adapta fácilmente a la adición de Michael con nucleófilos (como enolatos o éteres de sililo enol) o podría emplearse mediante una reacción de Diels-Alder con dienos ricos en electrones . Además, este compuesto reacciona con compuestos organocúpricos por adición 1,4 (adición de Michael), o con reactivos de Grignard por adición 1,2, es decir, con ataque del nucleófilo en el átomo de carbono del carbonilo. La ciclohexenona también se utiliza en síntesis de múltiples pasos en la construcción de productos naturales policíclicos. Es proquiral.
Con bases fuertes, las posiciones 4 y 6 (los dos grupos CH2 del grupo carbonilo y el doble enlace CC adyacente) están desprotonadas.
La ciclohexenona es un catalizador in vitro para una descarboxilación relativamente suave de los aminoácidos alfa . [7] [8]
Compuestos relacionados
- ciclopropenona
- ciclobutenona [9]
- ciclopentenona
- cicloheptenona [10]
Referencias
- ^ abc Ciclohexenona en Sigma-Aldrich
- ^ Podraze, KF Org. Prep. Proced. Int. , 1991, 23, pág. 217.
- ^ Componentes orgánicos básicos de la industria química , Harry H. Szmant, ISBN 978-0-471-85545-3
- ^ Michael G. Organ y Paul Anderson (1996). "Adiciones de carbonilo y conjugados a ciclohexenona: experimentos que ilustran la selectividad de los reactivos". Journal of Chemical Education . 73 (12): 1193. doi :10.1021/ed073p1193.
- ^ Tetrahedron Lett. 34, 3881, (1993)
- ^ RB Thompson (1947). "Dihidroresorcinol". Síntesis orgánicas . 27 : 21. doi :10.15227/orgsyn.027.0021.
- ^ Unos investigadores en Japón estaban intentando utilizar peróxido de t-butilo como catalizador para la descarboxilación utilizando un disolvente elegido de ciclohexanol . Curiosamente, descubrieron que cuando utilizaban ciclohexanol de menor pureza (por ejemplo, de grado técnico, 98 %), la reacción se desarrollaba hasta 4 veces más rápido en comparación con cuando utilizaban ciclohexanol relativamente puro (>99,3 %). Descubrieron que el ciclohexanol contenía ciclohexenona como impureza natural, que era tres veces más abundante en el ciclohexenona de grado técnico en comparación con el ciclohexanol más purificado (~0,3 % frente a ~0,1 %). Investigaciones posteriores demostraron que el 1 % de ciclohexenona en ciclohexanol descarboxilará la mayoría de los alfa-aminoácidos, incluidos los no estándar, con un rendimiento del 80-95 % en cuestión de varias horas. Las excepciones son ciertos aminoácidos como la histidina , que se informó que tarda más de 26 horas, y los poliaminoácidos, que no se descarboxilan utilizando 2-ciclohexenona y se debe encontrar otra ruta en su lugar. Hashimoto, M; Eda, Y; Yasutomo, O; Toshiaki, I; Aoki, S (1986). "Una nueva descarboxilación de .ALFA.-aminoácidos. Un método fácil de descarboxilación mediante el uso de 2-ciclohexen-1-ona como catalizador". Chemistry Letters . 15 (6): 893–896. doi :10.1246/cl.1986.893 . Consultado el 4 de enero de 2016 .
- ^ Laval, G; Golding, B (2003). "One-pot Sequence for the Descarboxilation of α-Amino Acids". Synlett (4): 542–546. doi :10.1055/s-2003-37512 . Consultado el 4 de enero de 2016 .
- ^ AG Ross, X. Li, SJ Danishefsky (2012). "Preparación de ciclobutenona". Organic Syntheses . 89 : 491. doi : 10.15227/orgsyn.089.0491 .
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Y. Ito, S. Fujii, M. Nakatuska, F. Kawamoto, T. Saegusa (1979). "Expansión de anillo de un carbono de cicloalcanonas a cicloalquenonas conjugadas: 2-ciclohepten-1-ona". Organic Syntheses . 59 : 113. doi :10.15227/orgsyn.059.0113.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )