Óxido de cerio (IV)
_oxide.jpg/440px-Cerium(IV)_oxide.jpg) | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Óxido de cerio (IV) | |
| Otros nombres Óxido cérico, Ceria, Dióxido de cerio | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.013.774 |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| CeO2 | |
| Masa molar | 172,115 g/mol |
| Apariencia | Sólido blanco o amarillo pálido, ligeramente higroscópico. |
| Densidad | 7,215 g/ cm3 |
| Punto de fusión | 2.400 °C (4.350 °F; 2.670 K) |
| Punto de ebullición | 3.500 °C (6.330 °F; 3.770 K) |
| insoluble | |
| +26,0·10 −6 cm3 / mol | |
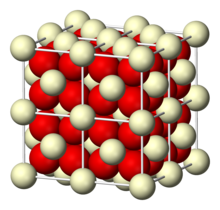
| Estructura | |
| Sistema cristalino cúbico , cF12 ( fluorita ) [1] | |
| FM 3 m, #225 | |
a = 5,41 Å [2] , b = 5,41 Å, c = 5,41 Å α = 90°, β = 90°, γ = 90° | |
| Ce, 8, cúbico O, 4, tetraédrico | |
| Peligros | |
| NFPA 704 (rombo cortafuegos) | |
| Compuestos relacionados | |
Compuestos relacionados | Óxido de cerio (III) |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El óxido de cerio (IV) , también conocido como óxido cérico , dióxido cérico , ceria , óxido de cerio o dióxido de cerio , es un óxido del metal de tierras raras cerio . Es un polvo de color blanco amarillento pálido con la fórmula química CeO 2 . Es un producto comercial importante y un intermediario en la purificación del elemento a partir de los minerales. La propiedad distintiva de este material es su conversión reversible a un óxido no estequiométrico .
Producción
El cerio se encuentra en la naturaleza en forma de óxidos, siempre mezclado con otros elementos de tierras raras. Sus principales menas son la bastnasita y la monacita . Después de la extracción de los iones metálicos en una base acuosa, el Ce se separa de esa mezcla mediante la adición de un oxidante seguida de un ajuste del pH. Este paso aprovecha la baja solubilidad del CeO 2 y el hecho de que otros elementos de tierras raras resisten la oxidación. [3]
El óxido de cerio (IV) se forma mediante la calcinación del oxalato de cerio o del hidróxido de cerio .
El cerio también forma óxido de cerio (III) , Ce
2Oh
3, que es inestable y se oxidará a óxido de cerio (IV). [4]
Características
El CeO 2 es uno de los óxidos de cerio más estudiados. El CeO 2 es la forma más oxidada del cerio, los estados 4f se hibridan fuertemente con los estados O 2p, lo que hace que los electrones 4f se deslocalicen. Estos estados forman una amplia banda dispersiva, que se extiende sobre una región de algunos eV, que se puede detectar correctamente utilizando métodos teóricos con precisión. [5]
Estructura y comportamiento de los defectos
El óxido de cerio adopta la estructura de fluorita , grupo espacial Fm 3 m, #225 que contiene Ce 4+ de 8 coordenadas y O 2− de 4 coordenadas . A altas temperaturas libera oxígeno para dar una forma no estequiométrica, deficiente en aniones que conserva la red de fluorita. [6] Este material tiene la fórmula CeO (2− x ) , donde 0 < x < 0,28. [7] El valor de x depende tanto de la temperatura, la terminación de la superficie y la presión parcial de oxígeno. La ecuación
Se ha demostrado que predice la no estequiometría de equilibrio x en un amplio rango de presiones parciales de oxígeno (10 3 –10 −4 Pa) y temperaturas (1000–1900 °C). [8]
La forma no estequiométrica tiene un color azul a negro y exhibe conducción tanto iónica como electrónica, siendo la iónica la más significativa a temperaturas > 500 °C. [9]
El número de vacantes de oxígeno se mide con frecuencia mediante espectroscopia fotoelectrónica de rayos X para comparar la relación de Ce3+
A Ce4+
.
Defecto químico
En la fase de fluorita más estable de ceria, presenta varios defectos dependiendo de la presión parcial de oxígeno o del estado de tensión del material. [10] [11] [12] [13]
Los defectos principales que preocupan son las vacantes de oxígeno y los pequeños polarones (electrones localizados en los cationes de cerio). El aumento de la concentración de defectos de oxígeno aumenta la tasa de difusión de los aniones de óxido en la red, como se refleja en un aumento de la conductividad iónica . Estos factores le dan al ceria un rendimiento favorable en aplicaciones como electrolito sólido en celdas de combustible de óxido sólido . El ceria dopado y no dopado también exhibe una alta conductividad electrónica a bajas presiones parciales de oxígeno debido a la reducción del ion de cerio que conduce a la formación de pequeños polarones . Dado que los átomos de oxígeno en un cristal de ceria se presentan en planos, la difusión de estos aniones es fácil. La tasa de difusión aumenta a medida que aumenta la concentración de defectos.
La presencia de vacantes de oxígeno en los planos terminales de ceria regula la energía de las interacciones de ceria con las moléculas de adsorbato y su humectabilidad . Controlar dichas interacciones superficiales es clave para aprovechar la ceria en aplicaciones catalíticas. [14]
Ocurrencia natural
El óxido de cerio (IV) se encuentra de forma natural en forma de cerianita-(Ce) mineral . [15] [16] Es un raro ejemplo de mineral de cerio tetravalente, siendo otros ejemplos la estetindita-(Ce) y la dinaesita-(La) . El sufijo "-(Ce)" se conoce como modificador de Levinson y se utiliza para mostrar qué elemento predomina en un sitio particular de la estructura. [17] Se encuentra a menudo en nombres de minerales que contienen elementos de tierras raras (REE). La presencia de cerianita-(Ce) está relacionada con algunos ejemplos de anomalía de cerio , donde Ce -que se oxida fácilmente- se separa de otros REE que permanecen trivalentes y, por lo tanto, se adaptan a estructuras de otros minerales distintos de la cerianita-(Ce). [18] [15] [16]
Aplicaciones
El cerio tiene dos aplicaciones principales, que se enumeran a continuación.
La principal aplicación industrial del óxido de ceria es el pulido, especialmente el planarizado químico-mecánico (CMP). [3] Para este fin, ha desplazado a muchos otros óxidos que se utilizaban anteriormente, como el óxido de hierro y el óxido de circonio . Para los aficionados, también se lo conoce como "rojo de óptico". [19] [20]
En su otra aplicación principal, el CeO2 se utiliza para decolorar el vidrio. Funciona convirtiendo las impurezas ferrosas teñidas de verde en óxidos férricos casi incoloros. [3]
Otras aplicaciones de nicho y emergentes
Catálisis
El CeO2 ha atraído mucha atención en el área de catálisis heterogénea . Cataliza la reacción de desplazamiento de gas de agua . Oxida el monóxido de carbono . Su derivado reducido Ce2O3 reduce el agua, con liberación de hidrógeno. [21] [22] [23] [24]
La interconvertibilidad de los materiales CeO x es la base del uso de ceria como catalizador de oxidación. Un uso pequeño pero ilustrativo es su uso en las paredes de hornos autolimpiantes como catalizador de oxidación de hidrocarburos durante el proceso de limpieza a alta temperatura. Otro ejemplo a pequeña escala pero famoso es su papel en la oxidación del gas natural en mantos de gas . [25]

Basándose en sus distintas interacciones superficiales, la ceria también se utiliza como sensor en convertidores catalíticos en aplicaciones automotrices, controlando la relación aire-escape para reducir las emisiones de NOx y monóxido de carbono . [26]
Energía y combustibles
Debido a la importante conducción iónica y electrónica del óxido de cerio, es muy adecuado para ser utilizado como conductor mixto . [27] Como tal, el óxido de cerio es un material de interés para las celdas de combustible de óxido sólido (SOFC) en comparación con el óxido de circonio . [28]
Termoquímicamente, el ciclo de óxido de cerio (IV)-óxido de cerio (III) o ciclo CeO 2 /Ce 2 O 3 es un proceso de división de agua de dos pasos que se ha utilizado para la producción de hidrógeno . [29] Debido a que aprovecha las vacantes de oxígeno entre los sistemas, esto permite que el ceria en el agua forme grupos hidroxilo (OH). [30] Los grupos hidroxilo pueden luego liberarse a medida que el oxígeno se oxida, proporcionando así una fuente de energía limpia.
Óptica
El óxido de cerio es muy valorado en la industria óptica por sus excepcionales capacidades de pulido. [31] Elimina eficazmente pequeños rayones e imperfecciones de las superficies de vidrio mediante abrasión mecánica e interacción química, produciendo un acabado suave y de alto brillo. [32] El óxido de cerio también puede mejorar la durabilidad de las superficies ópticas al formar una capa protectora que aumenta la resistencia a los rayones y al desgaste ambiental. [33]
El óxido de cerio también se ha utilizado en filtros infrarrojos y como sustituto del dióxido de torio en mantos incandescentes [34].
Soldadura
El óxido de cerio se utiliza como complemento de los electrodos de tungsteno para la soldadura por arco de tungsteno con gas. Ofrece ventajas sobre los electrodos de tungsteno puro, como la reducción de la tasa de consumo de electrodos y una mayor facilidad para iniciar y mantener el arco. Los electrodos de ceria se introdujeron por primera vez en el mercado estadounidense en 1987 y son útiles en CA, CC con electrodo positivo y CC con electrodo negativo.
Aspectos de seguridad
Se han investigado las nanopartículas de óxido de cerio (nanoceria) por su actividad antibacteriana y antioxidante. [35] [36] [37] [38]
La nanoceria es un posible reemplazo del óxido de zinc y el dióxido de titanio en los protectores solares , ya que tiene una actividad fotocatalítica menor . [39]
Véase también
Referencias
- ^ Pradyot Patnaik. Manual de productos químicos inorgánicos . McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ EA Kümmerle y G. Heger, “Las estructuras de C-Ce2O3+δ, Ce7O12 y Ce11O20”, Journal of Solid State Chemistry, vol. 147, núm. 2, págs. 485–500, 1999.
- ^ abc Reinhardt, Klaus; Winkler, Herwig (2000). "Cerio Mischmetal, aleaciones de cerio y compuestos de cerio". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a06_139. ISBN 978-3527306732..
- ^ "Propiedades termodinámicas estándar de sustancias químicas" (PDF) . Archivado desde el original (PDF) el 29 de octubre de 2013.
- ^ Herper, Heike C; Vekilova, Olga Yu; Simak, Sergei I; Di Marco, Igor; Eriksson, Olle (25 de febrero de 2020). "Carácter localizado versus itinerante de los estados 4f en óxidos de cerio". Journal of Physics: Condensed Matter . 32 (21): 215502. doi :10.1088/1361-648x/ab6e92. ISSN 0953-8984.
- ^ Estudio DFT de superficies de óxido de cerio Applied surface science 2019 vol 478
- ^ Defectos y procesos de defectos en sólidos no metálicos Por William Hayes, AM Stoneham Courier Dover Publications, 2004.
- ^ Bulfin, B.; Lowe, AJ; Keogh, KA; Murphy, BE; Lübben, O.; Krasnikov, SA; Shvets, IV (2013). "Modelo analítico de oxidación y reducción de CeO 2 ". The Journal of Physical Chemistry C . 117 (46): 24129–24137. doi :10.1021/jp406578z. hdl : 2262/76279 .
- ^ Ghillanyova, K.; Galusek, D. (2011). "Capítulo 1: Óxidos cerámicos". En Riedel, Ralf; Chen, I-Wie (eds.). Ciencia y tecnología de la cerámica, materiales y propiedades, vol . 2. John Wiley & Sons . ISBN 978-3-527-31156-9.
- ^ Munnings, C.; Badwal, SPS; Fini, D. (2014). "Oxidación espontánea inducida por estrés de iones Ce en ceria dopada con Gd a temperatura ambiente". Ionics . 20 (8): 1117–1126. doi :10.1007/s11581-014-1079-2. S2CID 95469920.
- ^ Badwal, SPS; Daniel Fini; Fabio Ciacchi; Christopher Munnings; Justin Kimpton; John Drennan (2013). "Estabilidad estructural y microestructural del electrolito de ceria-gadolinia expuesto a ambientes reductores de celdas de combustible de alta temperatura". J. Mater. Chem. A . 1 (36): 10768–10782. doi :10.1039/C3TA11752A.
- ^ Anandkumar, Mariappan; Bhattacharya, Saswata; Deshpande, Atul Suresh (23 de agosto de 2019). "Síntesis y caracterización a baja temperatura de soles de nanopartículas de óxido de fluorita multicomponente monofásico". RSC Advances . 9 (46): 26825–26830. Bibcode :2019RSCAd...926825A. doi : 10.1039/C9RA04636D . ISSN 2046-2069. PMC 9070433 . PMID 35528557.
- ^ Pinto, Felipe M (2019). "Defectos de oxígeno y química de superficies de óxidos reducibles". Frontiers in Materials . 6 : 260. Bibcode :2019FrMat...6..260P. doi : 10.3389/fmats.2019.00260 . S2CID 204754299.
- ^ Fronzi, Marco; Assadi, M. Hussein N.; Hanaor, Dorian AH (2019). "Información teórica sobre la hidrofobicidad de superficies de CeO2 de bajo índice" (PDF) . Applied Surface Science . 478 : 68–74. arXiv : 1902.02662 . Bibcode :2019ApSS..478...68F. doi :10.1016/j.apsusc.2019.01.208. S2CID 118895100.
- ^ ab "Cerianita-(Ce)". www.mindat.org . Consultado el 12 de noviembre de 2020 .
- ^ ab "Lista de minerales". www.ima-mineralogy.org . 2011-03-21 . Consultado el 2020-11-12 .
- ^ Burke, Ernst (2008). "El uso de sufijos en los nombres de minerales" (PDF) . Elements . 4 (2): 96.
- ^ Pan, Yuanming; Stauffer, Mel R. (2000). "Anomalía de cerio y fraccionamiento Th/U en el paleosuelo de Flin Flon de 1,85 Ga: pistas de minerales accesorios ricos en tierras raras y U e implicaciones para la reconstrucción paleoatmosférica". Mineralogista estadounidense . 85 (7): 898–911. Código Bibliográfico :2000AmMin..85..898P. doi :10.2138/am-2000-0703. S2CID 41920305.
- ^ "Propiedades de los abrasivos comunes (Museo de Bellas Artes de Boston)" (PDF) .
- ^ "Óxido cérico - CAMEO". cameo.mfa.org .
- ^ Ruosi Peng; et al. (2018). "Efecto del tamaño de las nanopartículas de Pt en la oxidación catalítica de tolueno sobre catalizadores de Pt/CeO2". Catálisis Aplicada B: Medioambiental . 220 : 462. Bibcode :2018AppCB.220..462P. doi :10.1016/j.apcatb.2017.07.048.
- ^ Montini, Tiziano; Melchionna, Michele; Monai, Mateo; Fornasiero, Paolo (2016). "Fundamentos y aplicaciones catalíticas de materiales a base de CeO 2 ". Reseñas químicas . 116 (10): 5987–6041. doi : 10.1021/acs.chemrev.5b00603. hdl : 11368/2890051 . PMID 27120134.
- ^ Paier, Joachim; Penschke, Christopher; Sauer, Joachim (2013). "Defectos de oxígeno y química de superficie de ceria: estudios químicos cuánticos comparados con experimentos". Chemical Reviews . 113 (6): 3949–3985. doi :10.1021/cr3004949. PMID 23651311.
- ^ Gorte, Raymond J. (2010). "Ceria en catálisis: desde aplicaciones automotrices hasta la reacción de desplazamiento de agua-gas". AIChE Journal . 56 (5): 1126–1135. Bibcode :2010AIChE..56.1126G. doi :10.1002/aic.12234.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ Twigg, Martyn V. (2011). "Control catalítico de las emisiones de los automóviles". Catalysis Today . 163 : 33–41. doi :10.1016/j.cattod.2010.12.044.
- ^ "Conductores mixtos". Instituto Max Planck de Investigación del Estado Sólido . Consultado el 16 de septiembre de 2016 .
- ^ Arachi, Y. (junio de 1999). "Conductividad eléctrica del sistema ZrO2–Ln2O3 (Ln=lantánidos)". Solid State Ionics . 121 (1–4): 133–139. doi :10.1016/S0167-2738(98)00540-2.
- ^ "Producción de hidrógeno a partir de ciclos termoquímicos solares de división del agua". SolarPACES . Archivado desde el original el 30 de agosto de 2009.
- ^ "Nuevos descubrimientos sobre el papel del óxido de cerio en la producción de hidrógeno". Ceric . 2018-07-01 . Consultado el 2022-09-22 .
- ^ "Óxido de cerio para eliminar rayones de las pantallas de los teléfonos". Stanford Advanced Materials . Consultado el 1 de julio de 2024 .
- ^ Janos, Pavel; Ederer, Jakub (2016). "Pulido químico-mecánico de vidrio con óxido de cerio: efecto de características físico-químicas seleccionadas en la eficiencia del pulido". Wear . 362–363: 114–120. doi :10.1016/j.wear.2016.05.020.
- ^ Hockey, BJ; Roy, Rice, eds. (1979). La ciencia del mecanizado cerámico y el acabado de superficies II: Actas de un simposio celebrado en la Oficina Nacional de Normas, Gaithersburg, Maryland, del 13 al 15 de noviembre de 1978. Biblioteca de la Universidad de Michigan. pág. 425. ASIN B0030T20RY.
- ^ "Dióxido de cerio". DaNa . Archivado desde el original el 2 de marzo de 2013.
- ^ Rajeshkumar, S.; Naik, Poonam (2018). "Síntesis y aplicaciones biomédicas de nanopartículas de óxido de cerio: una revisión". Informes de biotecnología . 17 : 1–5. doi :10.1016/j.btre.2017.11.008. ISSN 2215-017X. PMC 5723353 . PMID 29234605.
- ^ Karakoti, AS; Monteiro-Riviere, NA; Aggarwal, R.; Davis, JP; Narayan, RJ; Self, WT; McGinnis, J.; Seal, S. (2008). "Nanoceria como antioxidante: síntesis y aplicaciones biomédicas". JOM . 60 (3): 33–37. Bibcode :2008JOM....60c..33K. doi :10.1007/s11837-008-0029-8. PMC 2898180 . PMID 20617106.
- ^ Rajeshkumar, S.; Naik, Poonam (29 de noviembre de 2017). "Síntesis y aplicaciones biomédicas de nanopartículas de óxido de cerio: una revisión". Informes de biotecnología . 17 : 1–5. doi :10.1016/j.btre.2017.11.008. ISSN 2215-017X. PMC 5723353 . PMID 29234605.
- ^ Hussain S, Al-Nsour F, Rice AB, Marshburn J, Yingling B, Ji Z, Zink JI, Walker NJ, Garantziotis S (2012). "Las nanopartículas de dióxido de cerio inducen apoptosis y autofagia en monocitos de sangre periférica humana". ACS Nano . 6 (7): 5820–9. doi :10.1021/nn302235u. PMC 4582414 . PMID 22717232.
- ^ Zholobak, NM; Ivanov, VK; Shcherbakov, AB; Shaporev, AS; Polezhaeva, OS; Baranchikov, A.Ye.; Spivak, N.Ya.; Tretyakov, Yu.D. (2011). "Propiedad de protección UV, actividad fotocatalítica y fotocitotoxicidad de soluciones coloidales de ceria". Journal of Photochemistry and Photobiology B: Biology . 102 (1): 32–38. Bibcode :2011JPPB..102...32Z. doi :10.1016/j.jphotobiol.2010.09.002. PMID 20926307.
Enlaces externos
- Elementos web en la Universidad de Sheffield
- Síntesis y propiedades del óxido de ceria (en inglés y ruso)





