El catalizador de Crabtree
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC ( SP -4)-(η 2 ,η 2 -Cicloocta-1,5-dieno)(piridina)(triciclohexilfosfano)iridio(1+) hexafluoridofosfato(1−) | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química | |
| Tarjeta informativa de la ECHA | 100.164.161 |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C 31 H 50 F 6 IrNP 2 | |
| Masa molar | 804,9026 g/mol |
| Apariencia | Microcristales amarillos |
| Punto de fusión | 150 °C (302 °F; 423 K) (se descompone) [1] |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El catalizador de Crabtree es un compuesto de organoiridio con la fórmula [ C 8 H 12 Ir P(C 6 H 11 ) 3 C 5 H 5 N ]PF 6 . Es un catalizador homogéneo para reacciones de hidrogenación y transferencia de hidrógeno, desarrollado por Robert H. Crabtree . Este sólido naranja estable al aire está disponible comercialmente y es conocido por su hidrogenación dirigida para dar estereoselectividad trans con el respectivo grupo director. [2] [3]
Estructura y síntesis
El complejo tiene una geometría molecular plana cuadrada , como se esperaba para el complejo ad 8. Se prepara a partir de dímero de cloruro de iridio de ciclooctadieno . [4]
Reactividad
El catalizador de Crabtree es eficaz para la hidrogenación de sustratos mono-, di-, tri- y tetra-sustituidos. Mientras que el catalizador de Wilkinson y el catalizador de Schrock-Osborn no catalizan la hidrogenación de una olefina tetrasustituida, el catalizador de Crabtree sí lo hace a altas frecuencias de recambio (tabla). [2] [5]
Frecuencias de rotación Sustrato El catalizador de Wilkinson Catalizador Schrock-Osborn El catalizador de Crabtree Hex-1-eno 650 4000 6400 Ciclohexeno 700 10 4500 1-Metilciclohexeno 13 — 3800 2,3-Dimetil-but-2-eno — — 4000
El catalizador es reactivo a temperatura ambiente. [1] La reacción es robusta sin disolventes secantes ni desoxigenación meticulosa del hidrógeno. El catalizador es tolerante a grupos funcionales débilmente básicos como los ésteres, pero no a los alcoholes (ver más abajo) o las aminas. [2] El catalizador es sensible a las impurezas que contienen protones. [6]
El catalizador se desactiva irreversiblemente después de unos diez minutos a temperatura ambiente, lo que se indica mediante la aparición de un color amarillo. Un proceso de desactivación implica la formación de dímeros con puentes de hidruro. [7] Como consecuencia, el catalizador de Crabtree se utiliza habitualmente con cargas de catalizador muy bajas.

Otras funciones catalíticas: intercambio de isótopos e isomerización
Además de la hidrogenación, el catalizador cataliza la isomerización y la hidroboración de alquenos. [1]

El catalizador de Crabtree se utiliza en reacciones de intercambio de isótopos . Más específicamente, cataliza el intercambio directo de un átomo de hidrógeno con sus isótopos deuterio y tritio , sin el uso de un intermediario. [8] Se ha demostrado que el intercambio de isótopos con el catalizador de Crabtree es altamente regioselectivo. [9] [10]
Influencia de la dirección de grupos funcionales
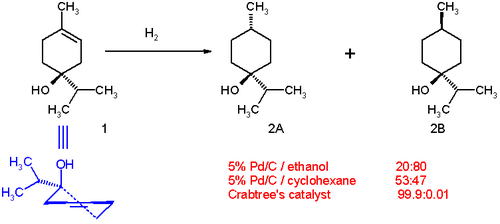
La hidrogenación de un terpen-4-ol demuestra la capacidad de los compuestos con grupos directores (el grupo –OH) de sufrir hidrogenación diastereoselectiva. Con paladio sobre carbono en etanol, la distribución del producto es 20:80 a favor del isómero cis ( 2B en el Esquema 1). El lado polar (con el grupo hidroxilo) interactúa con el disolvente. Esto se debe a una ligera haptofilia, un efecto en el que un grupo funcional se une a la superficie de un catalizador heterogéneo y dirige la reacción. [11] [12] En ciclohexano como disolvente , la distribución cambia a 53:47 porque la haptofilia ya no está presente (no hay ningún grupo director en el ciclohexano). La distribución cambia completamente a favor del isómero trans 2A cuando se utiliza el catalizador de Crabtree en diclorometano . Esta selectividad es predecible y prácticamente útil. [13] También se sabe que los grupos carbonilo dirigen la hidrogenación mediante el catalizador Crabtree para que sea altamente regioselectiva. [14] [15] [16]
A continuación se muestra el efecto director que provoca la estereoselectividad de la hidrogenación del terpen-4-ol con el catalizador de Crabtree.

Historia
Crabtree y el estudiante de posgrado George Morris descubrieron este catalizador en la década de 1970 mientras trabajaban en análogos de iridio del catalizador basado en rodio de Wilkinson en el Institut de Chimie des Substances Naturelles en Gif-sur-Yvette , cerca de París.
Los catalizadores de hidrogenación anteriores incluían el catalizador de Wilkinson y un complejo catiónico de rodio(I) con dos grupos fosfina desarrollado por Osborn y Schrock. [17] Estos catalizadores lograban la hidrogenación a través del desplazamiento; después de la adición de hidrógeno a través del metal, un solvente o un grupo fosfina se disociaba del metal rodio para que la olefina a ser hidrogenada pudiera tener acceso al sitio activo. [2] Este desplazamiento ocurre rápidamente para los complejos de rodio, pero ocurre casi nada para los complejos de iridio. [18] Debido a esto, la investigación en ese momento se centró en compuestos de rodio en lugar de compuestos que involucraban metales de transición de la tercera fila, como el iridio. Wilkinson, Osborn y Schrock también solo usaron solventes coordinantes. [19]
Crabtree observó que el paso de disociación del ligando no ocurre en la catálisis heterogénea , por lo que postuló que este paso era limitante en sistemas homogéneos. [2] Buscaron catalizadores con "sitios activos creados irreversiblemente en un solvente no coordinante". Esto condujo al desarrollo del catalizador de Crabtree y al uso del solvente CH 2 Cl 2 .
Referencias
- ^ abc Crabtree, RH (2001). "Hexafluorofosfato de (1,5-ciclooctadieno)(triciclohexilfosfina)(piridina)iridio(I)". Enciclopedia e-EROS de reactivos para síntesis orgánica . doi :10.1002/047084289X.rc290m.pub4 (inactivo 2024-09-12).
{{cite encyclopedia}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace ) - ^ abcde Robert H. Crabtree (1979). "Compuestos de iridio en catálisis". Acc. Chem. Res . 12 (9): 331–337. doi :10.1021/ar50141a005.
- ^ Brown, JM (1987). "Hidrogenación homogénea dirigida". Angew. Chem. Int. Ed. 26 (3): 190–203. doi :10.1002/anie.198701901.
- ^ Crabtree, RH; Morris, GE (1977). "Algunos complejos de diolefina de iridio (I) y una serie de trans -influencia para los complejos [IrCl (cod) L]". J. Organomet. Chem . 135 (3): 395–403. doi :10.1016/S0022-328X(00)88091-2.
- ^ White, M. (15 de octubre de 2002). «Hidrogenación» (PDF) . Consultado el 1 de diciembre de 2014 .
- ^ Xu, Yingjian; Mingos, D. Michael P .; Brown, John M. (2008). "Revisión del catalizador de Crabtree; efectos del ligando en la estabilidad y durabilidad". Chem. Comm. 2008 (2): 199–201. doi :10.1039/b711979h. PMID 18092086.
- ^ Crabtree, R.; Felkin, H.; Morris, G. (1977). "Complejos catiónicos de iridiodiolefina como catalizadores de hidrogenación de alquenos y aislamiento de algunos complejos hidruro relacionados". Journal of Organometallic Chemistry . 141 (2): 205–215. doi :10.1016/S0022-328X(00)92273-3.
- ^ Schou, S. (2009). "El efecto de añadir el catalizador de Crabtree al negro de rodio en reacciones de intercambio directo de isótopos de hidrógeno". Revista de compuestos etiquetados y radiofármacos . 52 (9): 376–381. doi :10.1002/jlcr.1612.
- ^ Valsborg, J.; Sorensen, L.; Foged, C. (2001). "Intercambio de isótopos de hidrógeno catalizado por organoiridio de derivados de benzamida". Journal of Labelled Compounds and Radiopharmaceuticals . 44 (3): 209–214. doi :10.1002/jlcr.446.
- ^ Hesk, D.; Das, P.; Evans, B. (1995). "Deuteración de acetanilidas y otros aromáticos sustituidos utilizando [Ir(COD)(Cy3P ) (Py)]PF6 como catalizador". Revista de compuestos etiquetados y radiofármacos . 36 (5): 497–502. doi :10.1002/jlcr.2580360514.
- ^ Thompson, H.; Naipawer, R. (1973). "Control estereoquímico de las reducciones. III. Enfoque de las haptofilias de grupo". Journal of the American Chemical Society . 95 (19): 6379–6386. doi :10.1021/ja00800a036.
- ^ Rowlands, G. (1 de enero de 2002). «Hidrogenación» (PDF) . Archivado desde el original (PDF) el 2 de enero de 2015. Consultado el 1 de diciembre de 2014 .
- ^ Brown, J. (1987). "Hidrogenación homogénea dirigida [Nuevos métodos sintéticos (65)]". Angew. Chem. Int. Ed. Engl. 26 (3): 190–203. doi :10.1002/anie.198701901.
- ^ Schultz, A.; McCloskey, P. (1985). "Hidrogenaciones homogéneas de olefinas catalizadas por iridio estereoselectivas dirigidas por grupos carboxamida y carbalcoxi". Journal of Organic Chemistry . 50 (26): 5905–5907. doi :10.1021/jo00350a105.
- ^ Crabtree, RH; Davis, MW (1986). "Efectos de dirección en la hidrogenación homogénea con [Ir(cod)(PCy3)(py)]PF6". J. Org. Chem . 51 (14): 2655–2661. doi :10.1021/jo00364a007.
- ^ Crabtree, R.; Davis, M. (1983). "Aparición y origen de un efecto director pronunciado de un grupo hidroxilo en la hidrogenación con [Ir(cod)P(C 6 H 11 ) 3 (py)]PF 6 ". Organometallics . 2 (5): 681–682. doi :10.1021/om00077a019.
- ^ Schrock, R.; Osborn, JA (1976). "Hidrogenación catalítica utilizando complejos catiónicos de rodio. I. Evolución del sistema catalítico y la hidrogenación de olefinas". Journal of the American Chemical Society . 98 (8): 2134–2143. doi :10.1021/ja00424a020.
- ^ Osborn, J.; Shapley, J. (1970). "Reordenamientos intramoleculares rápidos en compuestos de metales de transición pentacoordinados. Mecanismo de reordenamiento de algunos complejos fluxionales de iridio(I)". Journal of the American Chemical Society . 92 (23): 6976–6978. doi :10.1021/ja00726a047.
- ^ Young, J.; Wilkinson, G. (1966). "La preparación y propiedades del tris(trifenilfosfina)halogenorodio(I) y algunas reacciones derivadas de ello, incluida la hidrogenación catalítica homogénea de olefinas y acetilenos y sus derivados". J. Chem. Soc. A. 1966 : 1711. doi :10.1039/J19660001711.