Caseidae
| Caseidae Rango temporal: Carbonífero tardío - Pérmico medio , | |
|---|---|
 | |
| Esqueleto fósil de Cotylorhynchus romeri | |
| Clasificación científica | |
| Dominio: | Eucariota |
| Reino: | Animalia |
| Filo: | Cordados |
| Clado : | Sinápsidos |
| Clado : | † Caseasauria |
| Familia: | † Caséidos Williston , 1912 |
| Géneros | |
Caseidae son una familia extinta de sinápsidos basales que vivieron desde el Carbonífero Superior hasta el Pérmico Medio hace entre unos 300 y 265 millones de años. Los fósiles de estos animales proceden de la parte centro-sur de Estados Unidos ( Texas , Oklahoma y Kansas ), de varias partes de Europa ( Rusia europea , Francia , Alemania , Cerdeña y Polonia ), y posiblemente de Sudáfrica si el género Eunotosaurus es efectivamente un caseido como propusieron algunos autores en 2021. Los caseidos muestran una gran diversidad taxonómica y morfológica. Los taxones más basales fueron pequeñas formas insectívoras y omnívoras que vivieron principalmente en el Carbonífero Superior y el Pérmico Inferior, como Eocasea , Callibrachion y Martensius . Este tipo de caseido persiste hasta el Pérmico medio con Phreatophasma y puede ser Eunotosaurus . Durante el Pérmico temprano, el clado está representado principalmente por muchas especies que adoptaron una dieta herbívora . Algunos han evolucionado hasta convertirse en formas gigantescas que pueden alcanzar los 6-7 metros (20-23 pies) de longitud, como Cotylorhynchus hancocki y Alierasaurus ronchii , lo que los convierte en los sinápsidos más grandes del Pérmico. Los caseidos se consideran componentes importantes de los primeros ecosistemas terrestres en la historia de los vertebrados porque las numerosas especies herbívoras de esta familia se encuentran entre los primeros tetrápodos terrestres en ocupar el papel de consumidor primario . Los caseidos experimentaron una radiación evolutiva significativa al final del Pérmico temprano, convirtiéndose, junto con los eureptiles captorínidos , en los herbívoros dominantes de los ecosistemas terrestres en lugar de los edafosáuridos y los diadectidos .
En 2016 y 2022, los paleontólogos propusieron un estilo de vida semiacuático para los géneros más derivados como Cotylorhynchus y Lalieudorhynchus , pero esta hipótesis es cuestionada por otros investigadores.
Con un registro fósil que abarca desde el Carbonífero Tardío hasta el Pérmico Medio, los caseidos son uno de los grupos de sinápsidos basales (antes conocidos como « pelicosaurios ») que tiene el rango estratigráfico más grande . También representan uno de los dos únicos grupos de sinápsidos basales (junto con los Varanopidae ) que sobreviven en comunidades terrestres dominadas por terápsidos . Así, los últimos caseidos conocidos provienen de los estratos del Pérmico medio ( Roadiense superior - Wordiense ) de Francia y la Rusia europea, donde cohabitaron notablemente con dinocéfalos . [nb 1] Estos últimos caseidos aún muestran una cierta diversidad morfológica con herbívoros medianos a grandes ( Ennatosaurus y Lalieudorhynchus ), así como pequeñas formas depredadoras u omnívoras como Phreatophasma y posiblemente Eunotosaurus . Los caseidos son hasta ahora desconocidos en los estratos del Pérmico superior y probablemente desaparecieron a fines del Pérmico medio. Fueron reemplazados por pareiasaurios (con dentición similar) y dicinodontes .
Descripción

Los caseidos medían desde menos de 1 metro (3 pies 3 pulgadas) hasta 7 metros (23 pies) de longitud. [1] [2] [3] Tenían una cabeza pequeña más ancha que alta y con un hocico inclinado hacia adelante, un cuello muy corto, una cola larga, extremidades anteriores robustas y un cuerpo de proporciones variables dependiendo de su dieta. Pequeñas especies insectívoras como Eocasea tenían un tronco no expandido. [4] Otras con una dieta omnívora como Martensius tenían una caja torácica apenas agrandada, un cráneo más alargado, fosas nasales más pequeñas y un hocico menos inclinado hacia adelante que en los caseidos herbívoros. [5] Estos últimos se caracterizaban por su cráneo desproporcionadamente pequeño en comparación con el tamaño del cuerpo. El esqueleto postcraneal muestra de hecho un aumento espectacular en el volumen de la caja torácica , que se vuelve muy ancha y en forma de barril, probablemente para acomodar un intestino particularmente desarrollado , necesario para la digestión de plantas ricas en fibra. En estas formas, el cráneo tiene fosas nasales externas muy grandes y una región facial muy corta con una fuerte inclinación hacia adelante del extremo del hocico que sobresale claramente de la fila dental. Las fenestras temporales también son relativamente grandes (especialmente en Ennatosaurus ), las supratemporales son de gran tamaño y, en la superficie occipital , los procesos parooccipitales están masivamente desarrollados, estableciendo fuertes contactos de apoyo con los escamosos . [6] La superficie dorsal del cráneo está cubierta de numerosas fosas pequeñas. Estas sugieren la presencia de grandes escamas en la cabeza de estos animales. [7] Numerosos agujeros labiales que corren paralelos al borde ventral del premaxilar y el maxilar , así como a lo largo del borde dorsal del dentario , sugieren la presencia de "labios" escamosos que deben haber ocultado la dentición cuando las mandíbulas estaban cerradas. [8] [7] Los dientes , simplemente cónicos y puntiagudos en las especies insectívoras, adoptan en las especies herbívoras una morfología foliácea o espatulada y están provistos de cúpulas más o menos numerosas. Numerosos dientes pequeños adornaban también varios huesos del paladar. Las especies herbívoras no muestran una tendencia evolutiva simple hacia el aumento de la complejidad dentaria. [9] Así, los dientes de los taxones basales Casea y Arisierpeton presentan tres cúpulas [10] [11]al igual que en las formas más derivadas Cotylorhynchus y Caseopsis . [10] Ennatosaurus y Euromycter , que ocupan una posición filogenética intermedia, tienen dientes con 5 a 7 cúspulas y de 5 a 8 cúspulas respectivamente. [9] [12] Angelosaurus , uno de los caseidos más derivados, tiene dientes con 5 cúspulas. [10] En Angelosaurus los dientes tienen una morfología bulbosa con coronas muy cortas y anchas. Su robustez y el importante desgaste que muestran indican que Angelosaurus debió alimentarse de plantas más resistentes que aquellas de las que se alimentaban la mayoría de los demás caseidos herbívoros. [10] Los caseidos herbívoros también muestran adaptaciones dietéticas muy diferentes a las observadas en otro grupo de sinápsidos basales, los Edaphosauridae . Estos últimos tenían, además de la dentición marginal, una batería dental formada por numerosos dientes ubicados tanto en el paladar como en la superficie interna de las mandíbulas inferiores. En los caseidos herbívoros, los dientes palatinos son más pequeños y la superficie interna de las mandíbulas inferiores no presenta dientes. En lugar de una batería dental, tenían una lengua enorme (como lo indica la presencia de un aparato hioideo altamente desarrollado encontrado en Ennatosaurus y Euromycter ) tal vez rugosa, con la que tenían que comprimir la comida contra los dientes palatinos. [10] [8]


Las extremidades anteriores de los caseidos suelen ser más robustas que las posteriores. De hecho, se ha observado que los huesos de las extremidades anteriores ganaron en robustez desde el comienzo de la evolución del grupo, antes de la aparición de especies grandes, mientras que las extremidades posteriores se mantuvieron más delgadas. Estas características sugieren que el fortalecimiento inicial de las extremidades anteriores probablemente estaba relacionado con una función particular como la excavación, y que este rasgo fue posteriormente exaptado por caseidos más derivados y de mayor tamaño para soportar sus pesos de hasta varios cientos de kilogramos. [1] Durante su historia evolutiva, los caseidos también muestran una reducción en su fórmula falángica. [nb 2] Los caseidos más basales como Eoasea , Callibrachion y Martensius poseían la condición plesiomórfica de los amniotas primitivos con una fórmula falángica de 2-3-4-5-3 para manus y 2-3-4-5-4 para pes . [4] [13] [5] En Euromycter, la mano tiene una fórmula de 2-3-4-4-3 (se desconoce el pie). [12] En las formas más derivadas como Cotylorhynchus, la mano y el pie muestran una fórmula falángica de 2-2-3-3-2. [nb 3] [14] [15] [10] [16] Junto con esta reducción en el número de falanges, las proporciones de los autópodos también cambian en los caseidos derivados con metacarpianos , metatarsianos y falanges que se vuelven más cortos y anchos. En el extremo de esta especialización, el género Angelosaurus tiene falanges ungueales cortas, anchas y lisas que se parecen a pezuñas en lugar de garras . [10] [17]
Huellas
Se ha propuesto que muchas huellas de vertebrados pertenecen a Caseidae. A principios de la década de 2000, se consideró que unas grandes huellas conocidas como Brontopus giganteus de la cuenca pérmica de Lodève en el sur de Francia pertenecían a un terápsido caseido o dinocéfalo . [18] En 2019, Lorenzo Marchetti y sus colegas, sin embargo, determinaron que los dinocéfalos eran probablemente los creadores de huellas del icnogénero Brontopus . [19] En 2012, Rafael Costa da Silva y sus colegas propusieron que el icnogénero Chelichnus , ampliamente distribuido en las facies desérticas del Pérmico ( dunas fósiles ) de Europa , América del Norte y América del Sur , podría representar huellas de caseidos. [20] En 2019, Marchetti y sus colegas, sin embargo, reinterpretaron Chelichnus como un nomen dubium y un taphotaxon , este tipo de pista muestra características anatómicas falsas generadas por la locomoción en una paleosuperficie inclinada arenosa. [21] En 2014, Eva Sacchi y colegas describieron el icnotaxón Dimetropus osageorum a partir de alrededor de cien huellas aisladas y varios rastros de la Formación Wellington del Pérmico temprano en Oklahoma . El estudio morfológico de estas huellas y su comparación con esqueletos de tetrápodos reveló que probablemente pertenecen a un gran caseido comparable en tamaño a Cotylorhynchus romeri (este último de estratos más recientes). [22] Según Sacchi y colegas, algunas huellas de la Cuenca de Lodève (formación geológica no especificada) son similares a las de la Formación Wellington y estos autores las designan como Dimetropus cf. osageorum . [22] El estudio de Sacchi et al. también demuestra que el icnogénero Dimetropus exhibe una gran variación morfológica y que sus productores pueden asignarse a diferentes grupos zoológicos entre los sinápsidos no terápsidos y no solo Sphenacodontidae como se pensaba. [22] En 2021, Rafel Matamales-Andreu y sus colegas asignaron huellas encontradas en la Formación Port des Canonge del Pérmico Inferior ( Artinskiense - Kunguriano ) en Mallorca a un caseido. Estas huellas se parecen a las de D. osageorum pero también tienen diferencias. Estas huellas se dejan en nomenclatura abierta como cf. Dimetropussp.. Sin embargo, son más pequeños que los de D. osageorum y habrían sido producidos por un caseido de tamaño modesto con proporciones comparables a Ennatosaurus . [23]
Paleobiología
Dietas


Durante su historia evolutiva, los caseidos cambiaron de una dieta faunívora a una herbívora, un patrón que también ocurrió de forma independiente en otros grupos de tetrápodos del Carbonífero y el Pérmico, como Captorhinidae y Edaphosauridae . Los caseidos más tempranos y más basales, como el Eocasea del Carbonífero tardío y el Callibrachion del Pérmico temprano , tenían una caja torácica sin expandir y una dentadura compuesta por dientes cónicos muy pequeños, lo que sugiere una dieta insectívora. Otro caseido basal, Martensius , tiene un tronco y una dentadura ligeramente agrandados en forma de barril en los que los dientes indicativos de una dieta insectívora en los juveniles han sido reemplazados ontogenéticamente en los adultos por dientes que sugieren una dieta omnívora . En Martensius , el adulto todavía era capaz de alimentarse de insectos, pero también posee un borrador de las especializaciones de la dieta herbívora presentes en los caseidos posteriores, como un hocico relativamente corto, ligeramente inclinado hacia adelante, y una dentadura que es casi homodonta en las mandíbulas superiores y completamente homodonta en las mandíbulas inferiores. La secuencia de adquisición de los rasgos dentales en Martensius sugiere que el procesamiento de la vegetación intestinal precedió al procesamiento oral en la evolución de la herbivoría de los caseidos. Una dieta insectívora juvenil habría proporcionado la oportunidad de introducir con éxito en el intestino microorganismos capaces de celulolisis endosimbiótica , particularmente si las presas ingeridas eran insectos herbívoros que albergaban dichos microorganismos en sus vísceras . Posteriormente, los caseidos adoptaron una dieta estrictamente herbívora y evolucionaron hacia formas gigantescas. Estos caseidos herbívoros tenían dientes espatulados equipados con cúspides más o menos numerosas y una caja torácica muy agrandada y en forma de barril que debe haber albergado intestinos altamente desarrollados necesarios para la digestión de plantas con bajo valor nutricional. Esta adaptación explicaría en parte la diversificación y expansión del grupo a finales del Pérmico Inferior y durante el Pérmico Medio, ya que les permitió explotar un recurso vegetal rico en fibras que para entonces ya se había vuelto abundante y extendido. Sin embargo, pequeños caseidos probablemente faunívoros como Phreatophasma parecen haber persistido hasta el Pérmico Medio. [4] [13] [24] [5]
Estilo de vida semiacuático vs terrestre

Los caseidos son considerados animales terrestres en general. Everett C. Olson, en particular, consideró que el grado de osificación del esqueleto, los pies y manos relativamente cortos, las garras enormes, las extremidades con músculos extensores muy potentes y el sacro sólido sugerían fuertemente un estilo de vida terrestre. Olson no descartó que los caseidos pasaran algún tiempo en el agua, pero consideró que la locomoción en tierra era un aspecto importante de su estilo de vida. [10] Se ha sugerido que las extremidades anteriores muy poderosas, con músculos extensores fuertes y muy tendinosos, así como las garras muy grandes, podrían usarse para desenterrar raíces o tubérculos. [10] Sin embargo, el cuello muy corto implicaba una baja amplitud de movimientos verticales de la cabeza que impedía a la especie grande alimentarse a nivel del suelo. [25] Otra hipótesis sugiere que los caseidos podrían haber usado sus poderosas extremidades anteriores para doblar hacia ellos plantas grandes, que habrían arrancado con sus poderosas garras. [10] Otras hipótesis sugieren que algunos caseidos como Cotylorhynchus utilizaban sus extremidades con poderosas garras para defenderse de depredadores, o durante actividades intraespecíficas vinculadas en particular a la reproducción . Según Olson, algo interesante de esto, es que casi todos los ejemplares conocidos de la especie Cotylorhynchus hancocki tienen de una a diez costillas rotas y curadas durante la vida. [15] [10] Finalmente, para algunos autores, los grandes caseidos derivados habrían sido animales semiacuáticos que utilizaban sus manos con grandes garras a modo de remos , que también podían ser utilizadas para manipular las plantas de las que se alimentaban. [25]
En 2016, Markus Lambertz y sus colegas cuestionaron el estilo de vida terrestre de grandes caseidos como Cotylorhynchus . Estos autores demostraron que la microestructura ósea del húmero, fémur y costillas de especímenes adultos e inmaduros de Cotylorhynchus romeri se parecía más a la de los animales acuáticos que a la de los animales terrestres, teniendo los huesos una estructura muy esponjosa , una corteza extremadamente delgada y sin un canal medular definido . Esta baja densidad ósea habría sido una desventaja para los animales que pesaban varios cientos de kilos con un estilo de vida estrictamente terrestre. Lambertz et al. también argumentaron que las articulaciones entre las vértebras y las costillas dorsales permitían solo pequeños rangos de movimiento de la caja torácica, lo que limitaba la ventilación costal. Para superar esto, propusieron que estaba presente un protodiafragma para facilitar la respiración, especialmente en ambiente acuático. Estos autores también consideran que los paleoclimas áridos a los que corresponden los depósitos de caseidos no son incompatibles con un estilo de vida acuático de estos animales. De hecho, estos paleoambientes incluían un número significativo de cuerpos de agua (ríos, lagos y lagunas). Las condiciones áridas podrían haber sido la razón por la que los animales a veces se congregaban y finalmente morían. Además, los ambientes áridos tienen una baja densidad de plantas, lo que requeriría aún más esfuerzo locomotor para encontrar alimento. Así, para Lambertz et al., los grandes caseidos como Cotylorhynchus deben haber sido principalmente animales acuáticos que solo llegaban a tierra firme con fines de reproducción o termorregulación . [25]
Esta hipótesis es sin embargo cuestionada por Kenneth Angielczyk y Christian Kammerer así como por Robert Reisz y colegas basándose en datos paleontológicos y tafonómicos combinados con la ausencia en estos grandes caseidos de adaptaciones morfológicas a un estilo de vida acuático. Según Angielczyk y Kammerer, la baja densidad ósea de los caseidos identificados por Lambertz et al. no se parece a la de los animales semiacuáticos, que tienden a tener un esqueleto más fuertemente osificado para proporcionar control pasivo de flotabilidad y mayor estabilidad frente a la acción de la corriente y las olas. La microestructura ósea de Cotylorhynchus es más similar a la que se observa en animales que viven en el océano abierto , como los cetáceos y los pinnípedos , que enfatizan la alta maniobrabilidad, la aceleración rápida y el control hidrodinámico de la flotabilidad. Sin embargo, la morfología de los caseidos era totalmente incompatible con un estilo de vida pelágico . Por lo tanto, debido a estos datos inusuales, Angielczyk y Kammerer consideran que la evidencia disponible aún es insuficiente para cuestionar el estilo de vida terrestre más ampliamente asumido de los caseidos. [2] Robert Reisz y colegas también disputan el supuesto estilo de vida semiacuático de los caseidos sobre el hecho de que estos últimos no poseen adaptaciones morfológicas a un estilo de vida acuático y, en el caso de la especie Cotylorhynchus romeri , sobre la interpretación de que este animal vivía en un ambiente seco durante parte del año como lo indica la presencia de numerosos esqueletos del anfibio Brachydectes preservados en estivación y del pez pulmonado Gnathorhiza , otro estivador bien conocido. [8]
En 2022, Werneburg y sus colegas propusieron un estilo de vida semiacuático algo diferente, en el que los caseidos grandes como Lalieudorhynchus (cuya textura ósea es incluso más osteoporótica que en Cotylorhynchus ) serían equivalentes ecológicos de los hipopótamos modernos , pasando parte de su tiempo en el agua (siendo caminantes submarinos en lugar de animales nadadores) pero llegando a tierra firme en busca de alimento. [26]
Evolución
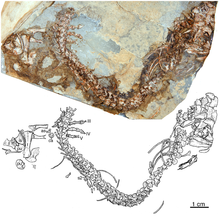

Los caseidos aparecen por primera vez en el registro fósil a finales del Carbonífero y ya están presentes tanto en Norteamérica como en Europa con pequeñas formas depredadoras como Eocasea y Datheosaurus . [4] [13] Estos caseidos faunívoros también existen a principios del Pérmico inferior, como Callibrachion , [13] y pueden haber existido hasta la base del Pérmico medio con Phreatophasma . [24] Durante el Pérmico, los representantes del clado evolucionaron principalmente hacia la herbivoría. Estos caseidos herbívoros experimentaron una importante radiación evolutiva durante la segunda mitad del Pérmico inferior al convertirse, con los eureptiles captorínidos moradisaurinos, en los principales herbívoros de los ecosistemas terrestres en lugar de los edafosáuridos y diadectídeos . El declive de los edafosáuridos y la propagación de los caseidos coincide con una aridificación del ambiente que se produjo a partir del Artinskiano y que habría favorecido la expansión de los caseidos. [27] [26] Los datos sedimentológicos y tafonómicos indican que la mayoría de los edafosáuridos favorecían hábitats húmedos (sus restos se encuentran principalmente en depósitos lacustres y pantanosos) mientras que los caseidos herbívoros generalmente vivían en biotopos más secos donde el agua de estanques y arroyos era efímera. [28] Los últimos caseidos datan del Pérmico Medio y se conocen principalmente en Europa con Phreatophasma y Ennatosaurus del Roadiense - Wordiense de Rusia, [29] [30] [31] Alierasaurus del Roadiense-(¿Wordiano?) de Cerdeña, [32] [33] [26] y Lalieudorhynchus del Wordiense tardío - Capitaniense temprano del sur de Francia. [26] En América del Norte, Angelosaurus romeri y Cotylorhynchus bransoni de la Formación Chickasha en Oklahoma probablemente datan del Roadiense temprano, mientras que los caseidos de la Formación San Angelo en Texas son ligeramente más antiguos y pueden estar a caballo entre el límite Kungurian y Roadiense, pero aún no está claro si datan del Kungurian más tardío o del Roadiense más temprano. [34]
Paleobiogeografía
Se han encontrado fósiles de caseidos en el sur y centro de Estados Unidos ( Texas , Oklahoma , Kansas ), Francia , Alemania , Polonia , Cerdeña y la Rusia europea . Esta distribución geográfica corresponde al cinturón paleoecuatorial de Pangea durante el Carbonífero y el Pérmico, con excepción de las localidades rusas que se ubicaban a nivel del paralelo 30 norte donde prevalecía un clima más templado. La ausencia en Rusia de localidades de vertebrados terrestres anteriores al Kunguriano no permite conocer el momento preciso de la llegada de los caseidos a esta región del mundo. [24] Según Werneburg y colegas, la presencia de caseidos en esta paleolatitud sugiere su posible existencia en las regiones templadas de Gondwana . [26] Una posible ocurrencia de Gondwana fue propuesta ya en la década de 1990 por Michael SY Lee y en 2021 por Asher J. Lichtig y Spencer G. Lucas, quienes reinterpretaron el taxón del Pérmico medio Eunotosaurus de Sudáfrica como un pequeño caseido excavador. [35] [36] Entre estas dos fechas, otros investigadores clasificaron a Eunotosaurus como un parareptil [37] o un pantestudino . [38] [39] Si los tres primeros autores están en lo cierto, Eunotosaurus sería el primer caseido encontrado en el hemisferio sur y el último representante conocido de la familia con una edad Capitaniana más tardía para los especímenes más recientes. [40] En otras partes de Gondwana, la presencia del icnotaxón Dimetropus en el Pérmico de Marruecos sugiere el futuro descubrimiento de sinápsidos basales (incluidos caseidos) en las cuencas pérmicas del norte de África , que también formaban parte del cinturón paleoecuatorial y constituían una de las principales rutas migratorias entre los hemisferios norte y sur. [41] [42]
Filogenia
La familia Caseidae fue erigida por Samuel Wendell Williston en 1911. [43] En 1940, Alfred Sherwood Romer y LW Price colocaron a Caseidae y Edaphosauridae en el mismo suborden, al que llamaron Edaphosauria. [44] Este grupo está ahora abandonado, estando los edafosauridos más cerca de los Sphenacodontia (con los que forman el clado Sphenacomorpha ) que de los caseidos. [28] Estos últimos se agrupan con los Eothyrididae en el clado Caseasauria , que representan los sinápsidos más basales . [45]
El primer análisis filogenético de los caseidos fue publicado en 2008 por Hillary C. Maddin y colegas. En este análisis, el género Oromycter ocupa la posición más basal dentro del clado. Ennatosaurus es el grupo hermano de un clado que contiene a Cotylorhynchus romeri y Angelosaurus dolani . Este análisis revela por primera vez la parafilia del género Casea , la especie “Casea” rutena representa un género distinto que será nombrado en 2011 Euromycter . [9] [46]
A continuación se muestra el primer cladograma de caseidos publicado por Maddin et al. en 2008. [9]
Otro análisis filogenético realizado en 2012 por Benson incluye al género Trichasaurus que ocupa una posición intermedia entre Casea broilii y “Casea” rutena . Ennatosaurus es identificado como el grupo hermano de un clado que incluye a Angelosaurus y las tres especies de Cotylorhynchus . Dentro de este último género, Cotylorhynchus romeri es el grupo hermano de las dos especies C. hancocki y C. bransoni . [47]
A continuación se muestra el cladograma de Caseasauria publicado por Benson en 2012. [47]
En 2015, Marco Romano y Umberto Nicosia publicaron el primer estudio cladístico que incluía casi todos los Caseidae (con la excepción de Alierasaurus ronchii de Cerdeña , entonces considerado demasiado fragmentario). Este estudio nuevamente resuelve el género Casea como parafilético, con la especie “Casea” nicholsi representando un género distinto sin nombre. En su análisis más parsimonioso, Ruthenosaurus está estrechamente relacionado con Cotylorhynchus hancocki . Ennatosaurus ocupa una posición más alta que en análisis anteriores, y se identifica como más estrechamente relacionado con Angelosaurus dolani . Sin embargo, la estrecha relación entre A. dolani y Ennatosaurus puede estar sesgada por la extrema incompletitud del material de las especies de América del Norte. [16]
A continuación se muestra el cladograma de caseidos publicado por Romano y Nicosia en 2015. [16]
Un análisis filogenético publicado en 2016 por Neil Brocklehurst y colegas incluye por primera vez los géneros Callibrachion y Datheosaurus que se identifican como caseidos basales que ocupan una posición intermedia entre Eocasea y Oromycter . [45]
A continuación se muestra el análisis filogenético publicado por Neil Brocklehurst y colegas en 2016. [45]
En 2017, Romano y sus colegas publicaron el primer análisis filogenético que incluía al género Alierasaurus . Este último se recupera como el taxón hermano del género Cotylorhynchus . [48]
A continuación se muestra el análisis filogenético publicado por Romano y colegas en 2017. [48]
Al describir la especie Martensius bromackerensis en 2020, Berman y sus colegas publicaron dos cladogramas en los que se identifica a Martensius como uno de los caseidos más basales, y se ubica justo por encima de Eocasea martini del Carbonífero Tardío . En el primer cladograma, la posición de los caseidos restantes está mal resuelta. En el segundo cladograma, Casea broilii se ubica por encima de Martensius bromackerensis , y es seguida por una politomía entre Oromycter dolesorum , Trichasaurus texensis y un clado de caseidos restantes. Dentro de estos taxones restantes, una secuencia de taxones ramificados comienza con Casea nicholsi , seguida por Euromycter rutenus , luego Ennatosaurus tecton , luego Angelosaurus romeri , luego un clado apical de las tres especies de Cotylorhynchus más Alierasaurus ronchii . En este clado final, Cotylorhynchus hancocki y C. bransoni son taxones hermanos y el clado forma una politomía con C. romeri y Alierasaurus ronchii . [5]
A continuación se muestran los dos cladogramas de caseidos publicados por Berman y colegas en 2020. [5]
| Caseidae | |
| Caseidae | |
En 2022, Werneburg y sus colegas describieron el género Lalieudorhynchus y publicaron un análisis filogenético que concluyó que los géneros Angelosaurus y Cotylorhynchus son parafiléticos y están representados solo por sus especies tipo. En este análisis, Cotylorhynchus romeri se posiciona justo encima del género Angelosaurus , y forma una politomía con un clado que contiene a Ruthenosaurus y Caseopsis y otro clado que contiene a Alierasaurus , las otras dos especies de Cotylorhynchus y Lalieudorhynchus . Dentro de este último clado, Alierasaurus es el grupo hermano de “Cotylorhynchus” bransoni y un clado más derivado que incluye a Lalieudorhynchus y “Cotylorhynchus” hancocki . [26]
A continuación se muestra el cladograma publicado por Werneburg y colegas en 2022. [26]
| Caseidae | |
Notas
- ^ Los dinocéfalos son conocidos en Francia únicamente por sus huellas atribuidas al icnogénero Brontopus . Este último también ha sido encontrado en la Formación Abrahamskraal en Sudáfrica, donde abundan los restos óseos de dinocéfalos. En Rusia , el caseido Ennatosaurus está presente en el conjunto Mezen, que también incluye una especie aún no descrita de dinocéfalo anteosáurido .
- ^ La fórmula de las falanges corresponde al número de falanges que constituyen cada uno de los dedos de la mano y del pie de los tetrápodos . Se enumera a partir del dedo I (que corresponde en los hombres al pulgar y al dedo gordo del pie) hasta el dedo V (el equivalente al meñique de la mano y del pie).
- ^ En 1962 Olson y Barghusen habían reportado en la especie Cotylorhynchus bransoni un pie con la fórmula falángica de 2-2-2-3-2, es decir, una fórmula más pequeña que en la especie tipo C. romeri . Sin embargo, en 2015 Romano y Nicosia demostraron que el tercer dedo del pie de esta especie tenía de hecho tres falanges y no dos. En consecuencia, la fórmula falángica del pie de C. bransoni era 2-2-3-3-2 como la de C. romeri .
Referencias
- ^ ab Romano, M. (2017). "Escalamiento de huesos largos de sinápsidos caseidos: un enfoque morfométrico y cladístico combinado". Lethaia . 50 (4): 511–526. doi :10.1111/let.12207.
- ^ por Angielczyk, KD; Kammerer, CF (2018). "Sinápsidos no mamíferos: las raíces profundas del árbol genealógico de los mamíferos". En Zachos, FE; Asher, RJ (eds.). Manual de zoología: evolución, diversidad y sistemática de los mamíferos . Berlín: de Gruyter. págs. 117–198. ISBN 978-3-11-027590-2.
- ^ Romano, M.; Citton, P.; Magánuco, S.; Sacchi, E.; Caratelli, M.; Ronchi, A.; Nicosia, U. (2018). "Nuevo descubrimiento de sinápsidos basales en el afloramiento pérmico de Torre del Porticciolo (Alghero, Italia)". Revista Geológica . 54 (3): 1554-1566. doi :10.1002/gj.3250. S2CID 133755506.
- ^ abcd Reisz, RR; Fröbisch, J. (2014). "El sinápsido caseido más antiguo del Pensilvania tardío de Kansas y la evolución de la herbivoría en vertebrados terrestres". PLOS ONE . 9 (4): e94518. Bibcode :2014PLoSO...994518R. doi : 10.1371/journal.pone.0094518 . PMC 3989228 . PMID 24739998.
- ^ abcde Berman, DS; Maddin, HC; Henrici, AC; Sumida, SS; Scott, D.; Reisz, RR (2020). "Nueva Caseida primitiva (Synapsida, Caseasauria) del Pérmico Inferior de Alemania". Anales del Museo Carnegie . 86 (1): 43–75. doi :10.2992/007.086.0103. S2CID 216027787.
- ^ Kemp, TS (1982). "Pelycosaurs". En Kemp, TS (ed.). Mammal-like reptiles and the origin of Mammals (Reptiles parecidos a mamíferos y el origen de los mamíferos ). Londres: Academic Press. p. 39. ISBN 978-0124041202.
- ^ ab Romano, M.; Brocklehurst, N.; Fröbisch, J. (2017). "El esqueleto postcraneal de Ennatosaurus tecton (Synapsida, Caseidae)". Revista de Paleontología Sistemática . 16 (13): 1097–1122. doi :10.1080/14772019.2017.1367729. S2CID 89922565.
- ^ abc Reisz, RR; Scott, D.; Modesto, SP (2022). "Anatomía craneal del sinápsido caseido Cotylorhynchus romeri, un gran herbívoro terrestre del Pérmico inferior de Oklahoma, EE. UU." Fronteras en Ciencias de la Tierra . 10 : 1–19. doi : 10.3389/feart.2022.847560 .
- ^ abcd Maddin, HC; Sidor, California; Reisz, RR (2008). "Anatomía craneal de Ennatosaurus tecton (Synapsida: Caseidae) del Pérmico Medio de Rusia y las relaciones evolutivas de Caseidae". Revista de Paleontología de Vertebrados . 28 (1): 160–180. doi :10.1671/0272-4634(2008)28[160:CAOETS]2.0.CO;2. S2CID 44064927.
- ^ abcdefghijk Olson, EC (1968). "La familia Caseidae". Fieldiana: Geología . 17 : 225–349.
- ^ Reisz, R. (2019). "Un pequeño sinápsido caseido, Arisierpeton simplex gen. et sp. nov., del Pérmico temprano de Oklahoma, con una discusión sobre la diversidad de sinápsidos en la localidad clásica de Richards Spur". PeerJ . 7e6615: 1–20. doi : 10.7717/peerj.6615 . PMC 6462398 . PMID 30997285.
- ^ ab Sigoneau-Russell, D.; Russel, DE (1974). "Étude du premier caséidé (Reptilia, Pelycosauria) d'Europe occidentale". Boletín del Museo Nacional de Historia Natural . Serie 3. 38 (230): 145–215.
- ^ abcd Spindler, F.; Falconnet, J.; Fröbisch, J. (2015). "Callibrachion y Datheosaurus, dos sinápsidos caseasaurianos basales históricos y previamente confundidos de Europa". Acta Palaeontologica Polonica . 361 (3): 597–616. doi : 10.4202/app.00221.2015 .
- ^ Stovall, JW; Price, LI; Romer, AS (1966). "El esqueleto postcraneal del pelicosaurio gigante del Pérmico Cotylorhynchus romeri ". Boletín del Museo de Zoología Comparada . 135 (1): 1–30.
- ^ ab Olson, EC (1962). "Vertebrados terrestres del Pérmico tardío, EE. UU. y URSS". Transactions of the American Philosophical Society . Nueva serie. 52 (2): 1–224. doi :10.2307/1005904. JSTOR 1005904.
- ^ abc Romano, M.; Nicosia, U. (2015). "Análisis cladístico de Caseidae (Caseasauria, Synapsida): uso del método de ponderación de huecos para incluir taxones basados en especímenes incompletos". Paleontología . 58 (6): 1109–1130. Bibcode :2015Palgy..58.1109R. doi : 10.1111/pala.12197 . S2CID 86489484.
- ^ Ronchi, A.; Sacchi, E.; Romano, M.; Nicosia, U. (2011). "Un enorme pelicosaurio caseido del noroeste de Cerdeña y su relación con la estratigrafía y paleobiogeografía del Pérmico europeo". Acta Palaeontologica Polonica . 56 (4): 723–738. doi : 10.4202/app.2010.0087 . S2CID 55085495.
- ^ Gand, G.; Garric, J.; Demathieu, G.; Ellenberger, P. (2000). "La palichnofaune de vertébrés tétrapodes du Permien supérieur du bassin de Lodève (Languedoc-Francia)". Palevertebrados . 29 (1): 1–82.
- ^ Marchetti, L.; Klein, H.; Buchwitz, M.; Ronchi, A.; Smith, RMH; De Klerk, WJ; Sciscio, L.; Groenewald, GH (2019). "Huellas de vertebrados del Pérmico-Triásico de Sudáfrica: icnotaxonomía, productores y bioestratigrafía a través de dos grandes crisis faunísticas". Gondwana Research . 72 : 139–168. Bibcode :2019GondR..72..139M. doi : 10.1016/j.gr.2019.03.009 . S2CID 133781923.
- ^ Silva, RC; Sedor, FA; Fernandes, ACS (2012). "Huellas fósiles del Pérmico Tardío de Brasil: Un ejemplo de biodiversidad oculta". Revista de Ciencias de la Tierra Sudamericana . 38 : 31–43. Bibcode :2012JSAES..38...31D. doi :10.1016/j.jsames.2012.05.001.
- ^ Marchetti, L.; Voigt, S.; Lucas, SG (2019). "Un estudio anatómicamente consistente de las huellas eólicas del Lopingiense de Alemania y Escocia revela la primera evidencia de la extinción masiva del final del Guadalupiense en las paleolatitudes bajas de Pangea". Gondwana Research . 73 : 32–53. Bibcode :2019GondR..73...32M. doi :10.1016/j.gr.2019.03.013. S2CID 146780505.
- ^ abc Sacchi, E.; Cifelli, R.; Citton, P.; Nicosia, U.; Romano, M. (2014). " Dimetropus osageorum n. isp. del Pérmico Temprano de Oklahoma (EE. UU.): Un rastro y su trazador". Ichnos: una revista internacional de rastros de plantas y animales . 21 (3): 175–192. doi :10.1080/10420940.2014.933070. S2CID 129567990.
- ^ Matamales-Andreu, R.; Mujal, E.; Galobart, À.; Fortuny, J. (2021). "Conocimiento sobre la evolución de la locomoción sinápsida basada en huellas de tetrápodos del Pérmico inferior de Mallorca (Islas Baleares, Mediterráneo occidental)" (PDF) . Paleogeografía, Paleoclimatología, Paleoecología . 579 : 110589. Código Bib : 2021PPP...579k0589M. doi :10.1016/j.palaeo.2021.110589.
- ^ abc Brocklehurst, N.; Fröbisch, J. (2017). "Un nuevo examen del enigmático tetrápodo ruso Phreatophasma aenigmaticum y sus implicaciones evolutivas". Fossil Record . 20 (1): 87–93. doi : 10.5194/fr-20-87-2017 .
- ^ abc Lambertz, M.; Shelton, CD; Spindler, F.; Perry, SF (2016). "Un punto caseiano para la evolución de un homólogo del diafragma entre los primeros sinápsidos". Anales de la Academia de Ciencias de Nueva York . 1385 (1): 1–18. Bibcode :2016NYASA1385....3L. doi :10.1111/nyas.13264. PMID 27859325. S2CID 24680688.
- ^ abcdefg Werneburg, R.; Spindler, F.; Falconnet, J.; Steyer, J.-S.; Vianey-Liaud, M.; Schneider, JW (2022). «Un nuevo sinápsido caseido del Pérmico (Guadalupiense) de la cuenca de Lodève (Occitania, Francia)» (PDF) . Paleovertebrados . 45(2)-e2 (2): e2. doi :10.18563/pv.45.2.e2. S2CID 253542331.
- ^ Marchetti, L.; Forte, G.; Kustatscher, E.; DiMichele, WA; Lucas, SG; Roghi, G.; Juncal, MA; Hartkopf-Fröder, C.; Krainer, K.; Morelli, C.; Ronchi, A. (2022). "El evento de calentamiento Artinskiano: un cambio euroamericano en el clima y la biota terrestre durante el Pérmico temprano". Earth-Science Reviews . 226 : 103922. Bibcode :2022ESRv..22603922M. doi :10.1016/j.earscirev.2022.103922. S2CID 245892961.
- ^ ab Spindler, F.; Voigt, S.; Fischer, J. (2019). "Edaphosauridae (Synapsida, Eupelycosauria) de Europa y su relación con los representantes de América del Norte". PalZ . 94 (1): 125–153. doi :10.1007/s12542-019-00453-2. S2CID 198140317.
- ^ Golubev, VK (2000). "Los conjuntos faunísticos de vertebrados terrestres del Pérmico de Europa del Este" (PDF) . 34 (Suppl.2): S211–S224.
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ Golubev, VK (2001). "Estratigrafía uniforme y correlación de depósitos marinos de Kazan en el área del estratotipo". Estratigrafía y correlación geológica . 9 (5): 454–472.
- ^ Golubev, VK (2015). "Etapa dinocéfala en la historia de la fauna tetrápoda del Pérmico de Europa del Este". Revista Paleontológica . 49 (2): 1346–1352. doi :10.1134/S0031030115120059. S2CID 130694755.
- ^ Citton, P.; Ronchi, A.; Maganuco, S.; Caratelli, M.; Nicosia, U.; Sacchi, E.; Romano, M. (2019). "Primeras huellas de tetrápodos del Pérmico de Cerdeña y su significado paleontológico y estratigráfico". Revista Geológica . 54 (4): 2084–2098. doi :10.1002/gj.3285. S2CID 135216684.
- ^ Schneider, JW; Lucas, SG; Scholze, F.; Voigt, S.; Marchetti, L.; Klein, H.; Opluštil, S.; Werneburg, R.; Golubev, VK; Barrick, JE; Nemyrovska, T.; Ronchi, A.; Day, MO; Silantiev, VV; Rößler, R.; Saber, H.; Linnemann, U.; Zharinova, V.; Shen, SZ. (2020). "Bioestratigrafía continental del Paleozoico tardío y Mesozoico temprano: vínculos con la escala cronoestratigráfica global estándar". Palaeoworld . 29 (2): 186–238. doi :10.1016/j.palwor.2019.09.001. S2CID 210316208.
- ^ Laurin, M.; Hook, RW (2022). "La edad de los vertebrados continentales paleozoicos más jóvenes de América del Norte: una revisión de los datos de los grupos del Pérmico Medio del río Pease (Texas) y El Reno (Oklahoma)". BSGF - Boletín de Ciencias de la Tierra . 193 (10): 10. doi : 10.1051/bsgf/2022007 . S2CID 248955905.
- ^ Lee, MSY (1995). Morfología evolutiva de los pareiasaurios (tesis doctoral). Cambridge: Departamento de Zoología, Universidad de Cambridge. pp. 151–155.
- ^ Lichtig, AJ; Lucas, SG (2021). "Chinlechelys del Triásico Superior de Nuevo México, Estados Unidos, y el origen de las tortugas". Paleontología Electrónica . 24 ((1):a13): 1–49. doi : 10.26879/886 . S2CID 233454789.
- ^ Modesto, SP (2000). "Eunotosaurus africanus y la ascendencia gondwánica de los reptiles anápsidos". Palaeontologia Africana . 36 : 15–20.
- ^ Bever, GS; Lyson, TR; Field, DJ; Bhullar, BA.S. (2015). "Origen evolutivo del cráneo de tortuga". Nature . 525 (7568): 239–242. Bibcode :2015Natur.525..239B. doi :10.1038/nature14900. PMID 26331544. S2CID 4401555.
- ^ Lyson, TR; Rubidge, BS; Scheyer, TM; de Queiroz, K.; Schachner, ER; Smith, RMH; Botha-Brink, J.; Bever, GS (2016). "Origen fosorial del caparazón de tortuga". Current Biology . 26 (14): 1887–1894. doi : 10.1016/j.cub.2016.05.020 . PMID 27426515. S2CID 3935231.
- ^ Day, MO; Smith, RMH (2020). "Bioestratigrafía de la zona de ensamblaje de Endothiodon (grupo Beaufort, supergrupo Karoo), Sudáfrica". Revista sudafricana de geología . 123 (2): 165–180. Código Bibliográfico :2020SAJG..123..165D. doi :10.25131/sajg.123.0011. S2CID 225834576.
- ^ Voigt, S.; Lagnaoui, A.; Hminna, A.; Sabre, H.; Schneider, JW (2011). "Notas de revisión sobre la icnofauna de tetrápodos del Pérmico de la cuenca de Tiddas, Marruecos central". Paleogeografía, Paleoclimatología, Paleoecología . 302 (3–4): 474–483. Código Bib : 2011PPP...302..474V. doi :10.1016/j.palaeo.2011.02.010.
- ^ Voigt, S.; Sabre, H.; Schneider, JW; Hmich, D.; Hminna, A. (2011). "Icnofauna de tetrápodos del Carbonífero tardío-Pérmico temprano de la cuenca de Khenifra, Marruecos central". Geobios . 44 (4): 399–407. Código Bib : 2011Geobi..44..399V. doi :10.1016/j.geobios.2010.11.008.
- ^ Williston, SW (1911). "Reptiles del Pérmico". Ciencias . 33 (851): 631–632. Bibcode :1911Sci....33..631W. doi :10.1126/science.33.851.631. PMID 17798180.
- ^ Romer, AS; Price, LI (1940). "Revisión de los pelicosaurios". Documento especial de la Sociedad Geológica de América . Documentos especiales de la Sociedad Geológica de América. 28 : 1–538. doi :10.1130/SPE28-p1.
- ^ abc Broklehurst, N.; Reisz, R.; Fernández, V.; Fröbisch, J. (2016). "Una redescripción de 'Mycterosaurus' smithae, un eotirídido del Pérmico temprano, y su impacto en la filogenia de los sinápsidos de grado pelicosaurio". PLOS ONE . 11 (6): e0156810. Bibcode :2016PLoSO..1156810B. doi : 10.1371/journal.pone.0156810 . PMC 4917111 . PMID 27333277.
- ^ Reisz, RR; Maddin, HC; Frobisch, J.; Falconnet, J. (2011). "Un nuevo gran caseide (Synapsida, Caseasauria) del Pérmico de Rodez (Francia), incluida una reevaluación de" Casea "rutena Sigogneau-Russell & Russell, 1974". Geodiversitas . 33 (2): 227–246. doi :10.5252/g2011n2a2. S2CID 129458820.
- ^ ab Benson, RBJ (2012). "Interrelaciones de los sinápsidos basales: las particiones morfológicas craneales y postcraneales sugieren diferentes topologías". Revista de Paleontología Sistemática . 10 (4): 601–624. doi :10.1080/14772019.2011.631042. S2CID 84706899.
- ^ ab Romano, M.; Ronchi, A.; Magánuco, S.; Nicosia, U. (2017). "Nuevo material de Alierasaurus ronchii (Synapsida, Caseidae) del Pérmico de Cerdeña (Italia), y sus afinidades filogenéticas". Paleontología Electrónica . 20.2.26A: 1–27. doi : 10.26879/684 . hdl : 11573/1045550 . S2CID 73577681.
Enlaces externos
- Árbol de la vida
- Paleovertebrados 390.100 Sinápsidos