Octacarbonilo de dicobalto
 | |
 Co 2 (CO) 8 empapado en hexanos | |
| Nombres | |
|---|---|
| Nombre IUPAC Octacarbonildicobalto( Co—Co ) | |
| Otros nombres Carbonilo de cobalto (2:8), di-mu-carbonilhexacarbonildicobalto, octacarbonilo de cobalto, dímero de tetracarbonilo de cobalto, carbonilo de dicobalto, octacarbonildicobalto | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química | |
| Tarjeta informativa de la ECHA | 100.030.454 |
| Número CE |
|
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 3281 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| Co2 ( CO) 8 | |
| Masa molar | 341,95 g/mol |
| Apariencia | cristales de color rojo anaranjado |
| Densidad | 1,87 g/ cm3 |
| Punto de fusión | 51 a 52 °C (124 a 126 °F; 324 a 325 K) |
| Punto de ebullición | 52 °C (126 °F; 325 K) se descompone |
| insoluble | |
| Presión de vapor | 0,7 mmHg (20 °C) [1] |
| Estructura | |
| 1,33 D ( isómero C 2v ) 0 D (isómero D 3d ) | |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Posible carcinógeno |
| Etiquetado SGA : | |
    | |
| Peligro | |
| H251 , H302 , H304 , H315 , H317 , H330 , H351 , H361 , H412 | |
| P201 , P260 , P273 , P280 , P304+P340+P310 , P403+P233 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | -23 °C (-9,4 °F) [1] |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | 15 mg/kg (oral, rata) |
| NIOSH (límites de exposición a la salud en EE. UU.): | |
PEL (Permisible) | ninguno [1] |
REL (recomendado) | Valor de exposición profesional ponderado (TWA) 0,1 mg/m3 [ 1] |
IDLH (Peligro inmediato) | Dakota del Norte [1] |
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa |
| Compuestos relacionados | |
Carbonilos metálicos relacionados | Pentacarbonilo de hierro Nonacarbonilo de dihierro Tetracarbonilo de níquel |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
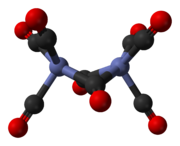
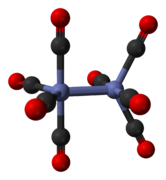
El octacarbonilo de dicobalto es un compuesto de organocobalto con composición Co2 (CO) 8 . Este carbonilo metálico se utiliza como reactivo y catalizador en la química organometálica y la síntesis orgánica , y es fundamental para gran parte de la química del organocobalto conocida . [2] [3] Es el miembro original de una familia de catalizadores de hidroformilación . [4] Cada molécula consta de dos átomos de cobalto unidos a ocho ligandos de monóxido de carbono , aunque se conocen múltiples isómeros estructurales. [5] Algunos de los ligandos de carbonilo son lábiles .
Síntesis, estructura, propiedades.
El octacarbonilo de dicobalto es un sólido pirofórico de color naranja . [6] Se sintetiza mediante la carbonilación a alta presión de sales de cobalto (II) : [6]
- 2 (CH 3 COO) 2 Co + 8 CO + 2 H 2 → Co 2 (CO) 8 + 4 CH 3 COOH
La preparación se lleva a cabo a menudo en presencia de cianuro , convirtiendo la sal de cobalto (II) en un complejo de pentacianocobaltato (II) que reacciona con monóxido de carbono para producir K[Co(CO) 4 ] . La acidificación produce hidruro de tetracarbonilo de cobalto , HCo(CO) 4 , que se degrada cerca de la temperatura ambiente a dicobalto octacarbonilo e hidrógeno. [3] [7] También se puede preparar calentando el metal cobalto a más de 250 °C en una corriente de gas de monóxido de carbono a aproximadamente 200 a 300 atm : [3]
- 2Co + 8CO → Co2 ( CO) 8
Existe como una mezcla de isómeros que se interconvierten rápidamente . [2] [3] En solución, hay dos isómeros conocidos que se interconvierten rápidamente: [5]
El isómero principal (a la izquierda en el proceso de equilibrio anterior ) contiene dos ligandos de carbonilo puente que unen los centros de cobalto y seis ligandos de carbonilo terminales, tres en cada metal. [5] Se puede resumir mediante la fórmula (CO) 3 Co(μ-CO) 2 Co(CO) 3 y tiene simetría C 2v . Esta estructura se asemeja al nonacarbonilo de dihierro ( Fe 2 (CO) 9 ) pero con un carbonilo puente menos. La distancia Co–Co es 2,52 Å, y las distancias terminal Co–CO y puente Co–CO son 1,80 y 1,90 Å, respectivamente. [8] El análisis del enlace sugiere la ausencia de un enlace directo cobalto-cobalto. [9]
El isómero menor no tiene ligandos de carbonilo puente, sino que tiene un enlace directo entre los centros de cobalto y ocho ligandos de carbonilo terminales, cuatro en cada átomo de metal. [5] Se puede resumir mediante la fórmula (CO) 4 Co-Co(CO) 4 y tiene simetría D 4d . Presenta un enlace cobalto-cobalto sin puente que tiene una longitud de 2,70 Å en la estructura sólida cuando se cristaliza junto con C 60 . [10]
Reacciones
Reducción
El octacarbonilo de dicobalto se escinde por reducción mediante metales alcalinos y reactivos relacionados, como la amalgama de sodio . Las sales resultantes se protonan para dar hidruro de tetracarbonilo y cobalto : [3]
- Co 2 (CO) 8 + 2 Na → 2 Na[Co(CO) 4 ]
- Na[Co(CO) 4 ] + H + → H[Co(CO) 4 ] + Na +
Las sales de esta forma también son intermediarios en la vía de síntesis de cianuro para el octacarbonilo de dicobalto. [7]
Reacciones con electrófilos
Los halógenos y reactivos relacionados rompen el enlace Co-Co para dar halotetracarbonilos pentacoordinados:
- Co 2 (CO) 8 + Br 2 → 2 Br[Co(CO) 4 ]
El nitrosilo de tricarbonilo de cobalto se produce mediante el tratamiento del octacarbonilo de dicobalto con óxido nítrico:
- Co 2 (CO) 8 + 2 NO → 2 Co (CO) 3 NO + 2 CO
Reacciones con alquinos
La reacción de Nicholas es una reacción de sustitución en la que un grupo alcoxi ubicado en el carbono α de un alquino es reemplazado por otro nucleófilo . El alquino reacciona primero con el octacarbonilo de dicobalto, a partir del cual se genera un catión propargílico estabilizado que reacciona con el nucleófilo entrante y luego se forma el producto por desmetalización oxidativa. [11] [12]

La reacción de Pauson-Khand , [13] en la que un alquino , un alqueno y monóxido de carbono se cicla para dar una ciclopentenona , puede ser catalizada por Co 2 (CO) 8 , [3] [14] aunque desde entonces se han desarrollado métodos más nuevos que son más eficientes: [15] [16]

El CO2 ( CO) 8 reacciona con los alquinos para formar un complejo covalente estable, que es útil como grupo protector para el alquino. Este complejo también puede utilizarse en la reacción de Pauson-Khand. [13]
Son posibles las reacciones intramoleculares de Pauson-Khand, en las que el material de partida contiene tanto las fracciones de alqueno como de alquino. En la síntesis asimétrica del alcaloide de Lycopodium huperzina-Q, Takayama y sus colaboradores utilizaron una reacción intramolecular de Pauson-Khand para ciclar un enino que contenía un alcohol primario protegido con terc -butildifenilsililo (TBDPS) . [17] La preparación de la fracción de siloxano cíclico inmediatamente antes de la introducción del dicobalto octacarbonilo garantiza que el producto se forme con la conformación deseada . [18]

El octacarbonilo de dicobalto puede catalizar la trimerización de alquinos de difenilacetileno y sus derivados a hexafenilbencenos . [19] Los difenilacetilenos simétricos forman hexafenilbencenos 6-sustituidos, mientras que los difenilacetilenos asimétricos forman una mezcla de dos isómeros. [20]


Hidroformilación

- El monóxido de carbono se disocia del hidruro de tetracarbonilo de cobalto para formar el catalizador activo, HCo(CO) 3
- Los enlaces π del centro de cobalto se unen al alqueno.
- El ligando alqueno se inserta en el enlace cobalto-hidruro.
- Un ligando carbonilo adicional coordina
- Un ligando carbonilo migra al enlace cobalto-alquilo [21]
- El dihidrógeno se suma al complejo acilo.
- El complejo dihidrido elimina el producto aldehído, [22] regenerando el catalizador.
- Una reacción secundaria improductiva y reversible
La hidrogenación de Co 2 (CO) 8 produce hidruro de tetracarbonilo de cobalto H[Co(CO) 4 ] : [23]
- Co 2 (CO) 8 + H 2 → 2 H[Co(CO) 4 ]
Este hidruro es un catalizador para la hidroformilación , la conversión de alquenos en aldehídos . [4] [23] El ciclo catalítico para esta hidroformilación se muestra en el diagrama. [4] [21] [22]
Reacciones de sustitución
Los ligandos de CO se pueden reemplazar con ligandos de fosfina terciaria para dar Co 2 (CO)−8x (PR 3 ) x . Estos derivados voluminosos son catalizadores más selectivos para las reacciones de hidroformilación.[3]"duras", por ejemplo,la piridina, causandesproporción:
- 12 C 5 H 5 N + 3 Co 2 (CO) 8 → 2 [Co(C 5 H 5 N) 6 ][Co(CO) 4 ] 2 + 8 CO
Conversión a carbonilos superiores

El calentamiento provoca la descarbonilación y la formación de tetracobalto dodecacarbonilo : [3] [24]
- 2 Co 2 (CO) 8 → Co 4 (CO) 12 + 4 CO
Al igual que muchos carbonilos metálicos, el dicobalto octacarbonilo abstrae haluros de haluros de alquilo. Al reaccionar con bromoformo , se convierte en metilidinetricobalto nonacarbonilo , HCCo 3 (CO) 9 , mediante una reacción que puede idealizarse como: [25]
- 9 Co 2 (CO) 8 + 4 CHBr 3 → 4 HCCo 3 (CO) 9 + 36 CO + 6 CoBr 2
Seguridad
El CO2 (CO) 8 es una fuente volátil de cobalto(0), es pirofórico y libera monóxido de carbono al descomponerse. [26] El Instituto Nacional de Seguridad y Salud Ocupacional ha recomendado que los trabajadores no estén expuestos a concentraciones superiores a 0,1 mg/m3 durante un promedio ponderado en el tiempo de ocho horas sin el equipo respiratorio adecuado. [27]
Referencias
- ^ abcde Guía de bolsillo del NIOSH sobre peligros químicos. "#0147". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab Pauson, Peter L .; Stambuli, James P.; Chou, Teh-Chang; Hong, Bor-Cherng (2014). "Octacarbonyldicobalt". Enciclopedia de reactivos para síntesis orgánica . John Wiley & Sons . págs. 1–26. doi :10.1002/047084289X.ro001.pub3. ISBN 9780470842898.
- ^ abcdefgh Donaldson, John Dallas; Beyersmann, Detmar (2005). "Cobalto y compuestos de cobalto". Ullmann's Encyclopedia of Industrial Chemistry . Wiley-VCH. doi :10.1002/14356007.a07_281.pub2. ISBN 3527306730.
- ^ abcdElschenbroich , C.; Salzer, A. (1992). Organometálicos: una introducción concisa (2ª ed.). Weinheim: Wiley-VCH . ISBN 3-527-28165-7.
- ^ abcd Sweany, Ray L.; Brown, Theodore L. (1977). "Espectros infrarrojos de octacarbonilo de dicobalto aislado en matriz. Evidencia del tercer isómero". Química inorgánica . 16 (2): 415–421. doi :10.1021/ic50168a037.
- ^ ab Gilmont, Paul; Blanchard, Arthur A. (1946). Octacarbonilo de dicobalto, nitrosilo tricarbonilo de cobalto e hidruro de tetracarbonilo de cobalto . Síntesis inorgánica. Vol. 2. págs. 238–243. doi :10.1002/9780470132333.ch76. ISBN 9780470132333.
- ^ ab Orchin, Milton (1953). "Hidrogenación de compuestos orgánicos con gas de síntesis". Avances en catálisis . Vol. 5. Academic Press . Págs. 385–415. ISBN. 9780080565095.
- ^ Sumner, G. Gardner; Klug, Harold P.; Alexander, Leroy E. (1964). "La estructura cristalina del octacarbonilo de dicobalto". Acta Crystallographica . 17 (6): 732–742. doi : 10.1107/S0365110X64001803 .
- ^ Green, Jennifer C.; Green, Malcolm LH ; Parkin, Gerard (2012). "La aparición y representación de enlaces de dos electrones con tres centros en compuestos inorgánicos covalentes". Chemical Communications . 2012 (94): 11481–11503. doi :10.1039/c2cc35304k. PMID 23047247.
- ^ Garcia, Thelma Y.; Fettinger, James C.; Olmstead, Marilyn M.; Balch, Alan L. (2009). "Espléndida simetría: Cristalización de un isómero sin puente de Co 2 (CO) 8 en Co 2 (CO) 8 · C 60 ". Chemical Communications . 2009 (46): 7143–7145. doi :10.1039/b915083h. PMID 19921010.
- ^ Nicholas, Kenneth M. (1987). "Química y utilidad sintética de los cationes propargilo complejos con cobalto". Acc. Chem. Res. (Revisión). 20 (6): 207–214. doi :10.1021/ar00138a001.
- ^ Teobald, Barry J. (2002). "La reacción de Nicholas: el uso de cationes propargílicos estabilizados con hexacarbonilo de dicobalto en síntesis". Tetrahedron (Revisión). 58 (21): 4133–4170. doi :10.1016/S0040-4020(02)00315-0.
- ^ ab Pauson, PL ; Khand, IU (1977). "Usos de complejos de cobalto-carbonil acetileno en síntesis orgánica". Ann. NY Acad. Sci. 295 (1): 2–14. Bibcode :1977NYASA.295....2P. doi :10.1111/j.1749-6632.1977.tb41819.x. S2CID 84203764.
- ^ Blanco-Urgoiti, Jaime; Añorbe, Loreto; Pérez-Serrano, Leticia; Domínguez, Gema; Pérez-Castells, Javier (2004). "La reacción de Pauson-Khand, una poderosa herramienta sintética para la síntesis de moléculas complejas". Química. Soc. Apocalipsis 33 (1): 32–42. doi :10.1039/b300976a. PMID 14737507.
- ^ Schore, Neil E. (1991). "La reacción de cicloadición de Pauson-Khand para la síntesis de ciclopentenonas". Org. React. 40 : 1–90. doi :10.1002/0471264180.or040.01. ISBN 0471264180.
- ^ Gibson, Susan E.; Stevenazzi, Andrea (2003). "La reacción de Pauson-Khand: ¡La era catalítica ha llegado!". Angew. Chem. Int. Ed. 42 (16): 1800–1810. doi :10.1002/anie.200200547. PMID 12722067.
- ^ Nakayama, Atsushi; Kogure, Noriyuki; Kitajima, Mariko; Takayama, Hiromitsu (2011). "Síntesis total asimétrica de un alcaloide de licopodio pentacíclico : huperzina-Q". Angélica. Química. Int. Ed. 50 (35): 8025–8028. doi :10.1002/anie.201103550. PMID 21751323.
- ^ Ho, Tse-Lok (2016). "Octacarbonilo de dicobalto". Reactivos de Fiesers para síntesis orgánica . Vol. 28. John Wiley & Sons . págs. 251–252. ISBN. 9781118942819.
- ^ Vij, V.; Bhalla, V.; Kumar, M. (8 de agosto de 2016). "Hexaarilbenceno: evolución de las propiedades y aplicaciones de un andamiaje polivalente". Chemical Reviews . 116 (16): 9565–9627. doi :10.1021/acs.chemrev.6b00144.
- ^ Xiao, W.; Feng, X.; Ruffieux, P.; Gröning, O.; Müllen, K.; Fasel, R. (18 de junio de 2008). "Autoensamblaje de redes moleculares quirales en panal de abeja en Au(111)". Revista de la Sociedad Química Americana . 130 (28): 8910–8912. doi :10.1021/ja7106542.
- ^ ab Heck, Richard F. ; Breslow, David S. (1961). "La reacción del hidrotetracarbonilo de cobalto con olefinas". Revista de la Sociedad Química Americana . 83 (19): 4023–4027. doi :10.1021/ja01480a017.
- ^ ab Halpern, Jack (2001). "Química organometálica en el umbral de un nuevo milenio. Retrospectiva y perspectiva". Química pura y aplicada . 73 (2): 209–220. doi : 10.1351/pac200173020209 .
- ^ ab Pfeffer, M.; Grellier, M. (2007). "Organometálicos de cobalto". Química organometálica integral III . Vol. 7. Elsevier . págs. 1–119. doi :10.1016/B0-08-045047-4/00096-0. ISBN . 9780080450476.
- ^ Chini, P. (1968). "Los grupos carbonílicos metálicos cerrados". Inorganica Chimica Acta Reviews . 2 : 31–51. doi :10.1016/0073-8085(68)80013-0.
- ^ Nestlé, Mara O.; Hallgren, John E.; Seyferth, Dietmar; Dawson, Pedro; Robinson, Brian H. (2007). "μ 3 -Metilidino y μ 3 -Bencilidino-Tris (Tricarbonilcobalto)". Inorg. Sintetizador. 20 : 226–229. doi :10.1002/9780470132517.ch53. ISBN 9780470132517.
- ^ Hoja de datos de seguridad de Cole Parmer
- ^ CDC - Guía de bolsillo de NIOSH sobre peligros químicos