Etano
 Geometría molecular del etano basada en espectroscopia rotacional . | |||
 | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Etano [1] | |||
| Nombre sistemático de la IUPAC Dicarbane (nunca recomendado [2] ) | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 1730716 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.000.741 | ||
| Número CE |
| ||
| 212 | |||
| Malla | Etano | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1035 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| Propiedades | |||
| C2H6 | |||
| Masa molar | 30,070 g·mol −1 | ||
| Apariencia | Gas incoloro | ||
| Olor | Inodoro | ||
| Densidad |
544,0 kg/m 3 (líquido a -88,5 °C) | ||
| Punto de fusión | -182,8 °C; -296,9 °F; 90,4 K | ||
| Punto de ebullición | -88,5 °C; -127,4 °F; 184,6 K | ||
| Punto crítico ( T , P ) | 305,32 K (32,17 °C; 89,91 °F) 48,714 bares (4871,4 kPa) | ||
| 56,8 mg L −1 [4] | |||
| Presión de vapor | 3,8453 MPa (a 21,1 °C) | ||
Constante de la ley de Henry ( k H ) | 19 nmol Pa −1 kg −1 | ||
| Acidez (p K a ) | 50 | ||
| Basicidad (p K b ) | -36 | ||
| Ácido conjugado | Etano | ||
| -37,37·10 −6 cm3 / mol | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 52,14 ± 0,39 JK −1 mol −1 a 298 Kelvin [5] | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −84 kJ mol −1 | ||
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | −1561,0–−1560,4 kJ mol −1 | ||
| Peligros | |||
| Etiquetado SGA : | |||
 | |||
| Peligro | |||
| H220 , H280 | |||
| P210 , P410+P403 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | -135 °C (-211 °F; 138 K) | ||
| 472 °C (882 °F; 745 K) | |||
| Límites de explosividad | 2,9–13% | ||
| Ficha de datos de seguridad (FDS) | es.inchem.org | ||
| Compuestos relacionados | |||
Alcanos relacionados | |||
Compuestos relacionados | |||
| Página de datos complementarios | |||
| Etano (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El etano ( EE . UU .: / ˈɛθeɪn / ETH - ayn , Reino Unido : / ˈiː- / EE- ) es un compuesto químico orgánico natural con fórmula química C
2yo
6A temperatura y presión estándar , el etano es un gas incoloro e inodoro . Como muchos hidrocarburos , el etano se aísla a escala industrial del gas natural y como subproducto petroquímico de la refinación del petróleo . Su principal uso es como materia prima para la producción de etileno . El grupo etilo se deriva formalmente, aunque rara vez en la práctica, del etano.
Historia
El etano fue sintetizado por primera vez en 1834 por Michael Faraday , aplicando la electrólisis de una solución de acetato de potasio . Confundió el hidrocarburo producto de esta reacción con metano y no lo investigó más. [6] El proceso ahora se llama electrólisis de Kolbe :
- CH 3 COO − → CH 3 • + CO 2 + e −
- CH3 • + • CH3 → C2H6
Durante el período 1847-1849, en un esfuerzo por reivindicar la teoría radical de la química orgánica , Hermann Kolbe y Edward Frankland produjeron etano mediante las reducciones de propionitrilo ( cianuro de etilo ) [7] y yoduro de etilo [8] con potasio metálico y , como hizo Faraday, mediante la electrólisis de acetatos acuosos . Confundieron el producto de estas reacciones con el radical metilo ( CH3 ), del cual el etano ( C2H6 ) es un dímero .
Este error fue corregido en 1864 por Carl Schorlemmer , quien demostró que el producto de todas estas reacciones era de hecho etano. [9] El etano fue descubierto disuelto en el petróleo crudo ligero de Pensilvania por Edmund Ronalds en 1864. [10] [11]
Propiedades
A temperatura y presión estándar, el etano es un gas incoloro e inodoro. Tiene un punto de ebullición de -88,5 °C (-127,3 °F) y un punto de fusión de -182,8 °C (-297,0 °F). El etano sólido existe en varias modificaciones. [12] Al enfriarse a presión normal, la primera modificación que aparece es un cristal plástico , que cristaliza en el sistema cúbico. En esta forma, las posiciones de los átomos de hidrógeno no son fijas; las moléculas pueden girar libremente alrededor del eje largo. Al enfriar este etano por debajo de ca. 89,9 K (-183,2 °C; -297,8 °F) se convierte en etano metaestable monoclínico II ( grupo espacial P 21/n). [13] El etano es solo muy escasamente soluble en agua.
Los parámetros de enlace del etano se han medido con alta precisión mediante espectroscopia de microondas y difracción de electrones: r C−C = 1,528(3) Å, r C−H = 1,088(5) Å y ∠CCH = 111,6(5)° por microondas y r C−C = 1,524(3) Å, r C−H = 1,089(5) Å y ∠CCH = 111,9(5)° por difracción de electrones (los números entre paréntesis representan las incertidumbres en los dígitos finales). [14]
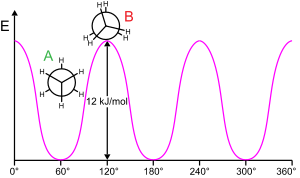
La rotación de una subestructura molecular alrededor de un enlace torcible generalmente requiere energía. La energía mínima para producir una rotación de enlace de 360° se denomina barrera rotacional .
El etano es un ejemplo clásico y simple de una barrera rotacional de este tipo, a veces llamada "barrera del etano". Una de las primeras evidencias experimentales de esta barrera (ver diagrama a la izquierda) se obtuvo modelando la entropía del etano. [16] Los tres hidrógenos en cada extremo son libres de girar alrededor del enlace carbono-carbono central cuando se les proporciona suficiente energía para superar la barrera. El origen físico de la barrera aún no está completamente establecido, [17] aunque la repulsión por superposición (intercambio) [18] entre los átomos de hidrógeno en extremos opuestos de la molécula es quizás el candidato más fuerte, con el efecto estabilizador de la hiperconjugación en la conformación escalonada contribuyendo al fenómeno. [19] Los métodos teóricos que utilizan un punto de partida apropiado (orbitales ortogonales) encuentran que la hiperconjugación es el factor más importante en el origen de la barrera rotacional del etano. [20] [21]
Ya entre 1890 y 1891, los químicos sugirieron que las moléculas de etano preferían la conformación escalonada con los dos extremos de la molécula torcidos entre sí. [22] [23] [24] [25]
Atmosférico y extraterrestre

El etano se encuentra como gas traza en la atmósfera de la Tierra , y actualmente tiene una concentración a nivel del mar de 0,5 ppb . [26] Las cantidades globales de etano han variado con el tiempo, probablemente debido a la quema en los yacimientos de gas natural . [27] Las tasas de emisión global de etano disminuyeron entre 1984 y 2010, [27] aunque el aumento de la producción de gas de esquisto en la Formación Bakken en los EE. UU. ha detenido la disminución a la mitad. [28] [29]
Aunque el etano es un gas de efecto invernadero , es mucho menos abundante que el metano, tiene una vida útil de sólo unos pocos meses en comparación con más de una década, [30] y también es menos eficiente en la absorción de radiación en relación con la masa. De hecho, el potencial de calentamiento global del etano resulta en gran medida de su conversión en metano en la atmósfera. [31] Se ha detectado como un componente traza en las atmósferas de los cuatro planetas gigantes y en la atmósfera de la luna Titán de Saturno . [32]
El etano atmosférico es el resultado de la acción fotoquímica del Sol sobre el gas metano, también presente en estas atmósferas: los fotones ultravioletas de longitudes de onda más cortas que 160 nm pueden fotodisociar la molécula de metano en un radical metilo y un átomo de hidrógeno . Cuando dos radicales metilo se recombinan, el resultado es etano:
- Canal 4 → Canal 3 • + •H
- CH3 • + • CH3 → C2H6
En la atmósfera de la Tierra, los radicales hidroxilo convierten el etano en vapor de metanol con una vida media de alrededor de tres meses. [30]
Se sospecha que el etano producido de esta manera en Titán vuelve a caer sobre la superficie de la luna como lluvia y, con el tiempo, se ha acumulado en mares de hidrocarburos que cubren gran parte de las regiones polares de la luna. A mediados de 2005, la sonda Cassini descubrió el lago Ontario en las regiones polares del sur de Titán. Un análisis posterior de los datos espectroscópicos infrarrojos presentados en julio de 2008 [33] proporcionó evidencia adicional de la presencia de etano líquido en el lago Ontario. Varios lagos de hidrocarburos significativamente más grandes, siendo Ligeia Mare y Kraken Mare los dos más grandes, fueron descubiertos cerca del polo norte de Titán utilizando datos de radar recopilados por Cassini. Se cree que estos lagos están llenos principalmente de una mezcla de etano líquido y metano.
En 1996, se detectó etano en el cometa Hyakutake [ 34] y desde entonces se ha detectado en otros cometas . La existencia de etano en estos cuerpos distantes del sistema solar puede implicar que el etano es un componente primordial de la nebulosa solar a partir de la cual se cree que se formaron el Sol y los planetas.
En 2006, Dale Cruikshank del Centro de Investigación Ames de la NASA ( coinvestigador de New Horizons ) y sus colegas anunciaron el descubrimiento espectroscópico de etano en la superficie de Plutón . [35]
Química
Las reacciones del etano implican principalmente reacciones de radicales libres . El etano puede reaccionar con los halógenos , especialmente el cloro y el bromo , mediante halogenación por radicales libres . Esta reacción se produce mediante la propagación del radical etilo : [36]
- Cl2 → 2Cl•
- C2H6 • +Cl • → C2H5 • + HCl
- C2H5 • + Cl2 → C2H5Cl + Cl •
- Cl • + C2H6 → C2H5 • + HCl
La combustión del etano libera 1559,7 kJ/mol, o 51,9 kJ/g, de calor y produce dióxido de carbono y agua según la ecuación química :
La combustión también puede ocurrir sin un exceso de oxígeno, lo que produce monóxido de carbono , acetaldehído , metano , metanol y etanol . A temperaturas más altas, especialmente en el rango de 600 a 900 °C (1112 a 1652 °F), el etileno es un producto importante:
- 2C2H6 + O2 → 2C2H4 + H2O
Estas reacciones de deshidrogenación oxidativa son relevantes para la producción de etileno . [37]
Producción
Después del metano , el etano es el segundo componente más importante del gas natural . El gas natural de diferentes yacimientos de gas varía en contenido de etano desde menos del 1% hasta más del 6% en volumen. Antes de la década de 1960, el etano y las moléculas más grandes normalmente no se separaban del componente metano del gas natural, sino que simplemente se quemaban junto con el metano como combustible. Hoy en día, el etano es una materia prima petroquímica importante y se separa de los demás componentes del gas natural en la mayoría de los yacimientos de gas bien desarrollados. El etano también se puede separar del gas de petróleo , una mezcla de hidrocarburos gaseosos producidos como subproducto de la refinación del petróleo .
El etano se separa del metano de forma más eficiente licuándolo a temperaturas criogénicas. Existen varias estrategias de refrigeración: el proceso más económico que se utiliza actualmente emplea un turboexpansor y puede recuperar más del 90% del etano del gas natural. En este proceso, el gas enfriado se expande a través de una turbina , lo que reduce la temperatura a aproximadamente -100 °C (-148 °F). A esta baja temperatura, el metano gaseoso se puede separar del etano licuado y de los hidrocarburos más pesados mediante destilación . Luego, una destilación adicional separa el etano del propano y de los hidrocarburos más pesados.
Uso
El principal uso del etano es la producción de etileno (eteno) mediante craqueo con vapor . El craqueo con vapor del etano es bastante selectivo para el etileno, mientras que el craqueo con vapor de hidrocarburos más pesados produce una mezcla de productos más pobre en etileno y más rica en alquenos más pesados (olefinas) , como el propeno (propileno) y el butadieno , y en hidrocarburos aromáticos .
El ehane se ha investigado como materia prima para otros productos químicos básicos. La cloración oxidativa del etano parece ser desde hace tiempo una ruta potencialmente más económica para obtener cloruro de vinilo que la cloración del etileno. Existen muchas patentes sobre este tema, pero la escasa selectividad para el cloruro de vinilo y las condiciones de reacción corrosivas han desalentado la comercialización de la mayoría de ellas. En la actualidad, INEOS opera una planta piloto de 1000 t/a ( toneladas por año ) de etano a cloruro de vinilo en Wilhelmshaven , Alemania .
SABIC opera una planta de 34.000 t/a en Yanbu para producir ácido acético mediante oxidación de etano. [38] La viabilidad económica de este proceso puede depender del bajo costo del etano cerca de los campos petrolíferos sauditas, y puede no ser competitivo con la carbonilación de metanol en otras partes del mundo. [39]
El etano se puede utilizar como refrigerante en sistemas de refrigeración criogénica.
En el laboratorio
En una escala mucho menor, en la investigación científica, el etano líquido se utiliza para vitrificar muestras ricas en agua para la criomicroscopía electrónica . Una película fina de agua sumergida rápidamente en etano líquido a -150 °C o menos se congela demasiado rápido para que el agua cristalice. Los métodos de congelación más lentos pueden generar cristales de hielo cúbicos, que pueden alterar las estructuras blandas dañando las muestras y reducir la calidad de la imagen dispersando el haz de electrones antes de que pueda llegar al detector.
Salud y seguridad
A temperatura ambiente, el etano es un gas extremadamente inflamable. Cuando se mezcla con aire en una proporción de entre el 3,0 % y el 12,5 % en volumen, forma una mezcla explosiva .
El etano no es cancerígeno . [40]
Véase también
- Biogás : una alternativa al gas natural sin emisiones de carbono
- Biorrefinación
- Plástico biodegradable
- Bioplástico de aplicación directa
Referencias
- ^ Unión Internacional de Química Pura y Aplicada (2014). Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013. The Royal Society of Chemistry . pág. 133. doi :10.1039/9781849733069. ISBN . 978-0-85404-182-4
Los hidrocarburos acíclicos saturados no ramificados C
2
H
6, C
3
H
8
y C
4
H
10 tienen los nombres conservados de
etano
, propano y butano, respectivamente.
- ^ IUPAC 2014, p. 4. "De manera similar, los nombres conservados 'etano', 'propano' y 'butano' nunca fueron reemplazados por los nombres sistemáticos 'dicarbano', 'tricarbano' y 'tetracarbano', como se recomienda para los análogos del silano, 'disilano'; el fosfano, 'trifosfano'; y el sulfano, 'tetrasulfano'".
- ^ "Etano: resumen de compuestos". PubChem Compound . EE. UU.: Centro Nacional de Información Biotecnológica. 16 de septiembre de 2004. Consultado el 7 de diciembre de 2011 .
- ^ Lide, DR, ed. (2005). Manual de química y física del CRC (86.ª edición). Boca Raton (FL): CRC Press. pág. 8.88. ISBN 0-8493-0486-5.
- ^ "Etano". webbook.nist.gov . Instituto Nacional de Estándares y Tecnología . Consultado el 16 de mayo de 2024 .
- ^ Faraday, Michael (1834). "Investigaciones experimentales en electricidad: Séptima serie". Philosophical Transactions . 124 : 77–122. Código Bibliográfico :1834RSPT..124...77F. doi :10.1098/rstl.1834.0008. S2CID 116224057.
- ^ Kolbe, Hermann; Frankland, Edward (1849). "Sobre los productos de la acción del potasio sobre el cianuro de etilo". Journal of the Chemical Society . 1 : 60–74. doi :10.1039/QJ8490100060.
- ^ Frankland, Edward (1850). "Sobre el aislamiento de los radicales orgánicos". Journal of the Chemical Society . 2 (3): 263–296. doi :10.1039/QJ8500200263.
- ^ Schorlemmer, Carl (1864). "Ueber die Identität des Aethylwasserstoffs und des Mmethyls". Annalen der Chemie und Pharmacie . 132 (2): 234–238. doi :10.1002/jlac.18641320217.
- ^ Roscoe, HE; Schorlemmer, C. (1881). Tratado de química . Vol. 3. Macmillan. págs. 144-145.
- ^ Watts, H. (1868). Diccionario de química . Vol. 4. pág. 385.
- ^ Van Nes, GJH; Vos, A. (1978). "Estructuras monocristalinas y distribuciones de densidad electrónica de etano, etileno y acetileno. I. Determinaciones de la estructura monocristalina por rayos X de dos modificaciones de etano" (PDF) . Acta Crystallographica Sección B . 34 (6): 1947. Bibcode :1978AcCrB..34.1947V. doi :10.1107/S0567740878007037. S2CID 55183235.
- ^ "El etano como sólido" . Consultado el 10 de diciembre de 2019 .
- ^ Harmony, Marlin D. (15 de noviembre de 1990). "Longitud de enlace simple carbono-carbono en equilibrio en etano". The Journal of Chemical Physics . 93 (10): 7522–7523. Bibcode :1990JChPh..93.7522H. doi :10.1063/1.459380. ISSN 0021-9606.
- ^ J, McMurry (2012). Química orgánica (8.ª ed.). Belmont, CA: Brooks. pág. 95. ISBN 9780840054449.
- ^ Kemp, JD; Pitzer, Kenneth S. (1937). "La entropía del etano y la tercera ley de la termodinámica. Rotación impedida de grupos metilo". Revista de la Sociedad Química Americana . 59 (2): 276. doi :10.1021/ja01281a014.
- ^ Ercolani, G. (2005). "Determinación de la barrera rotacional en etano mediante espectroscopia vibracional y termodinámica estadística". J. Chem. Educ . 82 (11): 1703–1708. Bibcode :2005JChEd..82.1703E. doi :10.1021/ed082p1703.
- ^ Pitzer, RM (1983). "La barrera a la rotación interna en el etano". Acc. Chem. Res . 16 (6): 207–210. doi :10.1021/ar00090a004.
- ^ Mo, Y.; Wu, W.; Song, L.; Lin, M.; Zhang, Q.; Gao, J. (2004). "La magnitud de la hiperconjugación en etano: una perspectiva desde la teoría del enlace de valencia ab initio". Angew. Chem. Int. Ed . 43 (15): 1986–1990. doi :10.1002/anie.200352931. PMID 15065281.
- ^ Pophristic, V.; Goodman, L. (2001). "La hiperconjugación, no la repulsión estérica, conduce a la estructura escalonada del etano". Nature . 411 (6837): 565–8. Bibcode :2001Natur.411..565P. doi :10.1038/35079036. PMID 11385566. S2CID 205017635.
- ^ Schreiner, PR (2002). "Enseñar las razones correctas: lecciones del origen erróneo de la barrera rotacional en el etano". Angewandte Chemie International Edition . 41 (19): 3579–81, 3513. doi :10.1002/1521-3773(20021004)41:19<3579::AID-ANIE3579>3.0.CO;2-S. PMID 12370897.
- ^ Bischoff, California (1890). "Ueber die Aufhebung der freien Drehbarkeit von einfach verbundenen Kohlenstoffatomen". Química. Ber . 23 : 623. doi : 10.1002/cber.18900230197.
- ^ Bischoff, California (1891). "Theoretische Ergebnisse der Studien in der Bernsteinsäuregruppe". Química. Ber . 24 : 1074-1085. doi :10.1002/cber.189102401195.
- ^ Bischoff, California (1891). "Die dynamische Hypothese in ihrer Anwendung auf die Bernsteinsäuregruppe". Química. Ber . 24 : 1085-1095. doi :10.1002/cber.189102401196.
- ^ Bischoff, California; Walden, P. (1893). "Die Anwendung der dynamischen Hypothese auf Ketonsäurederivate". Berichte der Deutschen Chemischen Gesellschaft . 26 (2): 1452. doi : 10.1002/cber.18930260254.
- ^ "Trace gases (archivado)". Atmosphere.mpg.de . Archivado desde el original el 22 de diciembre de 2008. Consultado el 8 de diciembre de 2011 .
- ^ ab Simpson, Isobel J.; Sulbaek Andersen, Mads P.; Meinardi, Simone; Bruhwiler, Lori; Blake, Nicola J.; Helmig, Detlev; Rowland, F. Sherwood; Blake, Donald R. (2012). "Disminución a largo plazo de las concentraciones atmosféricas globales de etano e implicaciones para el metano". Nature . 488 (7412): 490–494. Bibcode :2012Natur.488..490S. doi :10.1038/nature11342. PMID 22914166. S2CID 4373714.
- ^ Kort, EA; Smith, ML; Murray, LT; Gvakharia, A.; Brandt, AR; Peischl, J.; Ryerson, TB; Sweeney, C.; Travis, K. (2016). "Las emisiones fugitivas de la lutita de Bakken ilustran el papel de la producción de lutita en el cambio global del etano". Geophysical Research Letters . 43 (9): 4617–4623. Bibcode :2016GeoRL..43.4617K. doi : 10.1002/2016GL068703 . hdl : 2027.42/142509 .
- ^ "Un yacimiento petrolífero, culpable clave del aumento global del gas etano". Universidad de Michigan. 26 de abril de 2016.
- ^ ab Aydin, Kamil Murat; Williams, MB; Saltzman, ES (abril de 2007). "Viabilidad de reconstruir registros paleoatmosféricos de alcanos seleccionados, haluros de metilo y gases de azufre de núcleos de hielo de Groenlandia". Journal of Geophysical Research . 112 (D7). Código Bibliográfico :2007JGRD..112.7312A. doi :10.1029/2006JD008027.
- ^ Hodnebrog, Øivind; Dalsøren, Stig B.; Myrhe, Gunnar (2018). "Tiempos de vida, forzamiento radiativo directo e indirecto y potenciales de calentamiento global del etano (C2H6), el propano (C3H8) y el butano (C4H10)". Atmospheric Science Letters . 19 (2). Código Bibliográfico :2018AtScL..19E.804H. doi : 10.1002/asl.804 .
- ^ Brown, Bob; et al. (2008). "La NASA confirma la presencia de un lago líquido en la luna de Saturno". Laboratorio de Propulsión a Chorro de la NASA. Archivado desde el original el 5 de junio de 2011. Consultado el 30 de julio de 2008 .
- ^ Marrón, derecha; Soderblom, Luisiana; Soderblom, JM; Clark, enfermera registrada; Jaumann, R.; Barnes, JW; Sotin, C.; Buratti, B.; et al. (2008). "La identificación de etano líquido en Ontario Lacus de Titán". Naturaleza . 454 (7204): 607–10. Código Bib :2008Natur.454..607B. doi : 10.1038/naturaleza07100. PMID 18668101. S2CID 4398324.
- ^ Mumma, Michael J.; et al. (1996). "Detección de abundante etano y metano, junto con monóxido de carbono y agua, en el cometa C/1996 B2 Hyakutake: evidencia de origen interestelar". Science . 272 (5266): 1310–1314. Bibcode :1996Sci...272.1310M. doi :10.1126/science.272.5266.1310. PMID 8650540. S2CID 27362518.
- ^ Stern, A. (1 de noviembre de 2006). "Making Old Horizons New". La perspectiva del investigador principal . Laboratorio de Física Aplicada de la Universidad Johns Hopkins. Archivado desde el original el 28 de agosto de 2008. Consultado el 12 de febrero de 2007 .
- ^ Dreher, Eberhard-Ludwig; Torkelson, Theodore R.; Beutel, Klaus K. (2011). "Cloretanos y Cloroetilenos". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.o06_o01. ISBN 978-3-527-30385-4.
- ^ Najari, Sara; Saeidi, Samrand; Concepcion, Patricia; Dionysiou, Dionysios D.; Bhargava, Suresh K.; Lee, Adam F.; Wilson, Karen (2021). "Deshidrogenación oxidativa del etano: aspectos catalíticos y mecanísticos y tendencias futuras". Chemical Society Reviews . 50 (7): 4564–4605. doi :10.1039/D0CS01518K. PMID 33595011. S2CID 231946397.
- ^ Ramkumar, KS (26 de mayo de 2005). "La planta de ácido acético de SABIC entra en funcionamiento". Arab News . Archivado desde el original el 9 de junio de 2013. Consultado el 4 de julio de 2024 .
- ^ Cavani, Fabricio; Ballarini, Nicola (2009). Mizuno, Noritaka (ed.). Catálisis de oxidación heterogénea moderna. Wiley. pag. 291.ISBN 978-3-527-62755-4. Recuperado el 4 de julio de 2024 .
- ^ Vallero, Daniel (7 de junio de 2010). "Factores de la pendiente del cáncer". Biotecnología ambiental: un enfoque de biosistemas . Academic Press. p. 641. doi :10.1016/B978-0-12-375089-1.10014-5. ISBN 9780123750891.
Enlaces externos
- Ficha internacional de seguridad química 0266
- Evolución impulsada por el mercado de las tecnologías de procesamiento de gas para LGN
- Etano escalonado y eclipsado






