Célula madre mesenquimal
| Célula madre mesenquimal | |
|---|---|
 Micrografía electrónica de transmisión de una célula madre mesenquimal que muestra características ultraestructurales típicas . | |
| Detalles | |
| Identificadores | |
| latín | célula mesenquimática previa |
| Malla | D059630 |
| El | H2.00.01.0.00008 |
| Términos anatómicos de microanatomía [editar en Wikidata] | |
Las células madre mesenquimales ( MSC ), también conocidas como células estromales mesenquimales o células de señalización medicinal , son células estromales multipotentes que pueden diferenciarse en una variedad de tipos de células, incluidos osteoblastos (células óseas), condrocitos (células del cartílago), miocitos (células musculares) y adipocitos (células grasas que dan lugar al tejido adiposo de la médula ósea ). [1] [2] [3] [4]
Estructura
Definición
Las células madre mesenquimales (MSC), término acuñado por primera vez (1991) por Arnold I. Caplan en la Universidad Case Western Reserve [5] , se caracterizan morfológicamente por un cuerpo celular pequeño con unos pocos procesos celulares que son largos y delgados. Si bien los términos célula madre mesenquimal (MSC) y célula del estroma medular se han utilizado indistintamente durante muchos años, ninguno de ellos es lo suficientemente descriptivo:
- El mesénquima es tejido conectivo embrionario que se deriva del mesodermo y que se diferencia en tejido hematopoyético y conectivo, mientras que las MSC no se diferencian en células hematopoyéticas. [6]
- Las células del estroma son células del tejido conectivo que forman la estructura de sostén en la que residen las células funcionales del tejido. Si bien esta es una descripción precisa de una función de las MSC, el término no refleja las funciones relativamente recientes descubiertas de las MSC en la reparación de tejidos. [7]
- El término abarca células multipotentes derivadas de otros tejidos no medulares , como la placenta , [8] la sangre del cordón umbilical , el tejido adiposo , el músculo adulto , el estroma corneal [9] o la pulpa dental de los dientes deciduos (de leche). [10] Las células no tienen la capacidad de reconstituir un órgano entero.
Morfología
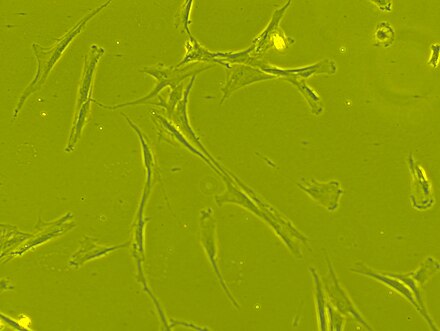

El cuerpo celular contiene un núcleo grande y redondo con un nucléolo prominente , que está rodeado de partículas de cromatina finamente dispersas, lo que le da al núcleo una apariencia clara. El resto del cuerpo celular contiene una pequeña cantidad de aparato de Golgi , retículo endoplasmático rugoso , mitocondrias y polirribosomas . Las células, que son largas y delgadas, están ampliamente dispersas y la matriz extracelular adyacente está poblada por unas pocas fibrillas reticulares , pero está desprovista de los otros tipos de fibrillas de colágeno . [11] [12] Estas características morfológicas distintivas de las células madre mesenquimales se pueden visualizar sin etiquetas utilizando imágenes de células vivas.
Clasificación
La Sociedad Internacional de Terapia Celular (ISCT) ha propuesto un conjunto de estándares para definir las MSC. Una célula puede clasificarse como MSC si muestra propiedades adherentes plásticas en condiciones normales de cultivo y tiene una morfología similar a la de los fibroblastos. De hecho, algunos sostienen que las MSC y los fibroblastos son funcionalmente idénticos. [13] El estudio en Science, "Potencial multilinaje de las células madre mesenquimales adultas", describe cómo las MSC pueden experimentar diferenciación osteogénica, adipogénica y condrogénica ex vivo . A noviembre de 2023, este artículo ha sido citado más de 29.000 veces. Las MSC cultivadas también expresan en su superficie CD73 , CD90 y CD105 , mientras que carecen de la expresión de los marcadores de superficie CD11b , CD14 , CD19 , CD34 , CD45 , CD79a y HLA-DR . [14]
Ubicación en el cuerpo
Las MSC se encuentran en todo el cuerpo humano.
Médula ósea
La médula ósea fue la fuente original de células madre medulares [15] y sigue siendo la fuente más utilizada. Estas células madre de la médula ósea no contribuyen a la formación de células sanguíneas y, por lo tanto, no expresan el marcador de células madre hematopoyéticas CD34 . A veces se las denomina células madre estromales de la médula ósea [16] .
Células del cordón
Las células madre hematopoyéticas más jóvenes y primitivas pueden obtenerse a partir del tejido del cordón umbilical, es decir, de la gelatina de Wharton y de la sangre del cordón umbilical . Sin embargo, las células madre hematopoyéticas se encuentran en concentraciones mucho más altas en la gelatina de Wharton en comparación con la sangre del cordón, que es una fuente rica de células madre hematopoyéticas . El cordón umbilical está disponible después del nacimiento. Normalmente se desecha y no supone ningún riesgo para su recolección. Estas células madre hematopoyéticas pueden resultar una fuente útil de células madre hematopoyéticas para aplicaciones clínicas, debido a sus propiedades primitivas y su rápida tasa de crecimiento. [17]
Tejido adiposo
Las MSC derivadas del tejido adiposo (AdMSC), además de ser más fáciles y seguras de aislar que las MSC derivadas de la médula ósea, se pueden obtener en mayores cantidades. [15] [18]
Células molares
El brote dentario en desarrollo del tercer molar mandibular es una rica fuente de células madre mesenquimales. Si bien se las describe como multipotentes, es posible que sean pluripotentes. Con el tiempo, forman esmalte, dentina, vasos sanguíneos, pulpa dental y tejido nervioso. Estas células madre son capaces de diferenciarse en condrocitos , cardiomiocitos , melanocitos y células similares a los hepatocitos in vitro . [10]
Líquido amniótico
Las células madre están presentes en el líquido amniótico . Hasta 1 de cada 100 células recolectadas durante la amniocentesis son células madre mesenquimales pluripotentes. [19]
Función
Capacidad de diferenciación
Las MSC tienen una gran capacidad de autorrenovación manteniendo su multipotencia. Trabajos recientes sugieren que la β-catenina, a través de la regulación de EZH2, es una molécula central en el mantenimiento de la "propiedad" de las MSC. [20] La prueba estándar para confirmar la multipotencia es la diferenciación de las células en osteoblastos, adipocitos y condrocitos, así como en miocitos.
Se ha observado que las MSC incluso se diferencian en células similares a neuronas, [21] pero aún hay dudas sobre si las neuronas derivadas de MSC son funcionales. [22] El grado en que el cultivo se diferenciará varía entre individuos y cómo se induce la diferenciación, por ejemplo, química o mecánica; [23] y no está claro si esta variación se debe a una cantidad diferente de células progenitoras "verdaderas" en el cultivo o a capacidades de diferenciación variables de los progenitores de los individuos. Se sabe que la capacidad de las células para proliferar y diferenciarse disminuye con la edad del donante, así como con el tiempo en el cultivo. [24] Asimismo, no se sabe si esto se debe a una disminución en el número de MSC o a un cambio en las MSC existentes. [ cita requerida ]
Efectos inmunomoduladores
Las MSC tienen un efecto sobre las células inmunes innatas y específicas, y la investigación ha demostrado una capacidad para suprimir el crecimiento tumoral. [25] Las MSC producen muchas moléculas inmunomoduladoras, incluidas la prostaglandina E2 (PGE2), [26] óxido nítrico , [27] indolamina 2,3-dioxigenasa (IDO), interleucina 6 (IL-6) y otros marcadores de superficie como FasL , [28] PD-L1 y PD-L2 . [29]
Las MSC tienen un efecto sobre los macrófagos, neutrófilos, células NK, mastocitos y células dendríticas en la inmunidad innata. Las MSC pueden migrar al sitio de la lesión, donde se polarizan a través de los macrófagos PGE2 en el fenotipo M2 que se caracteriza por un efecto antiinflamatorio. [30] Además, PGE2 inhibe la capacidad de los mastocitos para desgranularse y producir TNF-α. [31] [32] La proliferación y la actividad citotóxica de las células NK son inhibidas por PGE2 e IDO. Las MSC también reducen la expresión de los receptores de células NK: NKG2D, NKp44 y NKp30. [33] Las MSC inhiben el brote respiratorio y la apoptosis de los neutrófilos mediante la producción de citocinas IL-6 e IL-8. [34] La diferenciación y expresión de los marcadores de superficie de las células dendríticas es inhibida por IL-6 y PGE2 de las MSC. [35] Los efectos inmunosupresores de las MSC también dependen de IL-10, pero no se sabe con certeza si la producen solas o solo estimulan a otras células a producirla. [36]
Las MSC expresan las moléculas de adhesión VCAM-1 e ICAM-1, que permiten que los linfocitos T se adhieran a su superficie. Luego, las MSC pueden afectarlos mediante moléculas que tienen una vida media corta y su efecto está en la vecindad inmediata de la célula. [27] Estas incluyen óxido nítrico, [37] PGE2, HGF, [38] y la activación del receptor PD-1. [39] Las MSC reducen la proliferación de células T entre las fases G0 y G1 del ciclo celular [40] y disminuyen la expresión de IFNγ de las células Th1 mientras aumentan la expresión de IL-4 de las células Th2. [41] Las MSC también inhiben la proliferación de linfocitos B entre las fases G0 y G1 del ciclo celular. [39] [42]
Propiedades antimicrobianas
Las MSC producen varios péptidos antimicrobianos (AMP), entre ellos la catelicidina LL-37 humana , [43] β-defensinas , [44] lipocalina 2 [45] y hepcidina . [46] Estos péptidos, junto con la enzima indolamina 2,3-dioxigenasa (IDO), son responsables de la actividad antibacteriana de amplio espectro de las MSC. [47]
Importancia clínica

Las células madre mesenquimales pueden activarse y movilizarse en reacción a una lesión o infección. A partir de mayo de 2024, una búsqueda de "células madre mesenquimales" o "células estromales mesenquimales" en ClinicalTrials.gov arroja más de 1760 estudios que incluyen células madre mesenquimales [48] para más de 920 afecciones.
Enfermedad autoinmune
Estudios clínicos que investigan la eficacia de las células madre mesenquimales en el tratamiento de enfermedades están en desarrollo clínico en todo el mundo, particularmente en el tratamiento de enfermedades autoinmunes , enfermedad de injerto contra huésped , enfermedad de Crohn , esclerosis múltiple , lupus eritematoso sistémico y esclerosis sistémica . [49] [50]
Otras enfermedades
Muchos de los primeros éxitos clínicos obtenidos con el trasplante intravenoso se produjeron en enfermedades sistémicas como la enfermedad de injerto contra huésped y la sepsis . La inyección directa o la colocación de células en un sitio que necesita reparación puede ser el método de tratamiento preferido, ya que la administración vascular sufre un " efecto de primer paso pulmonar ", en el que las células inyectadas por vía intravenosa quedan secuestradas en los pulmones. [51]
Estudios adicionales sobre los mecanismos de acción de las MSC pueden proporcionar vías para aumentar su capacidad de reparación de tejidos. [52] [53]
Investigación
La mayoría de las técnicas de cultivo modernas todavía adoptan un enfoque de fibroblastos de unidad formadora de colonias (UFC-F), donde las células mononucleares de médula ósea crudas sin purificar o purificadas con Ficoll se siembran directamente en placas o matraces de cultivo celular . Las células madre mesenquimales, pero no los glóbulos rojos ni los progenitores hematopoyéticos, se adhieren al plástico de cultivo de tejidos en un plazo de 24 a 48 horas. Sin embargo, al menos una publicación ha identificado una población de MSC no adherentes que no se obtienen mediante la técnica de siembra directa. [54]
Otros métodos basados en la citometría de flujo permiten clasificar las células de la médula ósea en función de marcadores de superficie específicos, como STRO-1 . [55] Las células STRO-1+ son generalmente más homogéneas y tienen mayores tasas de adherencia y de proliferación, pero las diferencias exactas entre las células STRO-1+ y las MSC no están claras. [56]
También se han utilizado métodos de inmunodepleción que utilizan técnicas como MACS en la selección negativa de MSC. [57]
La suplementación de medios basales con suero bovino fetal o lisado de plaquetas humanas es común en el cultivo de MSC. Antes del uso de lisados de plaquetas para el cultivo de MSC, se recomienda el proceso de inactivación de patógenos para prevenir la transmisión de patógenos. [58]
Una nueva investigación titulada El trasplante de esferoides de células madre mesenquimales derivadas de células madre humanas mejora la osteoartritis espontánea en macacos rhesus [59] . Se han utilizado varios productos químicos y métodos, incluida la irradiación láser de baja intensidad, para aumentar la proliferación de células madre. [60]
Historia
Los científicos Ernest A. McCulloch y James E. Till revelaron por primera vez la naturaleza clonal de las células de la médula ósea en la década de 1960. [61] [62] En 1970, Arnold Caplan identificó ciertas condiciones por las cuales las células mesodérmicas se diferencian en cartílago o tejido miogénico (muscular) y hueso. [63]
Más tarde, en la década de 1970, Friedenstein y sus colegas informaron sobre un ensayo ex vivo para examinar el potencial clonogénico de células de médula ósea multipotentes. [64] [65] En este sistema de ensayo, las células del estroma se denominaban unidades formadoras de colonias-fibroblastos (UFC-f).
Experimentos posteriores revelaron la plasticidad de las células de la médula ósea y cómo su destino está determinado por señales ambientales. El cultivo de células del estroma de la médula ósea en presencia de estímulos osteogénicos como el ácido ascórbico , el fosfato inorgánico y la dexametasona podría promover su diferenciación en osteoblastos . Por el contrario, la adición del factor de crecimiento transformante beta (TGF-b) podría inducir marcadores condrogénicos . [ cita requerida ]
Los primeros ensayos clínicos de MSC fueron completados por Osiris Therapeutics en 1995, cuando a un grupo de 15 pacientes se les inyectó MSC cultivadas para probar la seguridad del tratamiento. [66] Las primeras aprobaciones regulatorias para MSC se otorgaron de manera condicional en 2012 en Canadá y Nueva Zelanda para el tratamiento de la enfermedad de injerto contra huésped (EICH) y, posteriormente, en Japón para el tratamiento de la fístula relacionada con la enfermedad de Crohn. [67]
Desde entonces, se han realizado más de 1.000 ensayos clínicos para tratar numerosas enfermedades. [68]
Controversias
Durante años se ha debatido el término "células madre mesenquimales" y cuál es el significado más correcto desde el punto de vista científico de las siglas MSC. La mayoría de las preparaciones de células mesenquimales o "MSC" solo contienen una fracción minoritaria de células madre multipotentes verdaderas, y la mayoría de las células son de naturaleza estromal. Caplan propuso reformular el término MSC para enfatizar su papel como "células de señalización medicinal". [69] Dentro del campo de las células madre, la abreviatura "MSC" se ha utilizado más comúnmente para referirse a "células madre/estromales mesenquimales" debido a la naturaleza heterogénea de las preparaciones celulares.
También existe una creciente preocupación por la comercialización y aplicación de células madre mesenquimales y MSC no aprobadas que carecen de datos rigurosos para respaldar estos usos clínicos en pacientes por parte de clínicas con fines de lucro. [70] [71]
Véase también
- Médula ósea
- Fibroblast
- Osificación intramembranosa
- Mesénquima
- Multipotencia
- Forro de cordón
- Tejido adiposo medular (MAT)
- Lista de tipos de células humanas derivadas de las capas germinales
Referencias
- ^ Tonk CH, Witzler M, Schulze M, Tobiasch E (2020). "Células madre mesenquimales". En Brand-Saberi B (ed.). Conceptos actuales esenciales en biología de células madre . Materiales de aprendizaje en biociencias. Cham: Springer International Publishing. págs. 21–39. doi :10.1007/978-3-030-33923-4_2. ISBN 978-3-030-33923-4.S2CID214523766 .
- ^ Ankrum JA, Ong JF, Karp JM (marzo de 2014). "Células madre mesenquimales: inmunoevasivas, no inmunoprivilegiadas". Nature Biotechnology . 32 (3): 252–60. doi :10.1038/nbt.2816. PMC 4320647 . PMID 24561556.
- ^ Mahla RS (2016). "Aplicaciones de células madre en medicina regenerativa y terapias de enfermedades". Revista internacional de biología celular . 2016 : 6940283. doi : 10.1155/2016/6940283 . PMC 4969512. PMID 27516776 .
- ^ Caplan AI (junio de 2017). "Células madre mesenquimales: ¡es hora de cambiar el nombre!". Stem Cells Translational Medicine . 6 (6): 1445–1451. doi :10.1002/sctm.17-0051. PMC 5689741 . PMID 28452204.
- ^ Bianco P, Robey PG, Simmons PJ (abril de 2008). "Células madre mesenquimales: revisión de la historia, conceptos y ensayos". Cell Stem Cell . 2 (4): 313–319. doi :10.1016/j.stem.2008.03.002. PMC 2613570 . PMID 18397751.
- ^ Porcellini A (2009). "Medicina regenerativa: una revisión". Revista Brasileira de Hematología y Hemoterapia . 31 (Suplemento 2). doi : 10.1590/S1516-84842009000800017 .
- ^ Valero MC, Huntsman HD, Liu J, Zou K, Boppart MD (2012). "El ejercicio excéntrico facilita la aparición de células madre mesenquimales en el músculo esquelético". PLOS ONE . 7 (1): e29760. Bibcode :2012PLoSO...729760V. doi : 10.1371/journal.pone.0029760 . PMC 3256189 . PMID 22253772.
- ^ Wang S, Qu X, Zhao RC (abril de 2012). "Aplicaciones clínicas de células madre mesenquimales". Journal of Hematology & Oncology . 5 : 19. doi : 10.1186/1756-8722-5-19 . PMC 3416655 . PMID 22546280.
- ^ Branch MJ, Hashmani K, Dhillon P, Jones DR, Dua HS, Hopkinson A (agosto de 2012). "Células madre mesenquimales en el estroma limbar corneal humano". Oftalmología investigativa y ciencia visual . 53 (9): 5109–16. doi :10.1167/iovs.11-8673. PMID 22736610.
- ^ ab Liu J, Yu F, Sun Y, Jiang B, Zhang W, Yang J, Xu G, Liang A, Liu S (marzo de 2015). "Reseñas concisas: características y posibles aplicaciones de las células madre mesenquimales derivadas del tejido dental humano". Células madre . 33 (3): 627–38. doi : 10.1002/stem.1909 . PMID 25447379.
- ^ Netter FH (1987). Sistema musculoesquelético: anatomía, fisiología y trastornos metabólicos . Summit, Nueva Jersey: Ciba-Geigy Corporation. pág. 134. ISBN 978-0-914168-88-1.
- ^ Brighton CT, Hunt RM (julio de 1991). "Cambios histológicos y ultraestructurales tempranos en el callo de fractura medular". The Journal of Bone and Joint Surgery. American Volumen . 73 (6): 832–847. doi :10.2106/00004623-199173060-00006. PMID 2071617.
- ^ Hematti P (mayo de 2012). "Células estromales mesenquimales y fibroblastos: ¿un caso de identidad equivocada?". Citoterapia . 14 (5): 516–21. doi :10.3109/14653249.2012.677822. PMID 22458957.
- ^ Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini F, Krause D, et al. (1 de enero de 2006). "Criterios mínimos para definir células estromales mesenquimales multipotentes. Declaración de posición de la Sociedad Internacional de Terapia Celular". Citoterapia . 8 (4): 315–7. doi :10.1080/14653240600855905. PMID 16923606.
- ^ ab Strioga M, Viswanathan S, Darinskas A, Slaby O, Michalek J (septiembre de 2012). "¿Igual o no igual? Comparación de células madre y estromales mesenquimales derivadas del tejido adiposo frente a las derivadas de la médula ósea". Células madre y desarrollo . 21 (14): 2724–52. doi :10.1089/scd.2011.0722. PMID 22468918.
- ^ Gregory CA, Prockop DJ, Spees JL (junio de 2005). "Células madre de médula ósea no hematopoyéticas: control molecular de la expansión y la diferenciación". Experimental Cell Research . Control molecular de la diferenciación de células madre. 306 (2): 330–5. doi :10.1016/j.yexcr.2005.03.018. PMID 15925588.
- ^ Liau LL, Ruszymah BH, Ng MH, Law JX (enero de 2020). "Características y aplicaciones clínicas de las células estromales mesenquimales derivadas de la gelatina de Wharton". Investigación actual en medicina traslacional . 68 (1): 5–16. doi :10.1016/j.retram.2019.09.001. PMID 31543433. S2CID 202731274.
- ^ Bunnell BA, Flaat M, Gagliardi C, Patel B, Ripoll C (junio de 2008). "Células madre derivadas de tejido adiposo: aislamiento, expansión y diferenciación". Métodos . Métodos en la investigación con células madre. 45 (2): 115–20. doi :10.1016/j.ymeth.2008.03.006. PMC 3668445 . PMID 18593609.
- ^ "¿Qué es el tejido del cordón umbilical?". CordAdvantage.com. 30 de octubre de 2018.
- ^ Sen B, Paradise CR, Xie Z, Sankaran J, Uzer G, Styner M, et al. (junio de 2020). "β-Catenina preserva el estado madre de las células estromales de la médula ósea murina mediante la activación de EZH2". Revista de investigación ósea y mineral . 35 (6): 1149–1162. doi : 10.1002/jbmr.3975 . PMC 7295671 . PMID 32022326.
- ^ Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-Gonzalez XR, et al. (julio de 2002). "Pluripotencia de células madre mesenquimales derivadas de médula ósea adulta". Nature . 418 (6893): 41–9. Bibcode :2002Natur.418...41J. doi :10.1038/nature00870. PMID 12077603. S2CID 47162269.(Retractado, véase doi :10.1038/s41586-024-07653-0, PMID 38886620, Retraction Watch )
- ^ Franco Lambert AP, Fraga Zandonai A, Bonatto D, Cantarelli Machado D, Pêgas Henriques JA (marzo de 2009). "Diferenciación de células madre adultas derivadas de tejido adiposo humano en tejido neuronal: ¿funciona?". Diferenciación; Investigación en Diversidad Biológica . 77 (3): 221–8. doi :10.1016/j.diff.2008.10.016. PMID 19272520.
- ^ Engler AJ, Sen S, Sweeney HL, Discher DE (agosto de 2006). "La elasticidad de la matriz dirige la especificación del linaje de células madre". Cell . 126 (4): 677–89. doi : 10.1016/j.cell.2006.06.044 . PMID 16923388. S2CID 16109483.
- ^ Choudhery MS, Badowski M, Muise A, Pierce J, Harris DT (enero de 2014). "La edad del donante afecta negativamente la expansión y diferenciación de células madre mesenquimales derivadas del tejido adiposo". Journal of Translational Medicine . 12 (1): 8. doi : 10.1186/1479-5876-12-8 . PMC 3895760 . PMID 24397850.
- ^ Banerjee K, Chattopadhyay A, Banerjee S (julio de 2022). "Comprensión de la asociación de las células madre en el desarrollo fetal y la carcinogénesis durante el embarazo". Avances en biología del cáncer - Metástasis . 4 : 100042. doi : 10.1016/j.adcanc.2022.100042 . ISSN 2667-3940. S2CID 248485831.
- ^ Spaggiari GM, Abdelrazik H, Becchetti F, Moretta L (junio de 2009). "Las MSC inhiben la maduración y la función de las células dendríticas derivadas de monocitos al interferir selectivamente con la generación de células dendríticas inmaduras: papel central de la prostaglandina E2 derivada de MSC". Blood . 113 (26): 6576–6583. doi : 10.1182/blood-2009-02-203943 . PMID 19398717. S2CID 206878089.
- ^ ab Ren G, Zhao X, Zhang L, Zhang J, L'Huillier A, Ling W, et al. (marzo de 2010). "La molécula-1 de adhesión intercelular inducida por citocinas inflamatorias y la molécula-1 de adhesión celular vascular en células madre mesenquimales son fundamentales para la inmunosupresión". Journal of Immunology . 184 (5): 2321–2328. doi :10.4049/jimmunol.0902023. PMC 2881946 . PMID 20130212.
- ^ Akiyama K, Chen C, Wang D, Xu X, Qu C, Yamaza T, et al. (mayo de 2012). "La inmunorregulación inducida por células madre mesenquimales implica la apoptosis de células T mediada por FAS-ligando/FAS". Cell Stem Cell . 10 (5): 544–555. doi :10.1016/j.stem.2012.03.007. PMC 3348385 . PMID 22542159.
- ^ Davies LC, Heldring N, Kadri N, Le Blanc K (marzo de 2017). "La secreción de ligandos de muerte programada-1 por parte de células estromales mesenquimales regula la inmunosupresión mediada por células T". Células madre . 35 (3): 766–776. doi :10.1002/stem.2509. PMC 5599995 . PMID 27671847.
- ^ Kim J, Hematti P (diciembre de 2009). "Macrófagos educados por células madre mesenquimales: un nuevo tipo de macrófagos activados alternativamente". Hematología experimental . 37 (12): 1445–53. doi :10.1016/j.exphem.2009.09.004. PMC 2783735 . PMID 19772890.
- ^ Brown JM, Nemeth K, Kushnir-Sukhov NM, Metcalfe DD, Mezey E (abril de 2011). "Las células del estroma de la médula ósea inhiben la función de los mastocitos a través de un mecanismo dependiente de COX2". Alergia clínica y experimental . 41 (4): 526–34. doi :10.1111/j.1365-2222.2010.03685.x. PMC 3078050 . PMID 21255158.
- ^ Kay LJ, Yeo WW, Peachell PT (abril de 2006). "La prostaglandina E2 activa los receptores EP2 para inhibir la desgranulación de los mastocitos pulmonares humanos". British Journal of Pharmacology . 147 (7): 707–13. doi :10.1038/sj.bjp.0706664. PMC 1751511 . PMID 16432506.
- ^ Spaggiari GM, Capobianco A, Becchetti S, Mingari MC, Moretta L (febrero de 2006). "Interacciones entre células madre mesenquimales y células asesinas naturales: evidencia de que las células NK activadas son capaces de matar a las MSC, mientras que las MSC pueden inhibir la proliferación de células NK inducida por IL-2". Blood . 107 (4): 1484–90. doi :10.1182/blood-2005-07-2775. hdl : 11567/267587 . PMID 16239427.
- ^ Raffaghello L, Bianchi G, Bertolotto M, Montecucco F, Busca A, Dallegri F, et al. (Enero de 2008). "Las células madre mesenquimales humanas inhiben la apoptosis de neutrófilos: un modelo para la preservación de neutrófilos en el nicho de la médula ósea". Células madre . 26 (1): 151–62. doi : 10.1634/stemcells.2007-0416 . PMID 17932421. S2CID 32230553.
- ^ Jiang XX, Zhang Y, Liu B, Zhang SX, Wu Y, Yu XD, Mao N (mayo de 2005). "Las células madre mesenquimales humanas inhiben la diferenciación y la función de las células dendríticas derivadas de monocitos". Blood . 105 (10): 4120–6. doi : 10.1182/blood-2004-02-0586 . PMID 15692068.
- ^ Ma S, Xie N, Li W, Yuan B, Shi Y, Wang Y (febrero de 2014). "Inmunobiología de células madre mesenquimales". Muerte celular y diferenciación . 21 (2): 216–25. doi :10.1038/cdd.2013.158. PMC 3890955 . PMID 24185619.
- ^ Ren G, Zhang L, Zhao X, Xu G, Zhang Y, Roberts AI, et al. (febrero de 2008). "La inmunosupresión mediada por células madre mesenquimales se produce a través de la acción concertada de las quimiocinas y el óxido nítrico". Cell Stem Cell . 2 (2): 141–50. doi : 10.1016/j.stem.2007.11.014 . PMID 18371435.
- ^ Di Nicola M, Carlo-Stella C, Magni M, Milanesi M, Longoni PD, Matteucci P, et al. (mayo de 2002). "Las células estromales de la médula ósea humana suprimen la proliferación de linfocitos T inducida por estímulos mitogénicos celulares o no específicos". Blood . 99 (10): 3838–43. doi : 10.1182/blood.v99.10.3838 . hdl : 11379/598065 . PMID 11986244. S2CID 5889200.
- ^ ab Augello A, Tasso R, Negrini SM, Amateis A, Indiveri F, Cancedda R, Pennesi G (mayo de 2005). "Las células progenitoras mesenquimales de la médula ósea inhiben la proliferación de linfocitos mediante la activación de la vía de muerte programada 1". Revista Europea de Inmunología . 35 (5): 1482–90. doi : 10.1002/eji.200425405 . PMID 15827960. S2CID 24088675.
- ^ Glennie S, Soeiro I, Dyson PJ, Lam EW, Dazzi F (abril de 2005). "Las células madre mesenquimales de la médula ósea inducen anergia de detención de división de células T activadas". Blood . 105 (7): 2821–7. doi : 10.1182/blood-2004-09-3696 . PMID 15591115. S2CID 33590543.
- ^ Aggarwal S, Pittenger MF (febrero de 2005). "Las células madre mesenquimales humanas modulan las respuestas de las células inmunitarias alogénicas". Blood . 105 (4): 1815–22. doi : 10.1182/blood-2004-04-1559 . PMID 15494428.
- ^ Corcione A, Benvenuto F, Ferretti E, Giunti D, Cappiello V, Cazzanti F, et al. (Enero de 2006). "Las células madre mesenquimales humanas modulan las funciones de las células B". Sangre . 107 (1): 367–72. doi : 10.1182/sangre-2005-07-2657 . PMID 16141348.
- ^ Krasnodembskaya A, Song Y, Fang X, Gupta N, Serikov V, Lee JW, Matthay MA (diciembre de 2010). "El efecto antibacteriano de las células madre mesenquimales humanas está mediado en parte por la secreción del péptido antimicrobiano LL-37". Células madre . 28 (12): 2229–38. doi :10.1002/stem.544. PMC 3293245 . PMID 20945332.
- ^ Sung DK, Chang YS, Sung SI, Yoo HS, Ahn SY, Park WS (marzo de 2016). "El efecto antibacteriano de las células madre mesenquimales contra Escherichia coli está mediado por la secreción de beta-defensina-2 a través de la señalización del receptor tipo Toll 4". Microbiología celular . 18 (3): 424–36. doi :10.1111/cmi.12522. PMC 5057339 . PMID 26350435.
- ^ Gupta N, Krasnodembskaya A, Kapetanaki M, Mouded M, Tan X, Serikov V, Matthay MA (junio de 2012). "Las células madre mesenquimales mejoran la supervivencia y la eliminación de bacterias en la neumonía murina por Escherichia coli". Tórax . 67 (6): 533–9. doi :10.1136/thoraxjnl-2011-201176. PMC 3358432 . PMID 22250097.
- ^ Alcayaga-Miranda F, Cuenca J, Martin A, Contreras L, Figueroa FE, Khoury M (octubre de 2015). "La terapia combinada de células madre mesenquimales derivadas de la menstruación y antibióticos mejora la supervivencia en la sepsis". Investigación y terapia con células madre . 6 : 199. doi : 10.1186/s13287-015-0192-0 . PMC 4609164. PMID 26474552 .
- ^ Meisel R, Brockers S, Heseler K, Degistirici O, Bülle H, Woite C, et al. (abril de 2011). "Las células estromales mesenquimales multipotentes humanas, pero no las murinas, exhiben una función efectora antimicrobiana de amplio espectro mediada por la indolamina 2,3-dioxigenasa". Leucemia . 25 (4): 648–54. doi : 10.1038/leu.2010.310 . PMID 21242993.
- ^ "Búsqueda de: Células madre mesenquimales - Lista de resultados - ClinicalTrials.gov". clinicaltrials.gov . Consultado el 26 de mayo de 2023 .
- ^ Figueroa FE, Carrión F, Villanueva S, Khoury M (2012). "Tratamiento con células madre mesenquimales para enfermedades autoinmunes: una revisión crítica". Biological Research . 45 (3): 269–77. doi : 10.4067/S0716-97602012000300008 . PMID 23283436.
- ^ Sharma RR, Pollock K, Hubel A , McKenna D (mayo de 2014). "Células madre o estromales mesenquimales: una revisión de aplicaciones clínicas y prácticas de fabricación". Transfusión . 54 (5): 1418–37. doi :10.1111/trf.12421. PMC 6364749 . PMID 24898458.
- ^ Fischer UM, Harting MT, Jimenez F, Monzon-Posadas WO, Xue H, Savitz SI, et al. (junio de 2009). "El paso pulmonar es un obstáculo importante para la administración intravenosa de células madre: el efecto de primer paso pulmonar". Células madre y desarrollo . 18 (5): 683–92. doi :10.1089/scd.2008.0253. PMC 3190292 . PMID 19099374.
- ^ Heirani-Tabasi A, Hassanzadeh M, Hemmati-Sadeghi S, Shahriyari M, Raeesolmohaddeseen M (2015). "Células madre mesenquimales; definiendo el futuro de la medicina regenerativa". Revista de genes y células . 1 (2): 34–39. doi :10.15562/gnc.15. S2CID 87157970.
- ^ Anderson JD, Johansson HJ, Graham CS, Vesterlund M, Pham MT, Bramlett CS, et al. (marzo de 2016). "El análisis proteómico integral de los exosomas de células madre mesenquimales revela la modulación de la angiogénesis a través de la señalización del factor nuclear kappaB". Células madre . 34 (3): 601–13. doi :10.1002/stem.2298. PMC 5785927 . PMID 26782178.
- ^ Wan C, He Q, McCaigue M, Marsh D, Li G (enero de 2006). "La población de células no adherentes de un cultivo de médula ósea humana es una fuente complementaria de células madre mesenquimales (MSC)". Journal of Orthopaedic Research . 24 (1): 21–8. doi :10.1002/jor.20023. PMID 16419965. S2CID 28963721.
- ^ Gronthos S, Graves SE, Ohta S, Simmons PJ (diciembre de 1994). "La fracción STRO-1+ de la médula ósea humana adulta contiene los precursores osteogénicos". Blood . 84 (12): 4164–73. doi : 10.1182/blood.V84.12.4164.bloodjournal84124164 . PMID 7994030.
- ^ Oyajobi BO, Lomri A, Hott M, Marie PJ (marzo de 1999). "Aislamiento y caracterización de progenitores de osteoblastos clonogénicos humanos inmunoseleccionados a partir del estroma de la médula ósea fetal utilizando el anticuerpo monoclonal STRO-1". Journal of Bone and Mineral Research . 14 (3): 351–61. doi : 10.1359/jbmr.1999.14.3.351 . PMID 10027900. S2CID 23683884.
- ^ Tondreau T, Lagneaux L, Dejeneffe M, Delforge A, Massy M, Mortier C, Bron D (1 de enero de 2004). "Aislamiento de células madre mesenquimales de médula ósea mediante adhesión plástica o selección negativa: fenotipo, cinética de proliferación y potencial de diferenciación". Citoterapia . 6 (4): 372–9. doi :10.1080/14653240410004943. PMID 16146890.
- ^ Iudicone P, Fioravanti D, Bonanno G, Miceli M, Lavorino C, Totta P, et al. (enero de 2014). "Lisado plaquetario libre de patógenos y pobre en plasma y expansión de células madre mesenquimales humanas". Journal of Translational Medicine . 12 : 28. doi : 10.1186/1479-5876-12-28 . PMC 3918216 . PMID 24467837.
- ^ Jiang B, Fu X, Yan L, Li S, Zhao D, Wang X, et al. (2019). "El trasplante de esferoides de células madre mesenquimales derivadas de células madre humanas mejora la osteoartritis espontánea en macacos rhesus". Theranostics . 9 (22): 6587–6600. doi :10.7150/thno.35391. PMC 6771254 . PMID 31588237.
- ^ Borzabadi-Farahani A (septiembre de 2016). "Efecto de la irradiación láser de bajo nivel en la proliferación de células madre mesenquimales dentales humanas; una revisión sistemática". Revista de fotoquímica y fotobiología. B, Biología . 162 : 577–582. doi :10.1016/j.jphotobiol.2016.07.022. PMID 27475781.
- ^ Becker AJ, McCulloch EA, Till JE (febrero de 1963). "Demostración citológica de la naturaleza clonal de colonias de bazo derivadas de células de médula ósea de ratón trasplantadas". Nature . 197 (4866): 452–4. Bibcode :1963Natur.197..452B. doi :10.1038/197452a0. hdl : 1807/2779 . PMID 13970094. S2CID 11106827.
- ^ Siminovitch L, Mcculloch EA, Till JE (diciembre de 1963). "La distribución de células formadoras de colonias entre las colonias del bazo". Journal of Cellular and Comparative Physiology . 62 (3): 327–36. doi :10.1002/jcp.1030620313. hdl : 1807/2778 . PMID 14086156.
- ^ Caplan AI (junio de 2017). "Células madre mesenquimales: ¡es hora de cambiar el nombre!". Stem Cells Translational Medicine . 6 (6): 1445–1451. doi :10.1002/sctm.17-0051. PMC 5689741 . PMID 28452204.
- ^ Friedenstein AJ, Deriglasova UF, Kulagina NN, Panasuk AF, Rudakowa SF, Luriá EA, Ruadkow IA (1974). "Precursores de fibroblastos en diferentes poblaciones de células hematopoyéticas detectados mediante el método de ensayo de colonias in vitro". Hematología experimental . 2 (2): 83–92. PMID 4455512.
- ^ Friedenstein AJ, Gorskaja JF, Kulagina NN (septiembre de 1976). "Precursores de fibroblastos en órganos hematopoyéticos de ratones normales e irradiados". Hematología experimental . 4 (5): 267–74. PMID 976387.
- ^ Lazarus HM, Haynesworth SE, Gerson SL, Rosenthal NS, Caplan AI (octubre de 1995). "Expansión ex vivo e infusión posterior de células progenitoras estromales derivadas de médula ósea humana (células progenitoras mesenquimales): implicaciones para el uso terapéutico". Trasplante de médula ósea . 16 (4): 557–564. PMID 8528172.
- ^ Galipeau J, Sensébé L (junio de 2018). "Células estromales mesenquimales: desafíos clínicos y oportunidades terapéuticas". Cell Stem Cell . 22 (6): 824–833. doi :10.1016/j.stem.2018.05.004. PMC 6434696 . PMID 29859173.
- ^ Lazarus HM, Haynesworth SE, Gerson SL, Caplan AI (octubre de 1997). "Las células progenitoras mesenquimales (del estroma) derivadas de la médula ósea humana (MPC) no se pueden recuperar de las colecciones de células progenitoras de sangre periférica". Journal of Hematotherapy . 6 (5): 447–455. doi :10.1089/scd.1.1997.6.447. PMID 9368181.
- ^ Caplan AI (febrero de 2019). «Células de señalización medicinal: funcionan, así que úselas». Nature . 566 (7742): 39. Bibcode :2019Natur.566R..39C. doi : 10.1038/d41586-019-00490-6 . PMID 30723355.
- ^ Vigdor N (4 de febrero de 2021). "Legislador promovió terapia con células madre para Covid-19 en esquema de fraude, dice EE. UU." The New York Times . ISSN 0362-4331 . Consultado el 8 de febrero de 2021 .
- ^ Oficina del Comisionado (9 de septiembre de 2020). "La FDA advierte sobre las terapias con células madre". Administración de Alimentos y Medicamentos de Estados Unidos .
Lectura adicional
Enlaces externos
- "Hoja informativa sobre células madre mesenquimales". Euro Stem Cell . Junio de 2012. Archivado desde el original el 27 de noviembre de 2016. Consultado el 25 de junio de 2012 .Revisado por científicos y no demasiado técnico.
- "Investigación con células madre mesenquimales". Universidad Johns Hopkins . Archivado desde el original el 15 de octubre de 2017. Consultado el 26 de junio de 2012 .