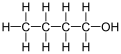
1-butanol
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Butan-1-ol [1] | |||
| Otros nombres n -Butanol Alcohol n- butílico Hidróxido de n -butilo n -Propilcarbinol n- Propilmetanol 1-Hidroxibutano Metilolpropano | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 3DMet |
| ||
| 969148 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.000.683 | ||
| Número CE |
| ||
| 25753 | |||
| BARRIL | |||
| Malla | 1-butanol | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1120 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C4H10O | |||
| Masa molar | 74,123 g·mol −1 | ||
| Apariencia | Líquido incoloro y refractario. | ||
| Olor | parecido al plátano , [2] áspero, alcohólico y dulce | ||
| Densidad | 0,81 g/ cm3 | ||
| Punto de fusión | -89,8 °C (-129,6 °F; 183,3 K) | ||
| Punto de ebullición | 117,7 °C (243,9 °F; 390,8 K) | ||
| 73 g/L a 25 °C | |||
| Solubilidad | Muy soluble en acetona, miscible con etanol , éter etílico. | ||
| registro P | 0,839 | ||
| Presión de vapor | 0,58 kPa (20 °C) Fichas internacionales de seguridad química (ICSC) de la OIT | ||
| Acidez (p K a ) | 16.10 | ||
| −56,536·10 −6 cm3 / mol | |||
Índice de refracción ( n D ) | 1.3993 (20 °C) | ||
| Viscosidad | 2,573 mPa·s (a 25 °C) [3] | ||
| 1,66 D | |||
| Termoquímica | |||
Entropía molar estándar ( S ⦵ 298 ) | 225,7 J/(K·mol) | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −328(4) kJ/mol | ||
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | −2670(20) kJ/mol | ||
| Peligros | |||
| Etiquetado SGA : | |||
   | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | 35 °C (95 °F; 308 K) | ||
| 343 °C (649 °F; 616 K) | |||
| Límites de explosividad | 1,45–11,25 % | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 790 mg/kg (rata, oral) | ||
LD Lo ( valor más bajo publicado ) | 3484 mg/kg (conejo, oral) 790 mg/kg (rata, oral) 1700 mg/kg (perro, oral) [5] | ||
LC 50 ( concentración media ) | 9221 ppm (mamífero) 8000 ppm (rata, 4 h ) [5] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 100 ppm (300 mg/m3 ) [ 4] | ||
REL (recomendado) | C 50 ppm (150 mg/m 3 ) [piel] [4] | ||
IDLH (Peligro inmediato) | 1400 ppm [4] | ||
| Ficha de datos de seguridad (FDS) | ICSC 0111 | ||
| Compuestos relacionados | |||
Compuestos relacionados | Butanotiol n -Butilamina Éter dietílico Pentano | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El 1-butanol , también conocido como butan-1-ol o n -butanol , es un alcohol primario con la fórmula química C4H9OH y una estructura lineal. Los isómeros del 1-butanol son isobutanol , butan -2-ol y terc -butanol . El término butanol sin modificar generalmente se refiere al isómero de cadena lineal.
El 1-butanol se produce de forma natural como un producto menor de la fermentación del etanol de azúcares y otros sacáridos [6] y está presente en muchos alimentos y bebidas. [7] [8] También es un saborizante artificial permitido en los Estados Unidos, [9] utilizado en mantequilla, crema, fruta, ron, whisky, helados y granizados, dulces, productos horneados y cordiales. [10] También se utiliza en una amplia gama de productos de consumo. [7]
El 1-butanol se utiliza principalmente como intermediario industrial, en particular para la fabricación de acetato de butilo (que es un aromatizante artificial y un disolvente industrial). Es un derivado petroquímico del propileno . Las cifras de producción estimadas para 1997 son: Estados Unidos 784.000 toneladas; Europa occidental 575.000 toneladas; Japón 225.000 toneladas. [8]
Producción
Desde la década de 1950, la mayor parte del 1-butanol se produce mediante la hidroformilación del propeno (proceso oxo) para formar preferentemente el butiraldehído n-butanal. Los catalizadores típicos se basan en cobalto y rodio. A continuación, el butiraldehído se hidrogena para producir butanol.

Un segundo método para producir butanol implica la reacción de Reppe del propileno con CO y agua: [11]
- CH 3 CH=CH 2 + H 2 O + 2 CO → CH 3 CH 2 CH 2 CH 2 OH + CO 2
Antiguamente, el butanol se preparaba a partir de crotonaldehído , que se puede obtener a partir de acetaldehído .
El butanol también se puede producir mediante la fermentación de biomasa por bacterias. Antes de la década de 1950, se utilizaba Clostridium acetobutylicum en la fermentación industrial para producir butanol. Las investigaciones realizadas en las últimas décadas han mostrado resultados de otros microorganismos que pueden producir butanol mediante fermentación.
El butanol se puede producir mediante hidrogenación de furano sobre un catalizador de Pd o Pt a alta temperatura y alta presión.https://pubs.rsc.org/en/content/articlehtml/2014/gc/c3gc41183d
Uso industrial
El 1-butanol, que constituye el 85% de su uso, se utiliza principalmente en la producción de barnices . Es un disolvente popular, por ejemplo, para la nitrocelulosa . Se utilizan diversos derivados del butanol como disolventes, por ejemplo, butoxietanol o acetato de butilo . Muchos plastificantes se basan en ésteres de butilo, por ejemplo, ftalato de dibutilo . El monómero acrilato de butilo se utiliza para producir polímeros. Es el precursor de las n-butilaminas . [11]
Biocombustible
Se ha propuesto el 1-butanol como sustituto del combustible diésel y la gasolina . Se produce en pequeñas cantidades en casi todas las fermentaciones (véase aceite de fusel ). El Clostridium produce rendimientos mucho mayores de butanol. Se están realizando investigaciones para aumentar el rendimiento de biobutanol a partir de biomasa .
El butanol se considera un biocombustible potencial ( combustible de butanol ). El butanol al 85 % se puede utilizar en automóviles diseñados para gasolina sin realizar ningún cambio en el motor (a diferencia del etanol al 85 %), y proporciona más energía para un volumen determinado que el etanol, casi tanta como la gasolina. Por lo tanto, un vehículo que utilice butanol tendría un consumo de combustible más comparable al de la gasolina que al del etanol. El butanol también se puede añadir al combustible diésel para reducir las emisiones de hollín. [12]
La producción o, en algunos casos, el uso de las siguientes sustancias puede provocar exposición al 1-butanol: cuero artificial , ésteres de butilo , cemento de caucho , tintes, esencias de frutas, lacas, películas cinematográficas y fotográficas, impermeables, perfumes, plásticos de piroxilina , rayón , vidrio de seguridad, barniz de goma laca y tela impermeabilizada. [7]
Ocurrencia en la naturaleza
El butan-1-ol se produce de forma natural como resultado de la fermentación de carbohidratos en varias bebidas alcohólicas, entre ellas la cerveza, [13] los aguardientes de uva, [14] el vino, [15] y el whisky. [16] Se ha detectado en los volátiles del lúpulo, [17] la yaca, [18] las leches tratadas térmicamente, [19] el melón almizclero, [20] el queso, [21] las semillas de guisante sureño, [22] y el arroz cocido. [23] El 1-butanol también se forma durante la fritura de aceite de maíz, aceite de semilla de algodón, trilinoleína y trioleína. [24]
El butan-1-ol es uno de los " alcoholes fusel " (del alemán "licor malo"), que incluyen alcoholes que tienen más de dos átomos de carbono y tienen una solubilidad significativa en agua. [25] Es un componente natural de muchas bebidas alcohólicas, aunque en concentraciones bajas y variables. [26] [27] Se le atribuye (junto con alcoholes fusel similares) ser responsable de resacas severas , aunque los experimentos en modelos animales no muestran evidencia de esto. [28]
El 1-butanol se utiliza como ingrediente en saborizantes procesados y artificiales, [29] y para la extracción de proteína libre de lípidos de la yema de huevo, [30] materiales saborizantes naturales y aceites vegetales, la fabricación de extracto de lúpulo para la elaboración de cerveza y como solvente para eliminar pigmentos del concentrado de proteína de hoja de cuajada húmeda . [31]
Metabolismo y toxicidad
La toxicidad aguda del 1-butanol es relativamente baja, con valores de LD50 oral de 790–4,360 mg/kg (rata; valores comparables para el etanol son 7,000–15,000 mg/kg). [8] [32] [11] Se metaboliza completamente en vertebrados de una manera similar al etanol : la alcohol deshidrogenasa convierte el 1-butanol en butiraldehído ; este luego es convertido en ácido butírico por la aldehído deshidrogenasa . El ácido butírico puede metabolizarse completamente a dióxido de carbono y agua por la vía de la β-oxidación . En la rata, solo el 0,03% de una dosis oral de 2,000 mg/kg se excretó en la orina. [33] En dosis subletales, el 1-butanol actúa como un depresor del sistema nervioso central , similar al etanol: un estudio en ratas indicó que la potencia intoxicante del 1-butanol es aproximadamente 6 veces mayor que la del etanol, posiblemente debido a su transformación más lenta por la alcohol deshidrogenasa. [34]
Otros peligros
El 1-butanol líquido, como ocurre con la mayoría de los disolventes orgánicos, es extremadamente irritante para los ojos; el contacto repetido con la piel también puede causar irritación. [8] Se cree que se trata de un efecto genérico de desengrasado . No se ha observado sensibilización cutánea. La irritación de las vías respiratorias se produce solo en concentraciones muy altas (>2400 ppm). [35]
Con un punto de inflamación de 35 °C, el 1-butanol presenta un riesgo moderado de incendio: es ligeramente más inflamable que el queroseno o el combustible diésel , pero menos inflamable que muchos otros disolventes orgánicos comunes. El efecto depresor sobre el sistema nervioso central (similar a la intoxicación por etanol) es un peligro potencial cuando se trabaja con 1-butanol en espacios cerrados, aunque el umbral de olor (0,2–30 ppm) está muy por debajo de la concentración que tendría algún efecto neurológico. [35] [36]
Véase también
Enlaces externos
- Ficha internacional de seguridad química 0111
- Guía de bolsillo del NIOSH sobre peligros químicos. "#0076". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- Informe de evaluación inicial de los SIDS sobre el n-butanol de la Organización para la Cooperación y el Desarrollo Económicos (OCDE)
- Criterios de salud ambiental del IPCS 65: Butanoles: cuatro isómeros
- Guía de salud y seguridad del IPCS 3: 1-butanol
Referencias
- ^ "1-Butanol - Resumen de compuestos". The PubChem Project . EE. UU.: Centro Nacional de Información Biotecnológica.
- ^ [Información sobre el producto n-butanol, The Dow Chemical Company, Formulario n.º 327-00014-1001, página 1]
- ^ Dubey, Gyan (2008). "Estudio de densidades, viscosidades y velocidades del sonido de mezclas líquidas binarias de butan-1-ol con n-alcanos (C6, C8 y C10) a T = (298,15, 303,15 y 308,15) K". The Journal of Chemical Thermodynamics . 40 (2): 309–320. doi :10.1016/j.jct.2007.05.016.
- ^ abc Guía de bolsillo del NIOSH sobre peligros químicos. "#0076". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab "Alcohol n-butílico". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Hazelwood, Lucie A.; Daran, Jean-Marc; van Maris, Antonius JA; Pronk, Jack T.; Dickinson, J. Richard (2008), "La vía de Ehrlich para la producción de alcohol fusel: un siglo de investigación sobre el metabolismo de Saccharomyces cerevisiae ", Appl. Environ. Microbiol. , 74 (8): 2259–66, Bibcode :2008ApEnM..74.2259H, doi :10.1128/AEM.02625-07, PMC 2293160 , PMID 18281432 .
- ^ abc Butanoles: cuatro isómeros, monografía n.º 65 de Criterios de salud ambiental, Ginebra: Organización Mundial de la Salud, 1987, ISBN 92-4-154265-9.
- ^ abcd n-Butanol (PDF) , Informe de evaluación inicial de los SIDS, Ginebra: Programa de las Naciones Unidas para el Medio Ambiente, abril de 2005.
- ^ 21 CFR § 172.515; 42 FR 14491, 15 de marzo de 1977, según enmendado.
- ^ Hall, RL; Oser, BL (1965), "Progresos recientes en la consideración de los ingredientes aromatizantes en el marco de la enmienda sobre aditivos alimentarios. III. Sustancias gras", Food Technol. : 151, citado en Butanoles: cuatro isómeros, monografía n.º 65 de Criterios de salud ambiental, Ginebra: Organización Mundial de la Salud, 1987, ISBN 92-4-154265-9.
- ^ abc Hahn, Heinz-Dieter; Dämbkes, Georg; Rupprich, Norbert (2005). "Butanoles". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a04_463. ISBN 978-3527306732..
- ^ Antoni, D.; Zverlov, V. y Schwarz, WH (2007). "Biocombustibles a partir de microbios". Microbiología Aplicada y Biotecnología . 77 (1): 23–35. doi :10.1007/s00253-007-1163-x. PMID 17891391. S2CID 35454212.
- ^ Bonte, W. (1979), "Sustancias congéneres en cervezas alemanas y extranjeras", Blutalkohol , 16 : 108-24, citado en Butanoles: cuatro isómeros, monografía n.º 65 de Criterios de salud ambiental, Ginebra: Organización Mundial de la Salud, 1987, ISBN 92-4-154265-9.
- ^ Schreier, Peter; Drawert, Friedrich; Winkler, Friedrich (1979), "Composición de componentes volátiles neutros en aguardientes de uva", J. Agric. Food Chem. , 27 (2): 365–72, doi :10.1021/jf60222a031.
- ^ Bonte, W. (1978), "Contenido de congéneres del vino y bebidas similares", Blutalkohol , 15 : 392–404, citado en Butanoles: cuatro isómeros, monografía n.º 65 de Criterios de salud ambiental, Ginebra: Organización Mundial de la Salud, 1987, ISBN 92-4-154265-9.
- ^ Postel, W.; Adam, L. (1978), "Caracterización cromatográfica de gases del whisky. III. Whisky irlandés", Branntweinwirtschaft , 118 : 404–7, citado en Butanoles: cuatro isómeros, monografía n.º 65 de Criterios de salud ambiental, Ginebra: Organización Mundial de la Salud, 1987, ISBN 92-4-154265-9.
- ^ Tressl, Roland; Friese, Lothar; Fendesack, Friedrich; Koeppler, Hans (1978), "Estudios de la composición volátil del lúpulo durante el almacenamiento", J. Agric. Food Chem. , 26 (6): 1426–30, doi :10.1021/jf60220a036.
- ^ Espadas, G.; Bobbio, PA; Hunter, GLK (1978), "Constituyentes volátiles de la fruta de jack ( Arthocarpus heterophyllus )", J. Food Sci. , 43 (2): 639–40, doi :10.1111/j.1365-2621.1978.tb02375.x.
- ^ Jaddou, Haytham A.; Pavey, John A.; Manning, Donald J. (1978), "Análisis químico de los componentes volátiles del sabor en leches tratadas térmicamente", J. Dairy Res. , 45 (3): 391–403, doi :10.1017/S0022029900016617, S2CID 85985458.
- ^ Yabumoto, K.; Yamaguchi, M.; Jennings, WG (1978), "Producción de compuestos volátiles por melón, Cucumis melo ", Food Chem. , 3 (1): 7–16, doi :10.1016/0308-8146(78)90042-0.
- ^ Dumont, Jean Pierre; Adda, Jacques (1978), "Presencia de sesquiterponas en compuestos volátiles del queso de montaña", J. Agric. Food Chem. , 26 (2): 364–67, doi :10.1021/jf60216a037.
- ^ Fisher, Gordon S.; Legendre, Michael G.; Lovgren, Norman V.; Schuller, Walter H.; Wells, John A. (1979), "Componentes volátiles de la semilla de guisante de Australia [ Vigna unguiculata (L.) Walp.]", J. Agric. Food Chem. , 27 (1): 7–11, doi :10.1021/jf60221a040.
- ^ Yajima, Izumi; Yanai, Tetsuya; Nakamura, Mikio; Sakakibara, Hidemasa; Habu, Tsutomu (1978), "Componentes volátiles del sabor del arroz cocido", Agric. Biol. Química. , 42 (6): 1229–33, doi : 10.1271/bbb1961.42.1229.
- ^ Chang, SS; Peterson, KJ; Ho, C. (1978), "Reacciones químicas implicadas en la fritura de alimentos en aceite de oliva", J. Am. Oil Chem. Soc. , 55 (10): 718–27, doi :10.1007/BF02665369, PMID 730972, S2CID 97273264, citado en Butanoles: cuatro isómeros, monografía n.º 65 de Criterios de salud ambiental, Ginebra: Organización Mundial de la Salud, 1987, ISBN 92-4-154265-9.
- ^ Atsumi, S.; Hanai, T.; Liao, JC (2008). "Vías no fermentativas para la síntesis de alcoholes superiores de cadena ramificada como biocombustibles". Nature . 451 (7174): 86–89. Bibcode :2008Natur.451...86A. doi :10.1038/nature06450. PMID 18172501. S2CID 4413113.
- ^ Woo, Kang-Lyung (2005), "Determinación de alcoholes de bajo peso molecular, incluido el aceite de fusel, en varias muestras mediante extracción con éter dietílico y cromatografía de gases capilar", J. AOAC Int. , 88 (5): 1419–27, doi : 10.1093/jaoac/88.5.1419 , PMID 16385992.
- ^ Lachenmeier, Dirk W.; Haupt, Simone; Schulz, Katja (2008), "Definición de los niveles máximos de alcoholes superiores en bebidas alcohólicas y productos de alcohol sustitutos", Regul. Toxicol. Pharmacol. , 50 (3): 313–21, doi :10.1016/j.yrtph.2007.12.008, PMID 18295386.
- ^ Hori, Hisako; Fujii, Wataru; Hatanaka, Yutaka; Suwa, Yoshihide (2003), "Efectos del aceite de fusel en modelos animales de resaca", Alcohol. Clin. Exp. Res. , 27 (8 Suppl): 37S–41S, doi : 10.1097/01.ALC.0000078828.49740.48 , PMID 12960505.
- ^ Mellan, I. (1950), Solventes industriales , Nueva York: Van Nostrand Reinhold, págs., citado en Butanoles: cuatro isómeros, monografía n.º 65 de Criterios de salud ambiental, Ginebra: Organización Mundial de la Salud, 1987, ISBN 92-4-154265-9.
- ^ Meslar, Harry W.; White, Harold B. III (1978), "Preparación de extractos proteicos libres de lípidos de yema de huevo", Anal. Biochem. , 91 (1): 75–81, doi :10.1016/0003-2697(78)90817-5, PMID 9762085.
- ^ Bray, Walter J.; Humphries, Catherine (1978), "Fraccionamiento con solventes del jugo de las hojas para preparar productos proteínicos verdes y blancos", J. Sci. Food Agric. , 29 (10): 839–46, Bibcode :1978JSFA...29..839B, doi :10.1002/jsfa.2740291003.
- ^ Etanol (PDF) , Informe de evaluación inicial de los pequeños Estados insulares en desarrollo, Ginebra: Programa de las Naciones Unidas para el Medio Ambiente, agosto de 2005.
- ^ Gaillard, D.; Derache, R. (1965), "Métabilisation de différents alcools présents dans les biossons alcooliques chez le rat", Trav. Soc. Farmacéutico. Montpellier , 25 : 541–62, citado en Butanoles: cuatro isómeros, monografía n.º 65 de Criterios de salud ambiental, Ginebra: Organización Mundial de la Salud, 1987, ISBN 92-4-154265-9.
- ^ McCreery, NJ; Hunt, WA (1978), "Correlatos fisicoquímicos de la intoxicación por alcohol", Neurofarmacología , 17 (7): 451–61, doi :10.1016/0028-3908(78)90050-3, PMID 567755, S2CID 19914287.
- ^ ab Wysocki, CJ; Dalton, P. (1996), Umbrales de olor e irritación para el 1-butanol en humanos , Filadelfia: Monell Chemical Senses Center, citado en n-Butanol (PDF) , Informe de evaluación inicial de los SIDS, Ginebra: Programa de las Naciones Unidas para el Medio Ambiente, abril de 2005.
- ^ Cometto-Muñiz, J. Enrique; Cain, William S. (1998), "Sensibilidad olfativa y trigémina: comparación de modalidades y métodos de medición", Int. Arch. Occup. Environ. Health , 71 (2): 105–10, Bibcode :1998IAOEH..71..105C, doi :10.1007/s004200050256, PMID 9580447, S2CID 25246408.





