Buckminsterfullereno
| |||
| Nombres | |||
|---|---|---|---|
| Pronunciación | / ˌ b ʌ k m ɪ n s t ər ˈ f ʊ l ə r iː n / | ||
| Nombre IUPAC preferido (C 60 - I h )[5,6]fulereno [1] | |||
| Otros nombres Buckyballs; Fullereno-C 60 ; [60]fulereno | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 5901022 | |||
| EBICh | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.156.884 | ||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD |
| ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C60 | |||
| Masa molar | 720,660 g·mol −1 | ||
| Apariencia | Cristales oscuros con forma de aguja | ||
| Densidad | 1,65 g/ cm3 | ||
| insoluble en agua | |||
| Presión de vapor | 0,4–0,5 Pa (T ≈ 800 K); 14 Pa (T ≈ 900 K) [2] | ||
| Estructura | |||
| Cúbica centrada en las caras, cF1924 | |||
| Fm 3 m, n.º 225 | |||
a = 1,4154 nm | |||
| Peligros | |||
| Etiquetado SGA : | |||
 | |||
| Advertencia | |||
| H315 , H319 , H335 | |||
| P261 , P264 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332+P313 , P337+P313 , P362 , P403+P233 , P405 , P501 | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
| Part of a series of articles on |
| Nanomaterials |
|---|
 |
| Carbon nanotubes |
| Fullerenes |
|
| Other nanoparticles |
| Nanostructured materials |
El buckminsterfullereno es un tipo de fulereno con la fórmula C60 . Tiene una estructura de anillo fusionado en forma de jaula ( icosaedro truncado ) formada por veinte hexágonos y doce pentágonos , y se asemeja a un balón de fútbol . Cada uno de sus 60 átomos de carbono está unido a sus tres vecinos.
El buckminsterfullereno es un sólido negro que se disuelve en disolventes de hidrocarburos para producir una solución violeta. La sustancia se descubrió en 1985 y ha sido objeto de intensos estudios, aunque se han encontrado pocas aplicaciones en el mundo real.
Las moléculas de buckminsterfullereno (o de fulerenos en general) se denominan comúnmente buckybolas . [3] [4]
Aparición
El buckminsterfullereno es el fulereno natural más común. Se pueden encontrar pequeñas cantidades en el hollín . [5] [6]
También existe en el espacio . Se ha observado C 60 neutro en nebulosas planetarias [7] y en varios tipos de estrellas . [8] La forma ionizada, C 60+ , se ha identificado en el medio interestelar , [9] donde es la causa de varias características de absorción conocidas como bandas interestelares difusas en el infrarrojo cercano. [10]
Historia

Las predicciones teóricas de las moléculas de buckminsterfullereno aparecieron a finales de los años 1960 y principios de los años 1970. [11] [12] [13] [14] Fue generado por primera vez en 1984 por Eric Rohlfing, Donald Cox y Andrew Kaldor [14] [15] utilizando un láser para vaporizar carbono en un haz de helio supersónico, aunque el grupo no se dio cuenta de que se había producido buckminsterfullereno. En 1985 su trabajo fue repetido por Harold Kroto , James R. Heath , Sean C. O'Brien, Robert Curl y Richard Smalley en la Universidad Rice , quienes reconocieron la estructura de C 60 como buckminsterfullereno. [16]
Al mismo tiempo, pero sin conexión con el trabajo de Kroto-Smalley, los astrofísicos estaban trabajando con espectroscopistas para estudiar las emisiones infrarrojas de las estrellas gigantes de carbono rojo. [17] [18] [19] Smalley y su equipo pudieron utilizar una técnica de vaporización láser para crear cúmulos de carbono que potencialmente podrían emitir infrarrojos en la misma longitud de onda que la emitida por la estrella de carbono rojo. [17] [20] Por lo tanto, a Smalley y su equipo les llegó la inspiración de utilizar la técnica láser sobre grafito para generar fulerenos.
Utilizando la evaporación láser del grafito, el equipo de Smalley encontró cúmulos de C n (donde n > 20 e incluso) de los cuales los más comunes fueron C 60 y C 70 . Se utilizó un disco de grafito sólido giratorio como superficie desde la que se vaporizó el carbono utilizando un rayo láser que creaba plasma caliente que luego se pasaba a través de una corriente de gas helio de alta densidad. [21] Las especies de carbono se enfriaron e ionizaron posteriormente, lo que dio como resultado la formación de cúmulos. Los cúmulos variaban en masas moleculares, pero Kroto y Smalley encontraron predominio en un cúmulo de C 60 que podría mejorarse aún más permitiendo que el plasma reaccionara durante más tiempo. También descubrieron que C 60 es una molécula similar a una jaula, un icosaedro truncado regular . [17] [21]
La evidencia experimental, un pico fuerte en 720 unidades de masa atómica , indicó que se estaba formando una molécula de carbono con 60 átomos de carbono, pero no proporcionó información estructural. El grupo de investigación concluyó después de experimentos de reactividad que la estructura más probable era una molécula esferoidal. La idea se racionalizó rápidamente como la base de una estructura de jaula cerrada con simetría icosaédrica . [11]
Kroto, Curl y Smalley recibieron el Premio Nobel de Química en 1996 por su papel en el descubrimiento del buckminsterfullereno y la clase de moléculas relacionadas, los fulerenos . [11]
En 1989, los físicos Wolfgang Krätschmer , Konstantinos Fostiropoulos y Donald R. Huffman observaron absorciones ópticas inusuales en películas delgadas de polvo de carbono (hollín). El hollín se había generado mediante un proceso de arco entre dos electrodos de grafito en una atmósfera de helio donde el material del electrodo se evapora y se condensa formando hollín en la atmósfera de extinción. Entre otras características, los espectros IR del hollín mostraron cuatro bandas discretas en estrecha concordancia con las propuestas para C 60 . [22] [23]
Otro artículo sobre la caracterización y verificación de la estructura molecular siguió en el mismo año (1990) a partir de sus experimentos de película delgada, y también detalló la extracción de un material evaporable y soluble en benceno del hollín generado por arco. Este extracto tuvo un análisis de cristal de rayos X y TEM consistente con matrices de moléculas esféricas de C 60 , aproximadamente 1,0 nm en diámetro de van der Waals [24] así como la masa molecular esperada de 720 Da para C 60 (y 840 Da para C 70 ) en sus espectros de masas . [25] El método fue simple y eficiente para preparar el material en cantidades de gramos por día (1990) que ha impulsado la investigación de fulerenos y aún hoy se aplica para la producción comercial de fulerenos.
El descubrimiento de rutas prácticas hacia el C 60 condujo a la exploración de un nuevo campo de la química que involucra el estudio de los fulerenos.
Etimología
Los descubridores del alótropo bautizaron la molécula recién descubierta en honor al arquitecto estadounidense R. Buckminster Fuller , que diseñó muchas estructuras de domo geodésico que se parecen al C 60 y que había fallecido en 1983, el año anterior al descubrimiento. [11] Otro nombre común para el buckminsterfullereno es "buckybolas". [26] [27]
Síntesis
El hollín se produce por ablación láser de grafito o pirólisis de hidrocarburos aromáticos . Los fulerenos se extraen del hollín con disolventes orgánicos utilizando un extractor Soxhlet . [28] Este paso produce una solución que contiene hasta un 75% de C 60 , así como otros fulerenos. Estas fracciones se separan mediante cromatografía . [29] Generalmente, los fulerenos se disuelven en un hidrocarburo o hidrocarburo halogenado y se separan utilizando columnas de alúmina. [30]
Estructura
El buckminsterfullereno es un icosaedro truncado con 60 vértices , 32 caras (20 hexágonos y 12 pentágonos donde ningún pentágono comparte un vértice) y 90 aristas (60 aristas entre anillos de 5 y 6 miembros y 30 aristas compartidas entre anillos de 6 y 6 miembros), con un átomo de carbono en los vértices de cada polígono y un enlace a lo largo de cada arista del polígono. El diámetro de van der Waals de un C
60La molécula mide aproximadamente 1,01 nanómetros (nm). El diámetro de núcleo a núcleo de una molécula de C
60La molécula mide aproximadamente 0,71 nm. La C
60La molécula tiene dos longitudes de enlace. Los enlaces anulares 6:6 (entre dos hexágonos) pueden considerarse " enlaces dobles " y son más cortos que los enlaces 6:5 (entre un hexágono y un pentágono). Su longitud de enlace promedio es de 0,14 nm. Cada átomo de carbono en la estructura está unido covalentemente con otros 3. [31] Un átomo de carbono en el anillo C
60Puede sustituirse por un átomo de nitrógeno o boro, obteniéndose un C
59N o C 59 B respectivamente. [32]

Propiedades
| Centrado por | Vértice | Borde 5-6 | Borde 6–6 | Cara hexagonal | Cara del Pentágono |
|---|---|---|---|---|---|
| Imagen |  | 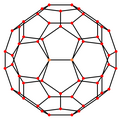 | 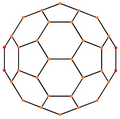 | 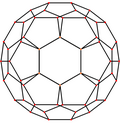 |  |
Simetría proyectiva | [2] | [2] | [2] | [6] | [10] |
Durante un tiempo, el buckminsterfullereno fue la molécula conocida más grande que se observó que exhibía dualidad onda-partícula . [33] En 2020, la molécula de tinte ftalocianina exhibió la dualidad que se atribuye más famosamente a la luz, los electrones y otras partículas y moléculas pequeñas. [34]
Solución

| Solvente | Solubilidad (g/L) |
|---|---|
| 1-cloronaftaleno | 51 |
| 1-metilnaftaleno | 33 |
| 1,2-diclorobenceno | 24 |
| 1,2,4-trimetilbenceno | 18 |
| tetrahidronaftaleno | 16 |
| disulfuro de carbono | 8 |
| 1,2,3-tribromopropano | 8 |
| xileno | 5 |
| bromoform | 5 |
| cumeno | 4 |
| tolueno | 3 |
| benceno | 1.5 |
| tetracloruro de carbono | 0,447 |
| cloroformo | 0,25 |
| hexano | 0,046 |
| ciclohexano | 0,035 |
| tetrahidrofurano | 0,006 |
| acetonitrilo | 0,004 |
| metanol | 0,00004 |
| agua | 1,3 × 10 −11 |
| pentano | 0,004 |
| octano | 0,025 |
| isooctano | 0,026 |
| decano | 0,070 |
| dodecano | 0,091 |
| tetradecano | 0,126 |
| dioxano | 0,0041 |
| mesitileno | 0,997 |
| diclorometano | 0,254 |

60solución, que muestra una absorción disminuida de la luz azul (~450 nm) y roja (~700 nm) que da como resultado el color púrpura.
Los fulerenos son poco solubles en disolventes aromáticos y disulfuro de carbono , pero insolubles en agua. Las soluciones de C 60 puro tienen un color púrpura intenso que deja un residuo marrón al evaporarse. La razón de este cambio de color es el ancho de energía relativamente estrecho de la banda de niveles moleculares responsables de la absorción de luz verde por moléculas individuales de C 60. Por lo tanto, las moléculas individuales transmiten algo de luz azul y roja, lo que da como resultado un color púrpura. Al secarse, la interacción intermolecular da como resultado la superposición y el ensanchamiento de las bandas de energía, eliminando así la transmitancia de luz azul y causando el cambio de color de púrpura a marrón. [17]
do
60cristaliza con algunos disolventes en la red ("solvatos"). Por ejemplo, la cristalización de C 60 a partir de una solución de benceno produce cristales triclínicos con la fórmula C 60 ·4C 6 H 6 . Al igual que otros solvatos, este libera fácilmente benceno para dar el habitual C 60 cúbico centrado en las caras . Cristales de tamaño milimétrico de C 60 y C
70Se pueden cultivar a partir de solución tanto para solvatos como para fulerenos puros. [38] [39]
Sólido


60en cristal.
En el buckminsterfullereno sólido, las moléculas C 60 adoptan el motivo fcc ( cubico centrado en las caras ). Comienzan a rotar aproximadamente a −20 °C. Este cambio está asociado con una transición de fase de primer orden a una estructura fcc y un aumento pequeño, pero abrupto, en la constante de red de 1,411 a 1,4154 nm. [40]
do
60El sólido es tan blando como el grafito , pero cuando se comprime a menos del 70% de su volumen se transforma en una forma superdura de diamante (ver nanobarra de diamante agregada ). C
60Las películas y las soluciones tienen fuertes propiedades ópticas no lineales; en particular, su absorción óptica aumenta con la intensidad de la luz (absorción saturable).
do
60Forma un sólido parduzco con un umbral de absorción óptica de ≈1,6 eV. [41] Es un semiconductor de tipo n con una energía de activación baja de 0,1-0,3 eV; esta conductividad se atribuye a defectos intrínsecos o relacionados con el oxígeno. [42] El Fcc C 60 contiene huecos en sus sitios octaédricos y tetraédricos que son lo suficientemente grandes (0,6 y 0,2 nm respectivamente) para acomodar átomos de impurezas. Cuando se dopan metales alcalinos en estos huecos, el C 60 se convierte de semiconductor en conductor o incluso superconductor. [40] [43]
Reacciones químicas y propiedades
Redox (reacciones de transferencia de electrones)
do
60sufre seis reducciones reversibles de un solo electrón, generando finalmente C6−
60Su oxidación es irreversible. La primera reducción se produce a ≈-1,0 V ( Fc / Fc+
), lo que demuestra que C 60 es un aceptor de electrones reacio. C
60tiende a evitar tener dobles enlaces en los anillos pentagonales, lo que hace que la deslocalización de electrones sea deficiente y da como resultado C
60Al no ser " superaromático ", el C 60 se comporta como un alqueno deficiente en electrones . Por ejemplo, reacciona con algunos nucleófilos. [24] [44]
Hidrogenación
El C 60 exhibe un pequeño grado de carácter aromático, pero aún refleja caracteres localizados de enlaces C–C dobles y simples. Por lo tanto, el C 60 puede experimentar adición con hidrógeno para dar polihidrofullerenos. El C 60 también experimenta reducción de Birch . Por ejemplo, el C 60 reacciona con litio en amoníaco líquido, seguido de terc -butanol para dar una mezcla de polihidrofullerenos tales como C 60 H 18 , C 60 H 32 , C 60 H 36 , siendo C 60 H 32 el producto dominante. Esta mezcla de polihidrofullerenos puede reoxidarse con 2,3-dicloro-5,6-diciano-1,4-benzoquinona para dar C 60 nuevamente.
Existe un método de hidrogenación selectiva. La reacción de C 60 con 9,9′,10,10′-dihidroantraceno en las mismas condiciones, dependiendo del tiempo de reacción, da C 60 H 32 y C 60 H 18 respectivamente y de forma selectiva. [45]
Halogenación
La adición de flúor , cloro y bromo ocurre para C 60 . Los átomos de flúor son lo suficientemente pequeños para una adición 1,2, mientras que Cl 2 y Br 2 se agregan a átomos de C remotos debido a factores estéricos . Por ejemplo, en C 60 Br 8 y C 60 Br 24 , los átomos de Br están en posiciones 1,3 o 1,4 entre sí. Bajo diversas condiciones se puede producir una gran cantidad de derivados halogenados de C 60 , algunos con una selectividad extraordinaria en uno o dos isómeros sobre los otros posibles. La adición de flúor y cloro generalmente da como resultado un aplanamiento de la estructura de C 60 en una molécula con forma de tambor. [45]
Adición de átomos de oxígeno
Las soluciones de C 60 se pueden oxigenar para formar el epóxido C 60 O. La ozonización de C 60 en 1,2-xileno a 257 K produce un ozónido intermedio C 60 O 3 , que se puede descomponer en 2 formas de C 60 O. La descomposición de C 60 O 3 a 296 K produce el epóxido, pero la fotólisis produce un producto en el que el átomo de O forma un puente en el borde 5,6. [45]

Cicloadiciones
La reacción de Diels-Alder se emplea comúnmente para funcionalizar C 60 . La reacción de C 60 con el dieno sustituido apropiado da el aducto correspondiente.
La reacción de Diels-Alder entre C 60 y 3,6-diaril-1,2,4,5-tetrazinas produce C 62. El C 62 tiene una estructura en la que un anillo de cuatro miembros está rodeado por cuatro anillos de seis miembros.

Las moléculas de C 60 también se pueden acoplar a través de una cicloadición [2+2] , dando el compuesto con forma de mancuerna C 120. El acoplamiento se logra mediante molienda vibratoria de alta velocidad de C 60 con una cantidad catalítica de KCN . La reacción es reversible ya que C 120 se disocia nuevamente en dos moléculas de C 60 cuando se calienta a 450 K (177 °C; 350 °F). Bajo alta presión y temperatura, la cicloadición [2+2] repetida entre C 60 da como resultado cadenas y redes de fulerenos polimerizados. Estos polímeros permanecen estables a presión y temperatura ambiente una vez formados, y tienen propiedades electrónicas y magnéticas notablemente interesantes, como ser ferromagnéticos por encima de la temperatura ambiente. [45]
Reacciones de radicales libres
Las reacciones de C 60 con radicales libres ocurren fácilmente. Cuando C 60 se mezcla con un disulfuro RSSR, el radical C 60 SR• se forma espontáneamente tras la irradiación de la mezcla.
La estabilidad de la especie radical C 60 Y • depende en gran medida de los factores estéricos de Y. Cuando el haluro de terc -butilo se fotoliza y se le permite reaccionar con C 60 , se forma un enlace C–C reversible entre jaulas: [45]

Ciclopropanación (reacción de Bingel)
La ciclopropanación ( reacción de Bingel ) es otro método común para funcionalizar C 60 . La ciclopropanación de C 60 ocurre principalmente en la unión de 2 hexágonos debido a factores estéricos.
La primera ciclopropanación se llevó a cabo tratando el β-bromomalonato con C 60 en presencia de una base. La ciclopropanación también ocurre fácilmente con diazometanos . Por ejemplo, el difenildiazometano reacciona fácilmente con C 60 para dar el compuesto C 61 Ph 2 . [45] El derivado de éster metílico del ácido fenil-C 61 -butírico preparado a través de la ciclopropanación se ha estudiado para su uso en células solares orgánicas .
Reacciones redox – C60aniones y cationes
do60aniones
El LUMO en C 60 es triplemente degenerado, con una separación HOMO – LUMO relativamente pequeña. Esta pequeña brecha sugiere que la reducción de C 60 debería ocurrir a potenciales suaves que conducen a aniones fulleruro, [C 60 ] n − ( n = 1–6). Los potenciales de punto medio de la reducción de 1 electrón del buckminsterfullereno y sus aniones se dan en la siguiente tabla:
| Potencial de reducción de C 60 a 213 K | |
|---|---|
| Semirreacción | Este (V) |
| C 60 + e − ⇌ C− 60 | -0,169 |
| do− 60+ e − ⇌ C2− 60 | -0,599 |
| do2− 60+ e − ⇌ C3− 60 | -1,129 |
| do3− 60+ e − ⇌ C4− 60 | -1.579 |
| do4− 60+ e − ⇌ C5− 60 | -2.069 |
| do5− 60+ e − ⇌ C6− 60 | -2,479 |
El C 60 forma una variedad de complejos de transferencia de carga , por ejemplo con tetrakis(dimetilamino)etileno :
- C 60 + C 2 (NMe 2 ) 4 → [C 2 (NMe 2 ) 4 ] + [C 60 ] −
Esta sal exhibe ferromagnetismo a 16 K.
do60cationes
El C 60 se oxida con dificultad. Se han observado tres procesos de oxidación reversibles mediante voltametría cíclica con cloruro de metileno ultraseco y un electrolito de soporte con resistencia a la oxidación extremadamente alta y baja nucleofilia, como [ n Bu 4 N] [AsF 6 ]. [44]
| Potenciales de reducción de la oxidación del C 60 a bajas temperaturas | |
|---|---|
| Semirreacción | Este (V) |
| C 60 ⇌ C+ 60 | +1,27 |
| do+ 60⇌ C2+ 60 | +1,71 |
| do2+ 60⇌ C3+ 60 | +2,14 |
Complejos metálicos
El C 60 forma complejos similares a los alquenos más comunes. Se han descrito complejos de molibdeno , tungsteno , platino , paladio , iridio y titanio . Las especies de pentacarbonilo se producen mediante reacciones fotoquímicas .
- M(CO) 6 + C 60 → M( η 2 -C 60 )(CO) 5 + CO (M = Mo, W)
En el caso del complejo de platino, el ligando de etileno lábil es el grupo saliente en una reacción térmica:
- Pt( η 2 -C 2 H 4 )(PPh 3 ) 2 + C 60 → Pt( η 2 -C 60 )(PPh 3 ) 2 + C 2 H 4
También se han reportado complejos de titanoceno :
- ( η 5 - Cp ) 2 Ti( η 2 -(CH 3 ) 3 SiC≡CSi(CH 3 ) 3 ) + C 60 → ( η 5 -Cp) 2 Ti( η 2 -C 60 ) + (CH 3 ) 3 SiC≡CSi( CH3 ) 3
Precursores coordinadamente insaturados, como el complejo de Vaska , para aductos con C 60 :
- trans -Ir(CO)Cl(PPh 3 ) 2 + C 60 → Ir(CO)Cl( η 2 -C 60 )(PPh 3 ) 2
Se ha preparado un complejo de iridio de este tipo, [Ir( η 2 -C 60 )(CO)Cl(Ph 2 CH 2 C 6 H 4 OCH 2 Ph) 2 ], en el que el centro metálico proyecta dos "brazos" ricos en electrones que abrazan al huésped C 60. [46]
Fullerenos endoédricos
Los átomos de metal o ciertas moléculas pequeñas como H2 y gases nobles pueden encapsularse dentro de la jaula C60 . Estos fulerenos endoédricos se sintetizan generalmente dopando los átomos de metal en un reactor de arco o por evaporación láser. Estos métodos dan bajos rendimientos de fulerenos endoédricos, y un método mejor implica abrir la jaula, empaquetar los átomos o moléculas y cerrar la abertura utilizando ciertas reacciones orgánicas . Este método, sin embargo, aún es inmaduro y solo se han sintetizado unas pocas especies de esta manera. [47]
Los fulerenos endoédricos muestran propiedades químicas distintivas e intrigantes que pueden ser completamente diferentes de las del átomo o molécula encapsulados, así como del propio fulereno. Se ha demostrado que los átomos encapsulados realizan movimientos circulares dentro de la jaula C60 , y su movimiento se ha seguido mediante espectroscopia de RMN . [46]
Posibles aplicaciones en tecnología
Las propiedades de absorción óptica del C 60 coinciden con el espectro solar de una manera que sugiere que las películas basadas en C 60 podrían ser útiles para aplicaciones fotovoltaicas. Debido a su alta afinidad electrónica [48] es uno de los aceptores de electrones más comunes utilizados en células solares basadas en donantes/aceptores. Se han reportado eficiencias de conversión de hasta 5,7% en células de polímero C 60. [49]
Posibles aplicaciones en el ámbito de la salud
Ingestión y riesgos
El C 60 es sensible a la luz, [50] por lo que dejarlo expuesto a la luz provoca su degradación, volviéndose peligroso. La ingestión de soluciones de C 60 que han sido expuestas a la luz podría llevar al desarrollo de cáncer (tumores). [51] [52] Por lo que el manejo de productos de C 60 para ingestión humana requiere de medidas de precaución [52] como: elaboración en ambientes muy oscuros, envasado en botellas de gran opacidad y almacenamiento en lugares oscuros, y otras como el consumo en condiciones de poca luz y el uso de etiquetas para advertir sobre los problemas con la luz.
Se ha comprobado que las soluciones de C 60 disueltas en aceite de oliva o agua, siempre que se preserven de la luz, no son tóxicas para los roedores. [53]
De lo contrario, un estudio encontró que el C 60 permanece en el cuerpo durante más tiempo de lo habitual, especialmente en el hígado, donde tiende a acumularse y, por lo tanto, tiene el potencial de inducir efectos perjudiciales para la salud. [54]
Aceites con C60 y riesgos
En un experimento realizado entre 2011 y 2012 se administró una solución de C 60 en aceite de oliva a ratas, consiguiendo una prolongación importante de su esperanza de vida. [53] Desde entonces, muchos aceites con C 60 se han vendido como productos antioxidantes, pero esto no evita el problema de su sensibilidad a la luz, que puede volverlos tóxicos. Una investigación posterior confirmó que la exposición a la luz degrada las soluciones de C 60 en aceite, volviéndolas tóxicas y provocando un aumento "masivo" del riesgo de desarrollar cáncer (tumores) tras su consumo. [51] [52]
Para evitar la degradación por efecto de la luz, los aceites C 60 deben elaborarse en ambientes muy oscuros, envasarse en botellas de gran opacidad y conservarse en oscuridad, consumirse en condiciones de poca luz y acompañarse de etiquetas que adviertan sobre los peligros de la luz para el C 60. [ 52] [50]
Algunos productores han podido disolver el C 60 en agua para evitar posibles problemas con los aceites, pero eso no protegería al C 60 de la luz, por lo que se necesitan las mismas precauciones. [50]
Referencias
- ^ Unión Internacional de Química Pura y Aplicada (2014). Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013. The Royal Society of Chemistry . p. 325. doi :10.1039/9781849733069. ISBN . 978-0-85404-182-4.
- ^ Piacente; Gigli; Scardala; Giustini; Ferro (1995). "Presión de vapor del buckminsterfullereno C 60 ". J. Física. química . 99 (38): 14052–14057. doi :10.1021/j100038a041.
- ^ "Buckyball". Diccionario Oxford de inglés . Oxford University Press . Consultado el 13 de abril de 2024 .
- ^ Revista AZo de materiales en línea. AZoM.com. "Buckminsterfullereno". 2006.
- ^ Howard, Jack B.; McKinnon, J. Thomas; Makarovsky, Yakov; Lafleur, Arthur L.; Johnson, M. Elaine (1991). "Fullerenos C 60 y C 70 en llamas". Nature . 352 (6331): 139–141. Bibcode :1991Natur.352..139H. doi :10.1038/352139a0. PMID 2067575. S2CID 37159968.
- ^ Howard, J; Lafleur, A; Makarovsky, Y; Mitra, S; Pope, C; Yadav, T (1992). "Síntesis de fulerenos en combustión". Carbon . 30 (8): 1183–1201. Bibcode :1992Carbo..30.1183H. doi :10.1016/0008-6223(92)90061-Z.
- ^ Cami, J.; Bernard-Salas, J.; Peeters, E.; Malek, SE (2010). "Detección de C60 y C70 en una nebulosa planetaria joven". Science . 329 (5996): 1180–1182. Bibcode :2010Sci...329.1180C. doi :10.1126/science.1192035. PMID 20651118. S2CID 33588270.
- ^ Roberts, Kyle RG; Smith, Keith T.; Sarre, Peter J. (2012). "Detección de C60 en objetos estelares jóvenes incrustados, una estrella Herbig Ae/Be y una inusual estrella de rama gigante post-asintótica". Monthly Notices of the Royal Astronomical Society . 421 (4): 3277–3285. arXiv : 1201.3542 . Bibcode :2012MNRAS.421.3277R. doi : 10.1111/j.1365-2966.2012.20552.x . S2CID 118739732.
- ^ Berné, O.; Mulas, G.; Joblin, C. (2013). "Interstellar C60+". Astronomía y Astrofísica . 550 : L4. arXiv : 1211.7252 . Código Bibliográfico :2013A&A...550L...4B. doi :10.1051/0004-6361/201220730. S2CID 118684608.
- ^ Maier, JP; Gerlich, D.; Holz, M.; Campbell, EK (julio de 2015). "Confirmación de laboratorio de C 60+ como portador de dos bandas interestelares difusas". Nature . 523 (7560): 322–323. Bibcode :2015Natur.523..322C. doi :10.1038/nature14566. ISSN 1476-4687 . PMID 26178962. S2CID 205244293.
- ^ abcd Katz, 363
- ^ Osawa, E. (1970). Kagaku (Kioto) (en japonés). 25: 854
- ^ Jones, David EH (1966). "Moléculas huecas". New Scientist (32): 245.
- ^ ab Smalley, Richard E. (1 de julio de 1997). "Descubrimiento de los fulerenos". Reseñas de Física Moderna . 69 (3): 723–730. Bibcode :1997RvMP...69..723S. CiteSeerX 10.1.1.31.7103 . doi :10.1103/RevModPhys.69.723.
- ^ Rohlfing, Eric A; Cox, D. M; Kaldor, A (1984). "Producción y caracterización de haces de cúmulos de carbono supersónicos". Journal of Chemical Physics . 81 (7): 3322. Bibcode :1984JChPh..81.3322R. doi :10.1063/1.447994.
- ^ Kroto, HW; Heath, JR; O'Brien, SC; Curl, RF; Smalley, RE (1985). "C 60 : Buckminsterfullereno". Nature . 318 (6042): 162–163. Código Bibliográfico :1985Natur.318..162K. doi :10.1038/318162a0. S2CID 4314237.
- ^ abcd Dresselhaus, MS ; Dresselhaus, G.; Eklund, PC (1996). Ciencia de los fulerenos y los nanotubos de carbono . San Diego, CA: Academic Press. ISBN 978-012-221820-0.
- ^ Herbig, E. (1975). "Las bandas interestelares difusas. IV – la región 4400-6850 A". Astrophys. J . 196 : 129. Bibcode :1975ApJ...196..129H. doi :10.1086/153400.
- ^ Leger, A.; d'Hendecourt, L.; Verstraete, L.; Schmidt, W. (1988). "Candidatos notables para el portador de las bandas interestelares difusas: C 60 + y otros iones de carbono poliédricos". Astron. Astrophysics . 203 (1): 145. Bibcode :1988A&A...203..145L.
- ^ Dietz, TG; Duncan, MA; Powers, DE; Smalley, RE (1981). "Producción láser de haces supersónicos de grupos metálicos". J. Chem. Phys . 74 (11): 6511. Bibcode :1981JChPh..74.6511D. doi :10.1063/1.440991.
- ^ ab Kroto, HW; Salud, JR; O'Brien, SC; Curl, RF; Smalley, RE (1985). "C 60 : Buckminsterfullereno". Naturaleza . 318 (6042): 162–163. Código Bibliográfico :1985Natur.318..162K. doi :10.1038/318162a0. S2CID 4314237.
- ^ Actas de la conferencia "Objetos polvorientos en el universo", págs. 89-93, "Búsqueda de los espectros UV e IR de C60 en polvo de carbono producido en laboratorio" Archivado el 5 de septiembre de 2017 en Wayback Machine.
- ^ Krätschmer, W. (1990). "Los espectros de absorción infrarroja y ultravioleta del polvo de carbono producido en laboratorio: evidencia de la presencia de la molécula C60". Chemical Physics Letters . 170 (2–3): 167–170. Bibcode :1990CPL...170..167K. doi : 10.1016/0009-2614(90)87109-5 .
- ^ ab Buckminsterfullereno, C60 Archivado el 27 de febrero de 2021 en Wayback Machine . Universidad de Bristol. Chm.bris.ac.uk (13 de octubre de 1996). Recuperado el 25 de diciembre de 2011.
- ^ Krätschmer, W.; Lamb, Lowell D.; Fostiropoulos, K.; Huffman, Donald R. (1990). "C 60 sólido : una nueva forma de carbono". Nature . 347 (6291): 354–358. Código Bibliográfico :1990Natur.347..354K. doi :10.1038/347354a0. S2CID 4359360.
- ^ "¿Qué es una cúpula geodésica?". Colección R. Buckminster Fuller: arquitecto, teórico de sistemas, diseñador e inventor . Universidad de Stanford. 6 de abril de 2017. Archivado desde el original el 12 de enero de 2020. Consultado el 10 de junio de 2019 .
- ^ Revista AZo de materiales en línea. AZoM.com. "Buckminsterfullereno". 2006.
- ^ Girolami, GS; Rauchfuss, TB; Angelici, RJ (1999). Síntesis y técnica en química inorgánica . Mill Valley, CA: University Science Books. ISBN 978-0935702484.
- ^ Katz, 369-370
- ^ Shriver; Atkins (2010). Química inorgánica (Quinta edición). Nueva York: WH Freeman. pág. 356. ISBN 978-0-19-923617-6.
- ^ Gato, 364
- ^ Catalán, 374
- ^ Arndt, Markus; Nairz, Olaf; Vos-Andreae, Julián; Keller, Claudia; Van Der Zouw, Gerbrand; Zeilinger, Antón (1999). "Dualidad onda-partícula de C 60 ". Naturaleza . 401 (6754): 680–682. Código Bib :1999Natur.401..680A. doi :10.1038/44348. PMID 18494170. S2CID 4424892.
- ^ Lee, Chris (21 de julio de 2020). «Dualidad onda-partícula en acción: las grandes moléculas surfean en sus propias olas». Ars Technica . Archivado desde el original el 26 de septiembre de 2021 . Consultado el 26 de septiembre de 2021 .
- ^ Beck, Mihály T.; Mandi, Géza (1997). "Solubilidad del C 60 ". Fullerenos, Nanotubos y Nanoestructuras de Carbono . 5 (2): 291–310. doi :10.1080/15363839708011993.
- ^ Bezmel'nitsyn, VN; Eletskii, AV; Okun', MV (1998). "Fullerenos en soluciones". Physics-Uspekhi . 41 (11): 1091–1114. Código Bibliográfico :1998PhyU...41.1091B. doi :10.1070/PU1998v041n11ABEH000502. S2CID 250785669.
- ^ Ruoff, RS; Tse, Doris S.; Malhotra, Ripudaman; Lorents, Donald C. (1993). "Solubilidad del fulereno (C 60 ) en una variedad de solventes". Journal of Physical Chemistry . 97 (13): 3379–3383. doi :10.1021/j100115a049.
- ^ Talyzin, AV (1997). "Transición de fase C 60 −C 60 *4C 6 H 6 en benceno líquido". Journal of Physical Chemistry B . 101 (47): 9679–9681. doi :10.1021/jp9720303.
- ^ Talyzin, AV; Engström, I. (1998). "C70 en soluciones de benceno, hexano y tolueno". Journal of Physical Chemistry B . 102 (34): 6477–6481. doi :10.1021/jp9815255.
- ^ por Katz, 372
- ^ Gato, 361
- ^ Catalán, 379
- ^ Gato, 381
- ^ ab Reed, Christopher A.; Bolskar, Robert D. (2000). "Aniones de fulleruro discretos y cationes de fullerenio". Chemical Reviews . 100 (3): 1075–1120. doi :10.1021/cr980017o. PMID 11749258. S2CID 40552372.
- ^ abcdef Catherine E. Housecroft; Alan G. Sharpe (2008). "Capítulo 14: Los elementos del grupo 14". Química inorgánica (3.ª ed.). Pearson. ISBN 978-0-13-175553-6.
- ^ de Jonathan W. Steed y Jerry L. Atwood (2009). Química supramolecular (2.ª edición). Wiley. ISBN 978-0-470-51233-3.
- ^ Rodríguez-Fortea, Antonio; Balch, Alan L.; Poblet, Josep M. (2011). "Metalofullerenos endoédricos: una asociación única anfitrión-invitado". Química. Soc. Rdo . 40 (7): 3551–3563. doi :10.1039/C0CS00225A. PMID 21505658.
- ^ Ryuichi, Mitsumoto (1998). "Estudio de estructuras electrónicas y enlaces químicos de fulerenos fluorados". J. Phys. Chem. A . 102 (3): 552–560. Código Bibliográfico :1998JPCA..102..552M. doi :10.1021/jp972863t.
- ^ Shang, Yuchen; Liu, Zhaodong; Dong, Jiajun; Yao, Mingguang; Yang, Zhenxing; Li, Quanjun; Zhai, Chunguang; Shen, Fangren; Hou, Xuyuan; Wang, Lin; Zhang, Nianqiang (noviembre de 2021). "Carbón amorfo a granel ultraduro de fullereno colapsado". Naturaleza . 599 (7886): 599–604. Código Bib :2021Natur.599..599S. doi :10.1038/s41586-021-03882-9. ISSN 1476-4687. PMID 34819685. S2CID 244643471. Archivado desde el original el 26 de noviembre de 2021 . Consultado el 26 de noviembre de 2021 .
- ^ abc "Degradación del C60 por la luz" (PDF) . Nature . Vol. 351. 23 de mayo de 1991.
- ^ ab Grohn, Kristopher J. "Comp grad leads research". WeyburnReview . Archivado desde el original el 2021-04-17 . Consultado el 2021-04-17 .
- ^ abcd Grohn, Kristopher J.; et al. "El C60 en el aceite de oliva provoca toxicidad dependiente de la luz" (PDF) . Archivado (PDF) desde el original el 2021-04-15 . Consultado el 2021-04-15 .
- ^ ab Baati, Tarek; Moussa, Fathi (junio de 2012). "La prolongación de la vida útil de las ratas mediante la administración oral repetida de [60]fullereno". Biomateriales . 33 (19): 4936–4946. doi :10.1016/j.biomaterials.2012.03.036. PMID 22498298.
- ^ Shipkowski, KA; Sanders, JM; McDonald, JD; Walker, NJ; Waidyanatha, S. (2019). "Disposición del fulereno C60 en ratas tras la administración intratraqueal o intravenosa". Xenobiotica; el destino de los compuestos extraños en los sistemas biológicos . 49 (9): 1078–1085. doi :10.1080/00498254.2018.1528646. PMC 7005847 . PMID 30257131.
Bibliografía
- Katz, EA (2006). "Películas delgadas de fulerenos como material fotovoltaico". En Sōga, Tetsuo (ed.). Materiales nanoestructurados para la conversión de energía solar . Elsevier. págs. 361–443. ISBN 978-0-444-52844-5.
Lectura adicional
- Kroto, HW; Heath, JR; O'Brien, SC; Curl, RF; Smalley, RE (noviembre de 1985). "C 60 : Buckminsterfullereno". Nature . 318 (14): 162–163. Código Bibliográfico :1985Natur.318..162K. doi :10.1038/318162a0. S2CID 4314237.– describiendo el descubrimiento original del C 60
- Hebgen, Peter; Goel, Anish; Howard, Jack B.; Rainey, Lenore C.; Vander Sande, John B. (2000). "Fullerenos y nanoestructuras en llamas de difusión" (PDF) . Actas del Instituto de Combustión . 28 : 1397–1404. CiteSeerX 10.1.1.574.8368 . doi :10.1016/S0082-0784(00)80355-0.– informe que describe la síntesis de C 60 con investigaciones sobre combustión publicado en 2000 en el 28º Simposio Internacional sobre Combustión
Enlaces externos
- Historia del descubrimiento del C60 realizado por el Departamento de Química de la Universidad de Bristol
- Una breve descripción del buckminsterfullereno descrito por la Universidad de Wisconsin-Madison
- Un informe del Ming Kai College que detalla las propiedades del buckminsterfullereno
- Artículo de Donald R. Huffman y Wolfgang Krätschmer sobre la síntesis de C60 publicado en Nature en 1990
- Una descripción detallada de C60 por el Laboratorio Nacional de Oak Ridge
- Un artículo sobre el buckminsterfullereno en Connexions Science Encyclopaedia
- Amplios datos estadísticos recopilados por la Universidad de Sussex sobre las propiedades cuantitativas numéricas del buckminsterfullereno
- Un portal web dedicado al buckminsterfullereno, creado y respaldado por la Universidad de Bristol
- Otro portal web dedicado al buckminsterfullereno, creado y respaldado por el Departamento de Química de la Universidad de Bristol.
- Un breve artículo dedicado íntegramente al C60 y su descubrimiento, estructura, producción, propiedades y aplicaciones.
- Artículo completo de la American Chemical Society sobre el buckminsterfullereno
- Buckminsterfullereno en la Tabla Periódica de Vídeos (Universidad de Nottingham)










