Bifenilo
 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido 1,1′-Bifenilo | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 3DMet |
|
| 1634058 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.001.967 |
| Número CE |
|
| Número E | E230 (conservantes) |
| 3808 | |
| BARRIL | |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 3077 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C12H10 | |
| Masa molar | 154,212 g·mol −1 |
| Apariencia | Cristales incoloros a amarillo pálido. |
| Olor | agradable [1] |
| Densidad | 1,04 g/cm3 [ 2] |
| Punto de fusión | 69,2 °C (156,6 °F; 342,3 K) [2] |
| Punto de ebullición | 255 °C (491 °F; 528 K) [2] |
| 4,45 mg/L [2] | |
| Presión de vapor | 0,005 mmHg (20 °C) [1] |
| −103,25·10 −6 cm3 / mol | |
| Peligros | |
| Etiquetado SGA : | |
  | |
| Advertencia | |
| H315 , H319 , H335 , H410 | |
| P261 , P264 , P271 , P273 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332+P313 , P337+P313 , P362 , P391 , P403+P233 , P405 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | 113 °C (235 °F; 386 K) [2] |
| 540 °C (1004 °F; 813 K) [2] | |
| Límites de explosividad | 0,6–5,8 % [1] |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | 2400 mg/kg (oral, conejo) 3280 mg/kg (oral, rata) 1900 mg/kg (oral, ratón) 2400 mg/kg (oral, rata) [3] |
| NIOSH (límites de exposición a la salud en EE. UU.): | |
PEL (Permisible) | TWA 1 mg/m3 ( 0,2 ppm) [1] |
REL (recomendado) | TWA 1 mg/m3 ( 0,2 ppm) [1] |
IDLH (Peligro inmediato) | 100 mg/m3 [ 1] |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
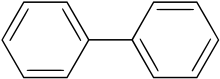
El bifenilo (también conocido como difenilo , fenilbenceno , 1,1′-bifenilo , limoneno [4] o BP ) es un compuesto orgánico que forma cristales incoloros. Particularmente en la literatura más antigua, los compuestos que contienen el grupo funcional que consiste en bifenilo menos un hidrógeno (el sitio en el que está unido) pueden usar los prefijos xenilo o difenililo . [5]
Tiene un olor agradable y característico. El bifenilo es un hidrocarburo aromático con una fórmula molecular (C 6 H 5 ) 2 . Es conocido como material de partida para la producción de bifenilos policlorados (PCB), que en su día se utilizaban ampliamente como fluidos dieléctricos y agentes de transferencia de calor .
El bifenilo también es un intermediario para la producción de una serie de otros compuestos orgánicos como emulsionantes , abrillantadores ópticos , productos fitosanitarios y plásticos . El bifenilo es insoluble en agua, pero soluble en disolventes orgánicos típicos. La molécula de bifenilo consta de dos anillos de fenilo conectados .
Propiedades y ocurrencia
El bifenilo es un sólido a temperatura ambiente, con un punto de fusión de 69,2 °C (156,6 °F). En la fase gaseosa, la molécula existe en dos formas enantiomórficas retorcidas con un ángulo entre los planos de los dos anillos de 44,4°. En el sólido a temperatura ambiente, el bifenilo es cristalino con el grupo espacial P2 1 /c, que no permite cristales quirales . En lugar de que haya un potencial de doble pozo que implique las dos conformaciones retorcidas, la energía potencial se minimiza en torsión cero. [6] [7]
El bifenilo se encuentra de forma natural en el alquitrán de hulla , el petróleo crudo y el gas natural y se puede aislar de estas fuentes mediante destilación . [8] Se produce industrialmente como un subproducto de la desalquilación del tolueno para producir metano :
- C6H5CH3 + C6H6 → C6H5 −C6H5 + CH4
La otra ruta principal es la deshidrogenación oxidativa del benceno :
- 2C6H6 + ½O2 → C6H5 −C6H5 + H2O
Anualmente se producen 40.000.000 kg por estas rutas. [9]
En el laboratorio, el bifenilo también se puede sintetizar tratando el bromuro de fenilmagnesio con sales de cobre (II).
También se puede preparar utilizando sales de diazonio . Cuando se trata la anilina con NaNO 2 + HCl diluido a 5 °C, se obtiene cloruro de diazonio-benceno. Cuando este reacciona con benceno, se forma bifenilo. Esto se conoce como reacción de Gomberg-Bachmann .
Reacciones y usos
Al carecer de grupos funcionales, el bifenilo es poco reactivo, lo que explica su principal aplicación: en una mezcla eutéctica con éter difenílico , como agente de transferencia de calor. Esta mezcla es estable a 400 °C. [9]
El bifenilo sufre una sulfonación que, seguida de una hidrólisis básica, produce p -hidroxibifenilo y p , p' -dihidroxibifenilo, que son fungicidas útiles. En otras reacciones de sustitución , sufre halogenación. Los bifenilos policlorados fueron en su día pesticidas populares. [9]
Radical bifenilo de litio
El bifenilo de litio contiene el anión radical , que es altamente reductor (-3,1 V frente a Fc +/0 ). Se han caracterizado varios solvatos de sales de metales alcalinos del anión bifenilo mediante cristalografía de rayos X. [10] Estas sales, normalmente preparadas in situ, son agentes reductores versátiles. [11] El bifenilo de litio ofrece algunas ventajas en relación con el nafteno de litio relacionado . [12] Relacionado con Li/bifenilo está el derivado con grupos terc -butilo en el bifenilo. [13]
Estereoquímica
La rotación alrededor del enlace simple en el bifenilo, y especialmente en sus derivados orto-sustituidos , está impedida estéricamente . Por esta razón, algunos bifenilos sustituidos muestran atropisomería ; es decir, los isómeros individuales C2-simétricos son ópticamente estables . Algunos derivados, así como moléculas relacionadas como BINAP , encuentran aplicación como ligandos en la síntesis asimétrica . En el caso del bifenilo no sustituido, el ángulo de torsión de equilibrio es de 44,4° y las barreras de torsión son bastante pequeñas, 6,0 kJ/mol a 0° y 6,5 kJ/mol a 90°. [14] La adición de sustituyentes orto aumenta en gran medida la barrera: en el caso del derivado 2,2'-dimetil, la barrera es de 17,4 kcal/mol (72,8 kJ/mol). [15]
Compuestos de bifenilo
Los bifenilos sustituidos tienen muchos usos. Se preparan mediante varias reacciones de acoplamiento, incluidas la reacción de Suzuki-Miyaura y la reacción de Ullmann . Los bifenilos policlorados se usaban alguna vez como fluidos refrigerantes y aislantes y los bifenilos polibromados son retardantes de llama . El motivo bifenilo también aparece en medicamentos como diflunisal y telmisartán . La abreviatura E7 representa una mezcla de cristal líquido que consta de varios cianobifenilos con largas colas alifáticas que se utilizan comercialmente en pantallas de cristal líquido ( 5CB , 7CB, 8OCB y 5CT [16] ). Una variedad de derivados de bencidina se utilizan en tintes y polímeros. La investigación sobre los candidatos a cristales líquidos de bifenilo se centra principalmente en moléculas con cabezas altamente polares (por ejemplo, grupos ciano o haluro) y colas alifáticas. Es parte del grupo activo en el antibiótico oritavancina .
Seguridad y bioactividad
El bifenilo impide el crecimiento de mohos y hongos , por lo que se utiliza como conservante ( E230 , en combinación con E231, E232 y E233), en particular en la conservación de frutas cítricas durante el transporte. Ya no está aprobado como aditivo alimentario en la Unión Europea.
El bifenilo es levemente tóxico, pero puede degradarse biológicamente mediante su conversión en compuestos no tóxicos. Algunas bacterias son capaces de hidroxilar el bifenilo y sus bifenilos policlorados (PCB). [17]
Véase también
- Naftaleno , donde los anillos están fusionados.
- Terfenilo , análogo de tres anillos
- bitiofeno
- Polipirrol
Notas
- ^ abcdef Guía de bolsillo del NIOSH sobre peligros químicos. "#0239". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ abcdef Registro en la base de datos de sustancias GESTIS del Instituto de Seguridad y Salud Ocupacional
- ^ "Difenilo". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH). 4 de diciembre de 2014. Consultado el 17 de marzo de 2015 .
- ^ "Bifenilo". NIST Chemistry WebBook . Instituto Nacional de Estándares y Tecnología de EE. UU .Un nombre poco conocido, según "Limonene". Archivo de Molécula de la Semana . Sociedad Química Estadounidense . 1 de noviembre de 2021.
- ^ "Beilsteins Handbuch der organischen Chemie, volumen 5".
- ^ Dr. Bruno Landeros-Rivera, Jesús Hernández-Trujillo (15 de diciembre de 2021). "Control de la conformación molecular y empaquetamiento cristalino de derivados de bifenilo". Chemistry Europe . 87 . doi :10.1002/cplu.202100492.
- ^ Landeros-Rivera, Bruno; Jancik, Vojtech; Moreno-Esparza, Rafael; Martínez Otero, Diego; Hernández-Trujillo, Jesús (27 de mayo de 2021). "Interacciones no covalentes en el cristal de bifenilo: ¿es el conformador plano un estado de transición?". Química Europa . 27 (46): 11912–11918. doi :10.1002/chem.202101490. ISSN 0947-6539. PMID 34043851.
- ^ Adams, NG; Richardson, DM (1953). "Aislamiento e identificación de bifenilos del petróleo crudo de West Edmond". Química analítica . 25 (7): 1073–1074. doi :10.1021/ac60079a020.
- ^ abc Griesbaum, Karl; Behr, Arno; Biedenkapp, Dieter; Voges, Heinz-Werner; Garbe, Dorotea; Paetz, cristiano; Collin, Gerd; Mayer, Dieter; Höke, Hartmut (2000), "Hidrocarburos", Enciclopedia de química industrial de Ullmann , doi :10.1002/14356007.a13_227, ISBN 978-3-527-30385-4
- ^ Castillo, Maximiliano; Metta-Magaña, Alejandro J.; Fortier, Skye (2016). "Aislamiento de arenuros de metales alcalinos cuantificables gravimétricamente utilizando 18-corona-6". New Journal of Chemistry . 40 (3): 1923–1926. doi :10.1039/C5NJ02841H.
- ^ Yanagisawa, Akira; Yasue, Katsutaka; Yamamoto, Hisashi (1997). "Carboxilación regio- y estereoselectiva de reactivos de bario alílico: ácido (E)-4,8-dimetil-3,7-nonadienoico". Org. Synth . 74 : 178. doi :10.15227/orgsyn.074.0178.
- ^ Rieke, Reuben D.; Wu, Tse-Chong; Rieke, Loretta I. (1995). "Calcio altamente reactivo para la preparación de reactivos organocálcicos: haluros de calcio 1-adamantil y su adición a cetonas: 1-(1-adamantil)ciclohexanol". Org. Synth . 72 : 147. doi :10.15227/orgsyn.072.0147.
- ^ Mudryk, Boguslaw; Cohen, Theodore (1995). "1,3-Dioles a partir de β-litioalcóxidos de litio generados por la litiación reductora de epóxidos: 2,5-dimetil-2,4-hexanodiol". Org. Synth . 72 : 173. doi :10.15227/orgsyn.072.0173.
- ^ Mikael P. Johansson y Jeppe Olsen (2008). "Barreras de torsión y ángulo de equilibrio del bifenilo: conciliación de la teoría con el experimento". J. Chem. Theory Comput . 4 (9): 1460–1471. doi :10.1021/ct800182e. PMID 26621432.
- ^ B. Testa (1982). "La geometría de las moléculas: principios básicos y nomenclaturas". En Christoph Tamm (ed.). Estereoquímica . Elsevier. pág. 18.
- ^ Mouquinho, Ana; Saavedra, María; Maiau, Alejandro; Petrova, Krasimira; Barros, M. Teresa; Figueirinhas, JL; Sotomayor, João (30 de junio de 2011). "Películas basadas en nuevos monómeros de metacrilato: síntesis, caracterización y propiedades electroópticas". Cristales Moleculares y Cristales Líquidos . 542 (1): 132/[654]–140/[662]. doi :10.1080/15421406.2011.570154. S2CID 97514765.
- ^ "Degradación de bifenilo - Streptomyces coelicolor, en la base de datos GenomeNet". genome.jp .
Referencias
- "Aislamiento e identificación de bifenilos del petróleo crudo de West Edmond". NG Adams y DM Richardson. Química analítica 1953 25 (7), 1073–1074.
- Bifenilo (1,1-Bifenilo) . Wiley/VCH, Weinheim (1991), ISBN 3-527-28277-7 .
Enlaces externos
- Ficha internacional de seguridad química 0106
- CDC - Guía de bolsillo de NIOSH sobre peligros químicos
- Inventario Nacional de Contaminantes - Bifenilo
- Hoja de datos de seguridad externa




![{\displaystyle {\ce {Ph-NH2->[{\text{NaNO}}_{2}{\text{(ac), HCl}}][T{\text{=273-278K}}]Ph-N2+->[{\text{Ph-H, Δ}}]Ph-Ph}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e967b1efa92a4e8fedb8b83b1bae2c4666216da4)