Auxiliar quiral
En estereoquímica , un auxiliar quiral es un grupo o unidad estereogénica que se incorpora temporalmente a un compuesto orgánico para controlar el resultado estereoquímico de la síntesis. [1] [2] La quiralidad presente en el auxiliar puede sesgar la estereoselectividad de una o más reacciones posteriores. El auxiliar puede luego recuperarse típicamente para su uso futuro.

La mayoría de las moléculas biológicas y los objetivos farmacéuticos existen como uno de dos enantiómeros posibles ; en consecuencia, las síntesis químicas de productos naturales y agentes farmacéuticos se diseñan con frecuencia para obtener el objetivo en forma enantioméricamente pura. [3] Los auxiliares quirales son una de las muchas estrategias disponibles para los químicos sintéticos para producir selectivamente el estereoisómero deseado de un compuesto dado. [4]
Los auxiliares quirales fueron introducidos por Elias James Corey en 1975 [5] con el 8-fenilmentol quiral y por Barry Trost en 1980 con el ácido mandélico quiral. El compuesto de mentol es difícil de preparar y, como alternativa, JK Whitesell introdujo el trans-2-fenil-1-ciclohexanol en 1985.
Síntesis asimétrica
Los auxiliares quirales se incorporan a las rutas sintéticas para controlar la configuración absoluta de los centros estereogénicos. La síntesis de David A. Evans del macrólido citovaricina, considerada un clásico, utiliza auxiliares quirales de oxazolidinona para una reacción de alquilación asimétrica y cuatro reacciones aldólicas asimétricas, estableciendo la estereoquímica absoluta de nueve estereocentros. [6]

Una transformación estereoselectiva guiada por auxiliares típica implica tres pasos: primero, el auxiliar se acopla covalentemente al sustrato; segundo, el compuesto resultante sufre una o más transformaciones diastereoselectivas; y finalmente, el auxiliar se elimina en condiciones que no provoquen la racemización de los productos deseados. [4] El costo de emplear auxiliares estequiométricos y la necesidad de dedicar pasos sintéticos a agregar y eliminar el auxiliar hacen que este enfoque parezca ineficiente. Sin embargo, para muchas transformaciones, la única metodología estereoselectiva disponible se basa en auxiliares quirales. Además, las transformaciones con auxiliares quirales tienden a ser versátiles y muy bien estudiadas, lo que permite el acceso más eficiente en términos de tiempo a productos enantioméricamente puros. [2]
Además, [7] los productos de las reacciones dirigidas por auxiliares son diastereómeros , lo que permite su fácil separación mediante métodos como la cromatografía en columna o la cristalización.
8-fenilmentol
En un ejemplo temprano del uso de un auxiliar quiral en la síntesis asimétrica, EJ Corey y colaboradores llevaron a cabo una reacción asimétrica de Diels-Alder entre el éster de acrilato de (−)-8-fenilmentol y el 5-benciloximetilciclopentadieno. [5] El producto de cicloadición se trasladó a la yodolactona que se muestra a continuación, un intermedio en la síntesis clásica de Corey de las prostaglandinas . Se propone que la cara posterior del acrilato está bloqueada por el auxiliar, de modo que la cicloadición se produce en la cara frontal del alqueno.

El (−)-8-fenilmentol se puede preparar a partir de cualquiera de los enantiómeros de pulegona [8] , aunque ninguna de las dos rutas es muy eficiente. Debido a la amplia utilidad del auxiliar 8-fenilmentol, se han explorado compuestos alternativos que se sintetizan más fácilmente, como el trans -2-fenil-1-ciclohexanol [9] y el trans -2-(1-fenil-1-metiletil)ciclohexanol [10] .
1,1'-Binaftil-2,2'-diol (BINOL)
El 1,1'-binaftil-2,2'-diol , o BINOL , se ha utilizado como auxiliar quiral para la síntesis asimétrica desde 1983. [11] [12]

Hisashi Yamamoto utilizó por primera vez ( R )-BINOL como auxiliar quiral en la síntesis asimétrica de limoneno , que es un ejemplo de monoterpenos cíclicos . El ( R )-BINOL mononeril éter se preparó mediante la monosililación y alquilación de ( R )-BINOL como auxiliar quiral. Seguido de la reducción con reactivo de organoaluminio, el limoneno se sintetizó con bajos rendimientos (rendimiento del 29 %) y excesos enantioméricos moderados de hasta el 64 % ee. [12]

La preparación de una variedad de R -aminoácidos poco comunes enantioméricamente puros se puede lograr mediante la alquilación de derivados quirales de glicina que poseen BINOL axialmente quiral como auxiliar. Fuji et al. lo han descrito. Según diferentes electrófilos , el exceso diastereomérico varió del 69 % al 86 %. [13]

Protegidos en la función aldehído con (R)-BINOL, los arilglioxales reaccionaron diastereoselectivamente con reactivos de Grignard para producir atrolactaldehído protegido con un exceso diastereomérico de moderado a excelente y altos rendimientos. [14]

El BINOL también se utilizó como auxiliar quiral para controlar la formación de un estereocentro P en un proceso de acoplamiento de CP catalizado por metales asimétricos. Mondal et al. descubrieron que la reacción de acoplamiento cruzado de CP catalizada por Pd entre fosforamiditas axialmente quirales basadas en BINOL y haluros de arilo o triflatos se produce con una estereoselectividad excelente debido a la presencia de BINOL cerca del centro P que reacciona. [15]
trans-2-Fenilciclohexanol
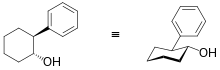
Un tipo de auxiliar quiral se basa en el motivo trans -2-fenilciclohexanol introducido por James K. Whitesell y colaboradores en 1985. Este auxiliar quiral se utilizó en reacciones eno del éster derivado del ácido glioxílico . [16]

En la síntesis total de (−)-heptemerona B y (−)-guanacastepeno E, unidos con trans-2-fenilciclohexanol, el glioxilato reaccionó con 2,4-dimetil-pent-2-eno, en presencia de cloruro de estaño(IV) , produciendo el aducto anti deseado como producto principal, junto con una pequeña cantidad de su isómero syn con una relación diastereomérica de 10:1 . [17]

Para un mayor control conformacional, el cambio de un grupo fenilo a un grupo tritilo da lugar al trans-2-tritilciclohexanol (TTC). En 2015, el grupo Brown publicó una ciclización oxidativa mediada por permanganato quiral eficiente con TTC. [18]

Oxazolidinonas
Los auxiliares de oxazolidinona , popularizados por David A. Evans , se han aplicado a muchas transformaciones estereoselectivas, incluidas las reacciones aldólicas , [19] reacciones de alquilación , [20] y reacciones de Diels-Alder . [21] [22] Las oxazolidinonas se sustituyen en las posiciones 4 y 5. A través del impedimento estérico, los sustituyentes dirigen la dirección de sustitución de varios grupos. El auxiliar se elimina posteriormente, por ejemplo, a través de hidrólisis.
Preparación
Las oxazolidinonas se pueden preparar a partir de aminoácidos o aminoalcoholes fácilmente disponibles . Existe una gran cantidad de oxazolidinonas disponibles comercialmente, incluidas las cuatro que se indican a continuación.

La acilación de la oxazolidinona se logra mediante desprotonación con n-butillitio y extinción con un cloruro de acilo .

Reacciones de alquilación
La desprotonación en el carbono α de una imida de oxazolidinona con una base fuerte como la diisopropilamida de litio proporciona selectivamente el ( Z ) - enolato , que puede sufrir alquilación estereoselectiva .

Los electrófilos activados, como los haluros alílicos o bencílicos , son muy buenos sustratos.
Reacciones aldólicas
Las oxazolidinonas quirales se han empleado más ampliamente en reacciones aldólicas estereoselectivas.
La enolización suave con el ácido de Lewis dibutilboro triflato y la base diisopropiletilamina produce el ( Z )-enolato, que experimenta una reacción aldólica diastereoselectiva con un sustrato aldehído. La transformación es particularmente potente porque establece dos estereocentros contiguos simultáneamente.

A continuación se puede encontrar un modelo para la estereoselectividad observada. La relación sin -estéreo entre el grupo metilo y el nuevo alcohol secundario resulta de un estado de transición de Zimmerman-Traxler de anillo de seis miembros , en el que el oxígeno del enolato y el oxígeno del aldehído coordinan el boro. El aldehído está orientado de tal manera que el hidrógeno se coloca en una orientación pseudoaxial para minimizar las interacciones 1,3-diaxiales . La estereoquímica absoluta de los dos estereocentros está controlada por la quiralidad en el auxiliar. En la estructura de transición, el carbonilo auxiliar está orientado lejos del oxígeno del enolato para minimizar el dipolo neto de la molécula; una cara del enolato está bloqueada por el sustituyente en el auxiliar quiral.

Eliminación
Se han desarrollado diversas transformaciones para facilitar la eliminación del auxiliar oxazolidinona para generar diferentes grupos funcionales sintéticamente útiles .

Alcanforsulta
El alcanforsultam , o sultam de Oppolzer, es un auxiliar quiral clásico.
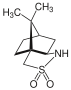
En la síntesis total de manzacidina B, el grupo Ohfune utilizó alcanforsultam para construir el anillo central de oxazolina de forma asimétrica. En comparación con la oxazolidinona como auxiliar quiral, el alcanforsultam mostró una selectividad significativa (2 S ,3 R ). [23]

El alcanforsultam también actúa como auxiliar quiral en la adición de Michael . La base de litio promovió la adición de Michael estereoselectiva de tioles a N-metacrilolalcanforsultam y produjo los productos de adición correspondientes con alta diastereoselectividad. [24]

El alcanforsultam se utilizó como auxiliar quiral para el reordenamiento asimétrico de Claisen . En presencia de hidroxitolueno butilado (BHT) utilizado como eliminador de radicales , se calentó una solución de tolueno del aducto entre geraniol y alcanforsultam en un tubo sellado a 140 °C, para proporcionar principalmente el isómero (2 R ,3 S ) como el principal producto de reordenamiento con un rendimiento del 72 %, asegurando los dos estereocentros contiguos que incluyen el carbono cuaternario. [25]

Pseudoefedrina y pseudoefedrina
Tanto la pseudoefedrina (R,R) como la (S,S) se pueden utilizar como auxiliares quirales. [26] La pseudoefedrina se hace reaccionar con un ácido carboxílico , un anhídrido de ácido o un cloruro de acilo para dar la amida correspondiente .
El protón α del compuesto carbonílico se desprotona fácilmente mediante una base no nucleófila para dar el enolato, que puede reaccionar posteriormente. La configuración del compuesto de adición, como con un haluro de alquilo , está dirigida por el grupo metilo. Por lo tanto, cualquier producto de adición será sin con el metilo y anti con el grupo hidroxilo . El auxiliar quiral pseudoefedrina se elimina posteriormente escindiendo el enlace amida con un nucleófilo apropiado .
Preparación
Ambos enantiómeros de la pseudoefedrina están disponibles comercialmente. La pseudoefedrina racémica tiene muchos usos médicos. Debido a que la pseudoefedrina se puede utilizar para fabricar metanfetamina ilegalmente , la compra de pseudoefedrina para su uso en investigación académica o industrial está bastante regulada. Como alternativa, Myers et al. informaron sobre la utilidad de los auxiliares quirales de la pseudoefedrina en las reacciones de alquilación. [27] Si bien la pseudoefedrina no está fácilmente disponible en fuentes comerciales, se puede sintetizar con relativa facilidad a partir del bencilo y no se puede utilizar para fabricar anfetaminas . [28]

Las amidas de pseudoefedrina se preparan típicamente mediante acilación con un cloruro o anhídrido de acilo . [29]

Alquilación
Las amidas de pseudoefedrina sufren una desprotonación por acción de una base fuerte, como la diisopropilamida de litio (LDA), para dar los correspondientes ( Z ) -enolatos . La alquilación de estos enolatos de litio se produce con una alta selectividad facial.

Se cree que la diastereoselectividad es el resultado de una configuración en la que una cara del enolato de litio está bloqueada por el alcóxido de litio secundario y las moléculas de disolvente asociadas con ese catión de litio. De acuerdo con esta propuesta, se ha observado que la diastereoselectividad de la etapa de alquilación depende en gran medida de la cantidad de cloruro de litio presente y del disolvente, tetrahidrofurano (THF). Normalmente, de 4 a 6 equivalentes de cloruro de litio son suficientes para saturar una solución de enolato en THF a la molaridad de la reacción.

Una ventaja principal de la alquilación asimétrica con amidas de pseudoefedrina es que los enolatos de amida suelen ser lo suficientemente nucleófilos como para reaccionar con haluros primarios e incluso secundarios a temperaturas que van desde –78 °C a 0 °C. También es posible la construcción de centros de carbono cuaternario mediante la alquilación de enolatos de amida con ramificaciones α, aunque es necesaria la adición de DMPU para electrófilos menos reactivos. [30]
Eliminación
Se han desarrollado condiciones para la transformación de amidas de pseudoefedrina en ácidos carboxílicos , alcoholes , aldehídos y cetonas enantioméricamente enriquecidos ; después de la escisión, el auxiliar se puede recuperar y reutilizar.

terc-Butanosulfinamida
Este auxiliar quiral de sulfinamida específico fue desarrollado inicialmente por Jonathan A. Ellman, y su uso ha sido explorado ampliamente por su grupo. [31] [32] Por lo tanto, a menudo se lo conoce como auxiliar de Ellman o sulfinamida de Ellman.

Preparación
Se puede obtener cualquier enantiómero de terc -butanosulfinamida a partir de disulfuro de terc -butilo en dos pasos: una reacción de oxidación catalítica asimétrica da como resultado el producto de oxidación del disulfuro (tiosulfinato) con alto rendimiento y exceso enantiomérico. El tratamiento de este compuesto con amida de litio en amoníaco produce un producto invertido ópticamente puro.

La condensación de terc -butanosulfinamida con un aldehído o una cetona se produce con un alto rendimiento y proporciona únicamente el isómero ( E ) de las N -sulfiniliminas correspondientes .

Síntesis de aminas quirales
La adición de un reactivo de Grignard a una aldimina o cetimina de terc -butanosulfinilo da como resultado una adición asimétrica para dar la sulfinamida ramificada. La estereoselectividad observada se puede racionalizar mediante una estructura de transición de anillo de seis miembros, en la que tanto el oxígeno como el nitrógeno de la sulfinilimina coordinan el magnesio.

Eliminación
El auxiliar se puede eliminar de la amina deseada mediante tratamiento con ácido clorhídrico en disolventes próticos .

SAMP/RAMPA
Las reacciones de alquilación de las hidrazonas quirales ( S )-1-amino-2-metoximetilpirrolidina ( SAMP ) y ( R )-1-amino-2-metoximetilpirrolidina ( RAMP ) fueron desarrolladas por Dieter Enders y EJ Corey. [33] [34]
Preparación
El SAMP se puede preparar en seis pasos a partir de ( S )-prolina, y el RAMP se puede preparar en seis pasos a partir de ( R )-ácido glutámico.

Reacciones de alquilación
La condensación de SAMP o RAMP con un aldehído o cetona produce la ( E )-hidrazina. La desprotonación con diisopropilamida de litio y la adición de un haluro de alquilo produce el producto alquilado. El auxiliar se puede eliminar por ozonólisis o hidrólisis.

Auxiliares quirales en la industria
Los auxiliares quirales son generalmente confiables y versátiles, lo que permite la síntesis de una gran cantidad de compuestos enantioméricamente puros de manera eficiente en términos de tiempo. En consecuencia, los auxiliares quirales suelen ser el método de elección en las primeras fases del desarrollo de fármacos. [2]
Tipranavir
El inhibidor de la proteasa del VIH, Tipranavir, se comercializa para el tratamiento del SIDA. La primera ruta de química medicinal enantioselectiva para Tipranavir incluía la adición conjugada de un reactivo organocuprato a un aceptor quiral de Michael . [35] La oxazolidinona quiral en el aceptor de Michael controlaba la estereoquímica de uno de los dos estereocentros de la molécula. La ruta comercial final para Tipranavir no presenta un auxiliar quiral; en cambio, este estereocentro se establece mediante una reacción de hidrogenación asimétrica . [36]

Atorvastatina
La sal de calcio de atorvastatina se comercializa con el nombre comercial Lipitor para reducir el colesterol en sangre. La primera ruta de química medicinal enantioselectiva para la atorvastatina se basó en una reacción aldólica diastereoselectiva con un éster quiral para fijar uno de los dos estereocentros alcohólicos. [37] En la ruta comercial para la atorvastatina, este estereocentro se transfiere desde el aditivo alimentario fácilmente disponible , ácido isoascórbico . [38]

Véase también
- Ejemplo de uso de trans-2-fenil-1-ciclohexanol como auxiliar quiral: lactama de Ojima
- Valina como auxiliar quiral en el método Schöllkopf
Referencias
- ^ Aplicaciones auxiliares quirales clave (segunda edición) (ed.: Roos, G.), Academic Press, Boston, 2014 ISBN 978-0-12-417034-6
- ^ abc Glorius, F.; Gnas, Y. (2006). "Auxiliares quirales: principios y aplicaciones recientes". Síntesis . 2006 (12): 1899–1930. doi :10.1055/s-2006-942399.
- ^ Jamali, Fakhreddin (1993). "Capítulo 14: Fármacos estereoquímicamente puros: una descripción general". En Wainer, Irving W. (ed.). Estereoquímica de fármacos: métodos analíticos y farmacología . Marcel Dekker, Inc., págs. 375–382. ISBN 978-0-8247-8819-3.
- ^ ab Evans, DA; Helmchen, G.; Rüping, M. (2007). "Auxiliares quirales en síntesis asimétrica". En Christmann, M (ed.). Síntesis asimétrica: lo esencial . Wiley-VCH Verlag GmbH & Co. págs. 3–9. ISBN 978-3-527-31399-0.
- ^ ab Corey, EJ; Ensley, HE (1975). "Preparación de un intermediario de prostaglandina ópticamente activo mediante inducción asimétrica". J. Am. Chem. Soc. 97 (23): 6908–6909. doi :10.1021/ja00856a074. PMID 1184891.
- ^ Nicolau, KC (2008). Classics in Total Synthesis (5.ª ed.). Nueva York, Nueva York: Wiley-VCH. pp. 485–508. ISBN 978-3-527-29231-8.
- ^ Miller, JP (2013). "Resumen de ChemInform: avances recientes en reacciones asimétricas de Diels-Alder". ChemInform . 44 (48): no. doi :10.1002/chin.201348243.
- ^ Corey, EJ; Ensley, HE; Parnell, CA (1978). "Síntesis conveniente de un director quiral altamente eficiente y reciclable para inducción asimétrica". J. Org. Chem. 43 (8): 1610–1611. doi :10.1021/jo00402a037.
- ^ Whitesell, JK; Chen, HH; Lawrence, RM (1985). "trans-2-fenilciclohexanol. Un auxiliar quiral potente y fácilmente disponible". J. Org. Chem . 50 (23): 4663–4664. doi :10.1021/jo00223a055.
- ^ Comins, DL; Salvador, JD (1993). "Síntesis y resolución eficientes de trans-2-(1-aril-1-metiletil)ciclohexanoles: alternativas prácticas al 8-fenilmentol". J. Org. Chem . 58 (17): 4656–4661. doi :10.1021/jo00069a031.
- ^ Brunel, Jean Michel (2005). "BINOL: un reactivo quiral versátil". Chemical Reviews . 105 (3): 857–898. doi :10.1021/cr040079g. PMID 15755079.
- ^ ab Sakane, Soichi; Fujiwara, Junya; Maruoka, Keiji; Yamamoto, Hisashi (1983). "Grupo saliente quiral. Síntesis asimétrica de tipo biogenético de limoneno y bisabolenos". Revista de la Sociedad Química Americana . 105 (19): 6154–6155. doi :10.1021/ja00357a033.
- ^ Tanaka, Kiyoshi; Ahn, Mija; Watanabe, Yukari; Fuji, Kaoru (1996-06-01). "Síntesis asimétrica de α-aminoácidos poco comunes mediante alquilaciones diastereoselectivas de un equivalente de glicina quiral". Tetrahedron: Asymmetry . 7 (6): 1771–1782. doi :10.1016/0957-4166(96)00212-1.
- ^ Maglioli, Paola; De Lucchi, Ottorino; Delogu, Giovanna; Valle, Giovanni (1 de enero de 1992). "Reducción altamente diastereoselectiva y adición de nucleófilos a arilglioxales protegidos con binaftol". Tetraedro: Asimetría . 3 (3): 365–366. doi :10.1016/S0957-4166(00)80276-1.
- ^ Mondal, Anirban; Thiel, Niklas O.; Dorel, Ruth; Feringa, Ben L. (enero de 2022). "Compuestos de fósforo P-quirogénicos mediante arilación estereoselectiva de fosforamiditas catalizada por Pd". Nature Catalysis . 5 (1): 10–19. doi : 10.1038/s41929-021-00697-9 . S2CID 245426891.
- ^ Buchi, George; Vogel, Dennis E. (1985). "Un nuevo método para la preparación de cetonas γ,δ-insaturadas mediante reordenamiento de Claisen". The Journal of Organic Chemistry . 50 (23): 4664–4665. doi :10.1021/jo00223a056.
- ^ Miller, Aubry K.; Hughes, Chambers C.; Kennedy-Smith, Joshua J.; Gradl, Stefan N.; Dirk Trauner (2006). "Síntesis total de (−)-heptemerona B y (−)-guanacastepeno E". Revista de la Sociedad Química Estadounidense . 128 (51): 17057–17062. doi :10.1021/ja0660507. PMID 17177458.
- ^ Al Hazmi, Ali M.; Sheikh, Nadeem S.; Bataille, Carole JR; Al-Hadedi, Azzam AM; Watkin, Sam V.; Luker, Tim J.; Camp, Nicholas P.; Brown, Richard CD (2014). " trans -2-Tritilciclohexanol como auxiliar quiral en la ciclización oxidativa mediada por permanganato de 2-metilenhept-5-enoatos: aplicación a la síntesis de óxido de trans -(+)-linalool". Cartas orgánicas . 16 (19): 5104–5107. doi :10.1021/ol502454r. PMID 25225741.
- ^ Evans, DA; Bartroli, J.; Shih, TL (1981). "Condensaciones aldólicas enantioselectivas. 2. Condensaciones aldólicas quirales eritroselectivas mediante enolatos de boro". J. Am. Chem. Soc . 103 (8): 2127–2129. doi :10.1021/ja00398a058.
- ^ Evans, DA; Ennis, MD; Mathre, DJ (1982). "Reacciones de alquilación asimétrica de enolatos de imida quirales. Un enfoque práctico para la síntesis enantioselectiva de derivados de ácidos carboxílicos a-sustituidos". J. Am. Chem. Soc . 104 (6): 1737–1739. doi :10.1021/ja00370a050.
- ^ Evans, DA; Chapman, KT; Bisaha, J. (1984). "Nuevas reacciones asimétricas de cicloadición de Diels-Alder. Carboximidas quirales α,β-insaturadas como sintones dienófilos quirales prácticos de acrilato y crotonato". J. Am. Chem. Soc . 106 (15): 4261–4263. doi :10.1021/ja00327a031.
- ^ Evans, DA; Chapman, KT; Hung, DT; Kawaguchi, AT (1987). "Solvación π del estado de transición por anillos aromáticos: una contribución electrónica a la diastereoselectividad de la reacción de Diels-Alder". Angew. Chem. Int. Ed. 26 (11): 1184–1186. doi :10.1002/anie.198711841.
- ^ Shinada, Tetsuro; Oe, Kentaro; Ohfune, Yasufumi (27 de junio de 2012). "Síntesis total eficiente de manzacidina B". Letras de tetraedro . 53 (26): 3250–3253. doi :10.1016/j.tetlet.2012.04.042.
- ^ Tsai, Wen-Jiuan; Lin, Yi-Tsong; Uang, Biing-Jiun (1994-07-01). "Adición de Michael asimétrica de tioles a (1R,2R,4R)-(−)-2,10- N -enoilcanforsultam". Tetrahedron: Asymmetry . 5 (7): 1195–1198. doi :10.1016/0957-4166(94)80155-X.
- ^ Takao, Ken-ichi; Sakamoto, Shu; Touati, Marianne Ayaka; Kusakawa, Yusuke; Tadano, Kin-ichi (8 de noviembre de 2012). "Construcción asimétrica de estereocentros cuaternarios totalmente de carbono mediante reordenamiento de Claisen mediado por auxiliares quirales y síntesis total de (+) -Bakuchiol". Moléculas . 17 (11): 13330–13344. doi : 10,3390/moléculas171113330 . PMC 6268616 . PMID 23138536.
- ^ Myers, AG; et al. (1997). "Pseudoefedrina como auxiliar quiral práctico para la síntesis de ácidos carboxílicos, alcoholes, aldehídos y cetonas altamente enantioméricamente enriquecidos". J. Am. Chem. Soc . 119 (28): 6496–6511. doi :10.1021/ja970402f.
- ^ Myers, AG; Morales, MR; Mellem, KT (2012). "Pseudoefenamina: un auxiliar quiral práctico para la síntesis asimétrica" (PDF) . Angew. Chem . 124 (19): 4646–4649. Bibcode :2012AngCh.124.4646M. doi :10.1002/ange.201200370. PMC 3854953 . PMID 22461381.
- ^ Mellem, Kevin T.; Myers, Andrew G. (2013). "Una ruta sintética simple y escalable para (+)- y (−)-pseudoefenamina". Cartas orgánicas . 15 (21): 5594–5597. doi :10.1021/ol402815d. ISSN 1523-7060. PMC 3864801 . PMID 24138164.
- ^ Myers, AG; Yang, BH; McKinstry, L.; Kopecky, DJ; Gleason, JL (1997). "Pseudoefedrina como auxiliar quiral práctico para la síntesis de ácidos carboxílicos, alcoholes, aldehídos y cetonas altamente enantioméricamente enriquecidos". J. Am. Chem. Soc . 119 (28): 6496–6511. doi :10.1021/ja970402f.
- ^ Kummer, DA; Chain, WJ; Morales, MR; Quiroga, O.; Myers, AG (2008). "Construcción alquilativa estereocontrolada de centros de carbono cuaternario". J. Am. Chem. Soc . 130 (40): 13231–13233. doi :10.1021/ja806021y. PMC 2666470. PMID 18788739 .
- ^ Liu, Guangcheng; Cogan, Derek A.; Ellman, Jonathan A. (octubre de 1997). "Síntesis catalítica asimétrica de terc-butanosulfinamida. Aplicación a la síntesis asimétrica de aminas". Revista de la Sociedad Química Americana . 119 (41): 9913–9914. doi :10.1021/ja972012z. ISSN 0002-7863.
- ^ Ellman, JA; Owens, TD; Tang, TP (2002). "N-terc-Butanosulfinil Iminas: Intermedios versátiles para la síntesis asimétrica de aminas". Acc. Chem. Res. 35 (11): 984–995. doi :10.1021/ar020066u. PMID 12437323.
- ^ Corey, EJ; Enders, D. (1976). "Aplicaciones de N,N-dimetilhidrazonas a la síntesis. Uso en la formación eficiente, selectiva posicional y estereoquímicamente de enlaces CC; hidrólisis oxidativa a compuestos carbonílicos". Tetrahedron Letters . 17 (1): 3–6. doi :10.1016/s0040-4039(00)71307-4.
- ^ Kurti, L.; Czako, B. (2005). Aplicaciones estratégicas de reacciones con nombre en síntesis orgánica . Burlington, MA: Elsevier Academic Press. pp. 150–151. ISBN 978-0-12-369483-6.
- ^ Turner, ST; et al. (1998). "Tipranavir (PNU-140690): un potente inhibidor no peptídico de la proteasa del VIH, biodisponible por vía oral, de la clase de las 5,6-dihidro-4-hidroxi-2-pironasulfonamidas". J. Med. Chem. 41 (18): 3467–3476. doi :10.1021/jm9802158. PMID 9719600.
- ^ Caron, Stéphane (2011). "Capítulo 15: Desarrollo de la ruta sintética de fármacos farmacéuticos contemporáneos seleccionados". En Caron, Stéphane (ed.). Química orgánica sintética práctica . John Wiley & Sons, Inc., págs. 666–670. ISBN 978-0-470-03733-1.
- ^ Roth, BD; et al. (1991). "Inhibidores de la biosíntesis del colesterol. 3. Inhibidores de la HMG-CoA reductasa por tetrahidro-4-hidroxi-6-[2-(1H-pirrol-1-il)etil]-2H-piran-2-ona. 2. Efectos de la introducción de sustituyentes en las posiciones tres y cuatro del núcleo pirrólico". J. Med. Chem . 34 (1): 357–366. doi :10.1021/jm00105a056. PMID 1992137.
- ^ Jie Jack Li; Douglas S. Johnson; Drago R. Sliskovic; Bruce D. Roth (2004). "Capítulo 9. Atorvastatina cálcica (Lipitor)". Síntesis de fármacos contemporánea . John Wiley & Sons, Inc., págs. 113-125. ISBN 978-0-471-21480-9.