Polimerización radical por transferencia de átomos
| Ciencia de los polímeros |
|---|
 |
La polimerización radical por transferencia de átomos ( ATRP ) es un ejemplo de polimerización radical por desactivación reversible . Al igual que su contraparte, ATRA , o adición radical por transferencia de átomos , la ATRP es un medio para formar un enlace carbono-carbono con un catalizador de metal de transición . La polimerización mediante este método se denomina polimerización por adición radical por transferencia de átomos ( ATRAP ). Como su nombre lo indica, el paso de transferencia de átomos es crucial en la reacción responsable del crecimiento uniforme de la cadena de polímeros . La ATRP (o polimerización radical viva mediada por metales de transición) fue descubierta independientemente por Mitsuo Sawamoto [1] y por Krzysztof Matyjaszewski y Jin-Shan Wang en 1995. [2] [3]
- El siguiente esquema presenta una reacción ATRP típica:

Polimerización radical con desactivación reversible controlada en la que la desactivación
de los radicales implica una transferencia reversible de átomos o una transferencia reversible de grupos catalizada generalmente,
aunque no exclusivamente, por complejos de metales de transición. [4]
Descripción general de ATRP
La ATRP suele emplear un complejo de metal de transición como catalizador con un haluro de alquilo como iniciador (RX). Se han empleado varios complejos de metales de transición, concretamente los de Cu, Fe, Ru, Ni y Os, como catalizadores para la ATRP. En un proceso ATRP, la especie latente se activa mediante el complejo de metal de transición para generar radicales a través de un proceso de transferencia de electrones. Simultáneamente, el metal de transición se oxida a un estado de oxidación más alto. Este proceso reversible establece rápidamente un equilibrio que se desplaza predominantemente hacia el lado con concentraciones de radicales muy bajas. El número de cadenas de polímero está determinado por el número de iniciadores. Cada cadena en crecimiento tiene la misma probabilidad de propagarse con monómeros para formar cadenas de polímero vivas/latentes (RP n -X). Como resultado, se pueden preparar polímeros con pesos moleculares similares y una distribución estrecha de pesos moleculares.
Las reacciones ATRP son muy robustas ya que son tolerantes a muchos grupos funcionales como grupos alilo, amino, epoxi, hidroxi y vinilo presentes en el monómero o el iniciador. [5] Los métodos ATRP también son ventajosos debido a la facilidad de preparación, catalizadores disponibles comercialmente y económicos (complejos de cobre), ligandos basados en piridina e iniciadores (haluros de alquilo). [6]

Componentes del ATRP normal
Existen cinco componentes variables importantes en las polimerizaciones radicalarias por transferencia de átomos: el monómero, el iniciador, el catalizador, el ligando y el disolvente. En la siguiente sección se detallan las contribuciones de cada componente a la polimerización general.
Monómero
Los monómeros que se utilizan normalmente en la ATRP son moléculas con sustituyentes que pueden estabilizar los radicales que se propagan; por ejemplo, estirenos, (met)acrilatos, (met) acrilamidas y acrilonitrilo . [7] La ATRP tiene éxito en la obtención de polímeros de alto peso molecular promedio y baja dispersidad cuando la concentración del radical que se propaga equilibra la velocidad de terminación del radical. Sin embargo, la velocidad de propagación es única para cada monómero individual. Por lo tanto, es importante que los demás componentes de la polimerización (iniciador, catalizador, ligando y disolvente) se optimicen para que la concentración de las especies latentes sea mayor que la del radical que se propaga y, al mismo tiempo, lo suficientemente baja como para evitar que se ralentice o detenga la reacción. [8] [9]
Iniciador
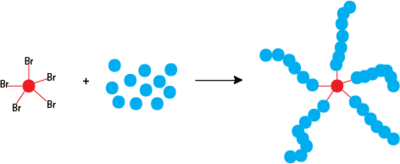
El número de cadenas de polímero en crecimiento está determinado por el iniciador. Para asegurar una baja polidispersidad y una polimerización controlada, la velocidad de iniciación debe ser tan rápida o preferiblemente más rápida que la velocidad de propagación [10]. Idealmente, todas las cadenas se iniciarán en un período de tiempo muy corto y se propagarán a la misma velocidad. Los iniciadores se eligen típicamente para que sean haluros de alquilo cuyas estructuras sean similares a las del radical que se propaga. [8] Los haluros de alquilo, como los bromuros de alquilo, son más reactivos que los cloruros de alquilo. Ambos ofrecen un buen control del peso molecular. [8] [9] La forma o estructura del iniciador influye en la arquitectura del polímero. Por ejemplo, los iniciadores con múltiples grupos de haluros de alquilo en un solo núcleo pueden dar lugar a una forma de polímero similar a una estrella. [11] Además, los iniciadores ATRP α-funcionalizados se pueden utilizar para sintetizar polímeros heterotelequélicos con una variedad de grupos en los extremos de la cadena [12].
Catalizador
El catalizador es el componente más importante de la ATRP porque determina la constante de equilibrio entre las especies activas y latentes. Este equilibrio determina la velocidad de polimerización. Una constante de equilibrio demasiado pequeña puede inhibir o ralentizar la polimerización, mientras que una constante de equilibrio demasiado grande conduce a una amplia distribución de longitudes de cadena. [9]
Existen varios requisitos para el catalizador metálico:
- Deben existir dos estados de oxidación accesibles que se diferencien por un electrón.
- El centro metálico debe tener una afinidad razonable por los halógenos.
- La esfera de coordinación del metal debe ser expandible cuando se oxida para acomodar el halógeno.
- El catalizador de metal de transición no debe provocar reacciones secundarias significativas, como el acoplamiento irreversible con los radicales que se propagan y la terminación catalítica de radicales.
Los catalizadores más estudiados son aquellos que incluyen cobre, que ha demostrado la mayor versatilidad con polimerizaciones exitosas para una amplia selección de monómeros.
Ligando
Uno de los aspectos más importantes en una reacción ATRP es la elección del ligando que se utiliza en combinación con el catalizador de haluro de cobre tradicional para formar el complejo catalizador. La función principal del ligando es solubilizar el haluro de cobre en cualquier disolvente elegido y ajustar el potencial redox del cobre. [13] Esto cambia la actividad y la dinámica de la reacción de intercambio de halógeno y la posterior activación y desactivación de las cadenas de polímero durante la polimerización, por lo que afecta en gran medida la cinética de la reacción y el grado de control sobre la polimerización. Se deben elegir diferentes ligandos en función de la actividad del monómero y la elección del metal para el catalizador. Como los haluros de cobre se utilizan principalmente como catalizador, los ligandos basados en amina son los más comúnmente elegidos. Se están investigando ligandos con actividades más altas como formas de disminuir potencialmente la concentración de catalizador en la reacción, ya que un complejo catalizador más activo conduciría a una mayor concentración de desactivador en la reacción. Sin embargo, un catalizador demasiado activo puede conducir a una pérdida de control y aumentar la polidispersidad del polímero resultante.
Disolventes
Se utilizan habitualmente tolueno, 1,4-dioxano, xileno, anisol, DMF, DMSO, agua, metanol, acetonitrilo o incluso el propio monómero (descrito como polimerización en masa).
Cinética del ATRP normal
- Reacciones en la polimerización radical por transferencia de átomos
- Iniciación
- Estado cuasi-estacionario
- También deben considerarse otras reacciones de rotura de cadena ( ).
Constante de equilibrio ATRP
La concentración de radicales en ATRP normal se puede calcular mediante la siguiente ecuación:
Es importante conocer el valor de K ATRP para ajustar la concentración de radicales. El valor de K ATRP depende de la energía de homoescisión del haluro de alquilo y del potencial redox del catalizador de Cu con diferentes ligandos. Dados dos haluros de alquilo (R 1 -X y R 2 -X) y dos ligandos (L 1 y L 2 ), habrá cuatro combinaciones entre diferentes haluros de alquilo y ligandos. Sea K ij ATRP el valor de K ATRP para R i -X y L j . Si conocemos tres de estas cuatro combinaciones, la cuarta se puede calcular como:
Los valores de K ATRP para diferentes haluros de alquilo y diferentes catalizadores de Cu se pueden encontrar en la literatura. [14]
Los disolventes tienen efectos significativos en los valores de K ATRP . El valor de K ATRP aumenta drásticamente con la polaridad del disolvente para el mismo haluro de alquilo y el mismo catalizador de Cu. [15] La polimerización debe tener lugar en una mezcla de disolvente/monómero, que cambia gradualmente a una mezcla de disolvente/monómero/polímero. Los valores de K ATRP podrían cambiar 10 000 veces al cambiar el medio de reacción de acrilato de metilo puro a dimetilsulfóxido puro. [16]
Coeficientes de tasa de activación y desactivación
Los valores del coeficiente de velocidad de desactivación, k d , deben ser lo suficientemente grandes para obtener una baja dispersidad. La medición directa de k d es difícil, aunque no imposible. En la mayoría de los casos, k d se puede calcular a partir de K ATRP y k a conocidos . [14] [17] [18] No se recomienda el uso de complejos de Cu que proporcionen valores de k d muy bajos en reacciones ATRP.
Conservación de la funcionalidad del extremo de la cadena
Generalmente se desea una retención de alto nivel de la funcionalidad del extremo de la cadena. Sin embargo, la determinación de la pérdida de la funcionalidad del extremo de la cadena basada en métodos de RMN de 1H y espectroscopia de masas no puede proporcionar valores precisos. Como resultado, es difícil identificar las contribuciones de las diferentes reacciones de ruptura de la cadena en ATRP. Una regla simple en ATRP comprende el principio de conservación del halógeno. [19] La conservación del halógeno significa que la cantidad total de halógeno en los sistemas de reacción debe permanecer constante. A partir de esta regla, el nivel de retención de la funcionalidad del extremo de la cadena se puede determinar con precisión en muchos casos. La determinación precisa de la pérdida de la funcionalidad del extremo de la cadena permitió una mayor investigación de las reacciones de ruptura de la cadena en ATRP. [20]
Ventajas y desventajas del ATRP
Ventajas
La ATRP permite la polimerización de una amplia variedad de monómeros con diferentes funcionalidades químicas, demostrando ser más tolerante a estas funcionalidades que las polimerizaciones iónicas . Proporciona un mayor control del peso molecular, la arquitectura molecular y la composición del polímero al tiempo que mantiene una baja polidispersidad (1,05-1,2). El halógeno que queda al final de la cadena de polímero después de la polimerización permite una fácil modificación del extremo de la cadena posterior a la polimerización en diferentes grupos funcionales reactivos. El uso de iniciadores multifuncionales facilita la síntesis de polímeros estrella de brazo inferior y polímeros telequélicos. La estimulación con luz visible externa La ATRP tiene una alta velocidad de respuesta y una excelente tolerancia a los grupos funcionales. [21]
Desventajas
El inconveniente más importante de la ATRP es la alta concentración de catalizador necesaria para la reacción. Este catalizador consta, por lo general, de un haluro de cobre y un ligando a base de amina. La eliminación del cobre del polímero después de la polimerización suele ser tediosa y costosa, lo que limita el uso de la ATRP en el sector comercial. [22] Sin embargo, los investigadores están desarrollando actualmente métodos que limitarían la necesidad de la concentración del catalizador a ppm. La ATRP también es una reacción tradicionalmente sensible al aire que normalmente requiere ciclos de congelación-bombeo-descongelación. Sin embargo, técnicas como la ATRP generada por activador mediante transferencia de electrones (AGET) ofrecen alternativas potenciales que no son sensibles al aire. [23] Una desventaja final es la dificultad de realizar la ATRP en medios acuosos.
Diferentes métodos ATRP
Métodos de regeneración del activador ATRP
En una ATRP normal, la concentración de radicales está determinada por el valor K ATRP , la concentración de especies latentes y la relación [Cu I ]/[Cu II ]. En principio, la cantidad total de catalizador de Cu no debería influir en la cinética de polimerización. Sin embargo, la pérdida de funcionalidad del extremo de la cadena convierte lenta pero irreversiblemente Cu I en Cu II . Por lo tanto, las relaciones iniciales [Cu I ]/[I] son típicamente de 0,1 a 1. Cuando se utilizan concentraciones muy bajas de catalizadores, normalmente a nivel de ppm, generalmente se requieren procesos de regeneración del activador para compensar la pérdida de CEF y regenerar una cantidad suficiente de Cu I para continuar la polimerización. Se desarrollaron varios métodos de regeneración del activador ATRP, a saber, ICAR ATRP, ARGET ATRP, SARA ATRP, e ATRP y ATRP fotoinducido. El proceso de regeneración del activador se introduce para compensar la pérdida de funcionalidad del extremo de la cadena, por lo que la cantidad acumulada de regeneración del activador debería ser aproximadamente igual a la cantidad total de pérdida de funcionalidad del extremo de la cadena.

ICAR-ATRP-Asociación Internacional de Policía
Los iniciadores para la regeneración continua del activador (ICAR) son una técnica que utiliza iniciadores radicales convencionales para regenerar continuamente el activador, reduciendo su concentración requerida de miles de ppm a <100 ppm, lo que la convierte en una técnica industrialmente relevante.
ARGET ATRP
Los activadores regenerados por transferencia de electrones (ARGET) emplean agentes reductores no formadores de radicales para la regeneración de Cu I. Un buen agente reductor (por ejemplo, hidrazina, fenoles, azúcares, ácido ascórbico) solo debe reaccionar con Cu II y no con radicales u otros reactivos en la mezcla de reacción.
Sara ATRP
Un SARA ATRP típico emplea Cu2O3 como activador suplementario y agente reductor (SARA). Cu2O3 puede activar el haluro de alquilo directamente, pero lentamente. Cu2O3 también puede reducir CuII a CuI . Ambos procesos ayudan a regenerar el activador CuI . Otros metales de valencia cero, como Mg, Zn y Fe, también se han empleado para SARA ATRP basado en Cu.
miATP
En el proceso e -ATRP, el activador Cu I se regenera mediante un proceso electroquímico. El desarrollo del proceso e- ATRP permite un control preciso del proceso de reducción y una regulación externa de la polimerización. En un proceso e- ATRP, la reacción redox involucra dos electrodos. La especie Cu II se reduce a Cu I en el cátodo. El compartimento del ánodo normalmente está separado del entorno de polimerización por una frita de vidrio y un gel conductor. Alternativamente, se puede utilizar un contraelectrodo de aluminio de sacrificio, que se sumerge directamente en la mezcla de reacción.
ATRP fotoinducida
La fotorreducción directa de catalizadores de metales de transición en ATRP y/o la activación fotoasistente de haluro de alquilo es particularmente interesante porque dicho procedimiento permitirá realizar ATRP con un nivel de ppm de catalizadores sin ningún otro aditivo.
Otros métodos ATRP
ATRP inversa
En la ATRP inversa, el catalizador se añade en su estado de oxidación más alto. Las cadenas se activan mediante iniciadores radicalarios convencionales (por ejemplo, AIBN) y se desactivan mediante el metal de transición. La fuente de halógeno transferible es la sal de cobre, por lo que esta debe estar presente en concentraciones comparables a las del metal de transición.
SR&NI ATRP
Una mezcla de iniciador radical y catalizador activo (de menor estado de oxidación) permite la creación de copolímeros en bloque (contaminados con homopolímero), lo que es imposible con la ATRP inversa estándar. Esto se denomina SR&NI (ATRP de iniciación inversa y normal simultánea).
AGENTE ATRP
Los activadores generados por transferencia de electrones utilizan un agente reductor incapaz de iniciar nuevas cadenas (en lugar de radicales orgánicos) como regenerador para el metal de baja valencia. Algunos ejemplos son el cobre metálico, el estaño (II), el ácido ascórbico o la trietilamina . Permite concentraciones más bajas de metales de transición y también puede ser posible en medios acuosos o dispersos.
Sistemas híbridos y bimetálicos
Esta técnica utiliza una variedad de diferentes metales/estados de oxidación, posiblemente sobre soportes sólidos, para actuar como activadores/desactivadores, posiblemente con toxicidad o sensibilidad reducida. [24] [25] Las sales de hierro pueden, por ejemplo, activar eficientemente los haluros de alquilo, pero requieren un desactivador Cu(II) eficiente que puede estar presente en concentraciones mucho más bajas (3–5 mol%)
ATRP sin metales
El catalizador de metales traza que queda en el producto final ha limitado la aplicación de ATRP en los campos biomédico y electrónico. En 2014, Craig Hawker y sus colaboradores desarrollaron un nuevo sistema de catálisis que implica la reacción fotorredox de 10-fenotiazina. Se ha demostrado que el ATRP sin metales es capaz de polimerizar de forma controlada los metacrilatos. [26] Esta técnica fue ampliada posteriormente a la polimerización del acrilonitrilo por Matyjaszewski et al. [27]
Mecano/sonoro-ATRP
La mecano/sono-ATRP utiliza fuerzas mecánicas, típicamente agitación ultrasónica, como estímulo externo para inducir la (re)generación de activadores en la ATRP. Esser-Kahn, et al. demostraron el primer ejemplo de mecano-ATRP utilizando la piezoelectricidad del titanato de bario para reducir las especies de Cu(II). [28] Posteriormente, Matyjaszewski, et al. mejoraron la técnica utilizando partículas de óxido de zinc o titanato de bario de tamaño nanométrico y/o funcionalizadas en la superficie, logrando una velocidad y un control superiores de la polimerización, así como un control temporal, con catalizadores de cobre a nivel de ppm. [29] [30] Además de las partículas piezoeléctricas, se descubrió que el agua y los carbonatos mediaban la mecano/sono-ATRP. Las moléculas de agua homolizadas mecoquímicamente sufren una adición radical a los monómeros, lo que a su vez reduce las especies de Cu(II). [31] Los complejos de carbonato de Cu(II) mecánicamente inestables se forman en presencia de carbonatos insolubles, que oxidan dimetilsulfóxido, las moléculas del solvente, para generar especies de Cu(I) y dióxido de carbono. [32]
ATRP biocatalítico
Los equipos de investigación de Fabio Di Lena [33] y Nico Bruns [34] han utilizado por primera vez metaloenzimas como catalizadores de ATRP, en paralelo e independientemente. Este trabajo pionero ha allanado el camino hacia el campo emergente de la polimerización radical biocatalítica por desactivación reversible . [35] [36]
Polímeros sintetizados a través de ATRP
Véase también
- Heteropolímero
- Radical (química)
- Polimerización por transferencia de cadena por adición-fragmentación reversible
- Polimerización radical mediada por nitróxido
Enlaces externos
- Acerca de ATRP - Matyjaszewski Polymer Group
Referencias
- ^ Kato, M; Kamigaito, M; Sawamoto, M; Higashimura, T (1995). "Polimerización de metacrilato de metilo con el sistema iniciador de tetracloruro de carbono/diclorotris-(trifenilfosfina)rutenio(II)/bis(2,6-di-terc-butilfenóxido) de metilaluminio: posibilidad de polimerización por radicales vivos". Macromolecules . 28 (5): 1721–1723. Bibcode :1995MaMol..28.1721K. doi :10.1021/ma00109a056.
- ^ Wang, JS; Matyjaszewski, K (1995). "Polimerización radical controlada/"viva". Polimerización radical por transferencia atómica en presencia de complejos de metales de transición". J. Am. Chem. Soc. 117 (20): 5614–5615. doi :10.1021/ja00125a035.
- ^ "Premio Wolf de Química 2011". Wolf Fund . Consultado el 21 de febrero de 2011 .
- ^ Jenkins, Aubrey D.; Jones, Richard G.; Moad, Graeme (2010). "Terminología para la polimerización radical con desactivación reversible, anteriormente denominada polimerización radical "controlada" o "viva" (Recomendaciones IUPAC 2010)" (PDF) . Química Pura y Aplicada . 82 (2): 483–491. doi :10.1351/PAC-REP-08-04-03.
- ^ Cowie, JMG; Arrighi, V. En Polímeros: química y física de materiales modernos; CRC Press Taylor and Francis Group: Boca Raton, Fl, 2008; 3.ª ed., págs. 82–84 ISBN 0849398134
- ^ Matyjaszewski, K. "Fundamentos de la investigación ATRP". Archivado desde el original el 22 de febrero de 2009. Consultado el 7 de enero de 2009 .
- ^ Patten, T. E; Matyjaszewski, K (1998). "Polimerización radical por transferencia atómica y síntesis de materiales poliméricos". Adv. Mater. 10 (12): 901–915. doi :10.1002/(sici)1521-4095(199808)10:12<901::aid-adma901>3.0.co;2-b.
- ^ abc Odian, G. En Polimerización en cadena radical; Principios de polimerización; Wiley-Interscience: Staten Island, Nueva York, 2004; Vol. , págs. 316–321.
- ^ abc Matyjaszewski, Krzysztof; Xia, Jianhui (2001). "Polimerización radical por transferencia atómica". Chem. Rev. 101 (9): 2921–90. doi :10.1021/cr940534g. ISSN 0009-2665. PMID 11749397.
- ^ <!- -No se indica- ->. "Iniciadores". Grupo de polímeros Matyjaszewski . Universidad Carnegie Mellon. Archivado desde el original el 19 de julio de 2011. Consultado el 30 de noviembre de 2018 .
- ^ Jakubowski, Wojciech. "Herramientas completas para la síntesis de polímeros funcionalizados bien definidos mediante ATRP". Sigma-Aldrich . Consultado el 21 de julio de 2010 .
- ^ <!- -No se indica- ->. "Uso de iniciadores ATRP funcionales". Matyjaszewski Polymer Group . Universidad Carnegie Mellon. Archivado desde el original el 13 de febrero de 2011. Consultado el 30 de noviembre de 2018 .
- ^ <!- -No se indica- ->. "Caracterización estructural de un complejo catalizador ATRP". Matyjaszewski Polymer Group . Universidad Carnegie Mellon . Consultado el 30 de noviembre de 2018 .
- ^ ab Tang, W; Kwak, Y; Braunecker, W; Tsarevsky, NV; Coote, ML; Matyjaszewski, K (2008). "Comprensión de la polimerización radical por transferencia de átomos: efecto de las estructuras de ligando e iniciador en las constantes de equilibrio". J. Am. Chem. Soc. 130 (32): 10702–10713. doi :10.1021/ja802290a. PMID 18642811.
- ^ Braunecker, W; Tsarevsky, NV; Gennaro, A; Matyjaszewski, K (2009). "Componentes termodinámicos del equilibrio de polimerización radical por transferencia de átomos: cuantificación de los efectos del disolvente". Macromolecules . 42 (17): 6348–6360. Bibcode :2009MaMol..42.6348B. doi :10.1021/ma901094s.
- ^ Wang, Y; Kwak, Y; Buback, J; Buback, M; Matyjaszewski, K (2012). "Determinación de las constantes de equilibrio de ATRP en condiciones de polimerización". ACS Macro Lett. 1 (12): 1367–1370. doi :10.1021/mz3005378.
- ^ Tang, W; Matyjaszewski, K (2007). "Efectos de la estructura del iniciador en las constantes de velocidad de activación en ATRP". Macromolecules . 40 (6): 1858–1863. Bibcode :2007MaMol..40.1858T. doi :10.1021/ma062897b.
- ^ Tang, W; Matyjaszewski, K (2006). "Efecto de la estructura del ligando en las constantes de velocidad de activación en ATRP". Macromolecules . 39 (15): 4953–4959. Bibcode :2006MaMol..39.4953T. doi :10.1021/ma0609634.
- ^ Wang, Y; Zhong, M; Zhang, Y; Magenau, AJD; Matyjaszewski, K (2012). "Conservación de halógenos en polimerización radical por transferencia de átomos". Macromolecules . 45 (21): 8929–8932. Bibcode :2012MaMol..45.8929W. doi :10.1021/ma3018958.
- ^ Wang, Y; Soerensen, N; Zhong, M; Schroeder, H; Buback, M; Matyjaszewski, K (2013). "Mejora de la "vivacidad" de ATRP mediante la reducción de la concentración del catalizador de Cu". Macromolecules . 46 (3): 689–691. Código Bibliográfico :2013MaMol..46..683W. doi :10.1021/ma3024393.
- ^ "Polimerización por transferencia de átomos por radicales libres (ATRP): inteligencia artificial para la química" . Consultado el 19 de noviembre de 2019 .
- ^ Borman, Stu (30 de octubre de 2006). "Polímeros con cantidades seguras de cobre". Chemical & Engineering News . 84 (43): 40–41. doi :10.1021/cen-v084n044.p040 . Consultado el 30 de noviembre de 2018 .
- ^ Siegwart, Daniel; Kwan Oh, Jung; Matyjaszewski, Krzysztof (1 de enero de 2012). "ATRP en el diseño de materiales funcionales para aplicaciones biomédicas". Progreso en la ciencia de polímeros . 37 (1): 18–37. doi :10.1016/j.progpolymsci.2011.08.001. PMC 3604987 . PMID 23525884.
- ^ Xiong, De'an; He, Zhenping (15 de enero de 2010). "Modulación de la actividad catalítica de Au/micelas mediante canales hidrófilos ajustables". Journal of Colloid and Interface Science . 341 (2): 273–279. Bibcode :2010JCIS..341..273X. doi :10.1016/j.jcis.2009.09.045. PMID 19854448.
- ^ Chen, Xi; He, Zhenping; et al. (5 de agosto de 2008). "Compuestos de micelas de oro núcleo-capa-corona con una capa híbrida inteligente ajustable". Langmuir . 24 (15): 8198–8204. doi :10.1021/la800244g. PMID 18576675.
- ^ Treat, Nicolas; Sprafke, Hazel; Kramer, John; Clark, Paul; Barton, Bryan; Read de Alaniz, Javier; Fors, Brett; Hawker, Craig (2014). "Polimerización radical por transferencia de átomos sin metal". Revista de la Sociedad Química Americana . 136 (45): 16096–16101. doi :10.1021/ja510389m. PMID 25360628.
- ^ Pan, Xiangcheng; Lamson, Melissa; Yan, Jiajun; Matyjaszewski, Krzysztof (17 de febrero de 2015). "Polimerización radical fotoinducida de acrilonitrilo por transferencia atómica sin metal". ACS Macro Letters . 4 (2): 192–196. doi :10.1021/mz500834g.
- ^ Mohapatra, Hemakesh; Kleiman, Maya; Esser-Kahn, Aaron Palmer (24 de octubre de 2016). "Polimerización radical controlada mecánicamente iniciada por ultrasonido". Nature Chemistry . 9 (2): 135–139. doi :10.1038/nchem.2633.
- ^ Wang, Zhenhua; Pan, Xiangcheng; Yan, Jiajun; Dadashi-Silab, Sajjad; Xie, Guojun; Zhang, Jianan; Wang, Zhanhua; Xia, Hesheng; Matyjaszewski, Krzysztof (28 de abril de 2017). "Control temporal en la polimerización radical por transferencia de átomos controlada mecánicamente utilizando un bajo nivel de ppm de catalizador de Cu". ACS Macro Letters . 6 (5): 546–549. doi :10.1021/acsmacrolett.7b00152.
- ^ Wang, Zhenhua; Pan, Xiangcheng; Li, Lingchun; Fantin, Marco; Yan, Jiajun; Wang, Zongyu; Wang, Zhanhua; Xia, Hesheng; Matyjaszewski, Krzysztof (4 de octubre de 2017). "Mejora de la ATRP inducida mecánicamente mediante la promoción de la transferencia de electrones interfacial desde nanopartículas piezoeléctricas a catalizadores de Cu". Macromolecules . 50 (20): 7940–7948. Código Bibliográfico :2017MaMol..50.7940W. doi :10.1021/acs.macromol.7b01597.
- ^ Wang, Zhenhua; Wang, Zhanhua; Pan, Xiangcheng; Fu, Liye; Lathwal, Sushil; Olszewski, Mateusz; Yan, Jiajun; Enciso, Alan E.; Wang, Zongyu; Xia, Hesheng; Matyjaszewski, Krzysztof (20 de marzo de 2018). "Polimerización radical acuosa por transferencia de átomos inducida por ultrasonicación". ACS Macro Letters . 7 (3): 275–280. doi : 10.1021/acsmacrolett.8b00027 . ISSN 2161-1653.
- ^ Wang, Zhenhua; Lorandi, Francesca; Fantin, Marco; Wang, Zongyu; Yan, Jiajun; Wang, Zhanhua; Xia, Hesheng; Matyjaszewski, Krzysztof (22 de enero de 2019). "Polimerización radical por transferencia de átomos posibilitada por especies de carbonato de cobre lábiles sonoquímicamente". ACS Macro Letters . 8 (2): 161–165. doi :10.1021/acsmacrolett.9b00029.
- ^ Ng, Yeap-Hung; Lena, Fabio di; Chai, Christina LL (24 de mayo de 2011). "PolyPEGA con pesos moleculares predeterminados a partir de polimerización radical mediada por enzimas en agua". Chemical Communications . 47 (22): 6464–6466. doi :10.1039/C1CC10989H. ISSN 1364-548X.
- ^ Sigg, Severin J.; Seidi, Farzad; Renggli, Kasper; Silva, Tilana B.; Kali, Gergely; Bruns, Nico (1 de noviembre de 2011). "Peroxidasa de rábano picante como catalizador para la polimerización radical por transferencia de átomos: Peroxidasa de rábano picante como catalizador para la transferencia de átomos...". Comunicaciones rápidas macromoleculares . 32 (21): 1710–1715. doi :10.1002/marc.201100349.
- ^ Catálisis enzimática para polimerización radical por desactivación reversible. Ruoyu Li, Weina Kong, Zesheng An. Angew. Chem. Int. Ed. 2022, 61, e202202033 https://doi.org/10.1002/ange.202202033
- ^ Li, Ruoyu; Kong, Weina; An, Zesheng (14 de febrero de 2023). "Control de la polimerización radical con biocatalizadores". Macromolecules . 56 (3): 751–761. doi :10.1021/acs.macromol.2c02307. ISSN 0024-9297.
![{\displaystyle {\begin{array}{ll}{\color {Azul}{\ce {R}}}{-}{\color {Rojo}{\ce {X}}}+{\color {Verde} {\ce {Cu^{I}}}}{\color {Rojo}{\ce {X}}}/{\ce {L}}\ {\overset {k_{a,0}}{\underset { k_{d,0}}{\ce {<<=>}}}}\ {\color {Verde}{\ce {Cu^{II}}}}{\color {Rojo}{\ce {X2} }}/{\ce {L}}+{\color {Azul}{\ce {R}}}^{\cdot }&K_{\ce {ATRP,0}}={\frac {k_{a,0 }}{k_{d,0}}}\\{\color {Azul}{\ce {R}}}^{\cdot }{\ce {+M->[k_{\ce {add}}]}}{\color {Azul}{\ce {R}}}{\ce {-P1^{.}}}\\2{\color {Azul}{\ce {R}}} ^{\cdot }{\ce {->[k_{t,0}]}}{\begin{Bmatrix}{\color {Azul}{\ce {R}}}{-}{\color {Azul} {\ce {R}}}\\{\ce {o}}\\{\color {Azul}{\ce {R}}}^{=}+{\color {Azul}{\ce {R} }}{\ce {H}}\end{Bmatrix}}\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8d22caa49b8487dcf7c567e3a374e6eda1eb8269)
![{\displaystyle {\begin{array}{ll}{\color {Azul}{\ce {R}}}{\ce {-P_{\mathit {n}}}}{-}{\color {Rojo} {\ce {X}}}+{\color {Verde}{\ce {Cu^{I}}}}{\color {Rojo}{\ce {X}}}/{\ce {L}}\ {\overset {k_{a}}{\underset {k_{d}}{\ce {<<=>}}}}\ {\color {Verde}{\ce {Cu^{II}}}}{ \color {Rojo}{\ce {X2}}}/{\ce {L}}+{\color {Azul}{\ce {R}}}{\ce {-P_{\mathit {n}}^ {.}}}&{\begin{array}{l}{\ce {ATRP}}\\{\ce {activación/desactivación}}\\{\ce {equilibrio}}\\K_{\ce {ATRP}}={\frac {k_{a}}{k_{d}}}\end{array}}\\\left.{\begin{aligned}{\ color {Azul}{\ce {R}}}{\ce {-P_{\mathit {n}}^{.}}}+{\ce {M}}\ &{\ce {->[k_{ p}]}}{\color {Azul}{\ce {R}}}{\ce {-P_{{\mathit {n}}+1}^{.}}}\\2{\color {Azul }{\ce {R}}}{\ce {-P_{\mathit {n}}^{.}}}\ &{\ce {->[k_{t}]}}{\begin{Bmatrix} {\color {Azul}{\ce {R}}}{\ce {-P_{\mathit {n}}-P_{\mathit {n}}}}{-}{\color {Azul}{\ce {R}}}\\{\ce {o}}\\{\color {Azul}{\ce {R}}}{\ce {-P_{\mathit {n}}^ {=}}}+{\color {Azul}{\ce {R}}}{\ce {-P_{\mathit {n}}-H}}\end{Bmatrix}}\quad \end{alineado} }\right\}&{\begin{array}{l}{\text{Igual que la polimerización radical convencional}}\\{\text{}}\end{array}}\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/39fb52256b72949b3c61f2aa8614f152f1eb4e96)

![{\displaystyle [{\ce {RP}}_{n}^{\bullet }]=K_{{\ce {ATRP}}}\cdot [{\ce {RP}}_{n}{\ce { -X}}]\cdot {\frac {{\ce {[Cu^{I}X/L]}}}{{\ce {[Cu^{II}X2/L]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/30cc5d17e88a09ffcf5c87757ad665152bca820d)

![{\displaystyle \sum [{\color {Rojo}{\ce {X}}}]={\ce {Constante}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/15f7b07e94d49b27f87f64e49678cd97ba334e7d)
![{\displaystyle \underbrace {{[{\color {Azul}{\ce {R}}}{-}{\color {Rojo}{\ce {X}}}]_{0}}-{[{\color {Azul}{\ce {R}}}{-}{\color {Rojo}{\ce {X}}}]}_{t}-{[{\color {Azul}{\ce {R}}}{-}{\ce {P}}_{\mathit {n}}{-}{\color {Rojo}{\ce {X}}}]}_{t}} _{\begin{matrix}{\text{Pérdida de cadena}}\\{\text{funcionalidad final}}\end{matrix}}=\underbrace {({[{\color {Verde}{\ce {Cu^{I}}}}{\color {Rojo}{\ce {X}}}/{\ce {L}}]}_{t}+2{[{\color {Verde}{\ce {Cu^{II}}}}{\color {Rojo}{\ce {X2}}}/{\ce {L}}]}_{t})-({{[{\color {Verde}{\ce {Cu^{I}}}}{\color {Rojo}{\ce {X}}}/{\ce {L}}]_{0}}+2[{\color {Verde}{\ce {Cu^{II}}}}{\color {Rojo}{\ce {X2}}}/{\ce {L}}]_{0}})} \text{Cambio en }}{\ce {[Cu^{I}X/L]}}{\text{ y }}{\ce {[Cu^{II}X2/L]}}}+\underbrace {{[{\color {Naranja}{\ce {RA}}}{-}{\color {Rojo}{\ce {X}}}]}_{t}} _{\begin{matrix}{\text{Transferencia X en}}\\{\text{activador}}\\{\text{regeneración}}\end{matriz}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ccf14e7e9ac0a21917eab3e34883db3bf5ecef07)