Actinio
El actinio es un elemento químico de símbolo Ac y número atómico 89. Fue aislado por primera vez por Friedrich Oskar Giesel en 1902, quien le dio el nombre de emanio ; el elemento obtuvo su nombre al ser identificado erróneamente con una sustancia que André-Louis Debierne encontró en 1899 y llamó actinio. La serie de los actínidos , un conjunto de 15 elementos entre el actinio y el lawrencio en la tabla periódica , recibe su nombre del actinio. Junto con el polonio , el radio y el radón , el actinio fue uno de los primeros elementos radiactivos no primordiales en ser aislados.
El actinio, un metal radiactivo blando de color blanco plateado , reacciona rápidamente con el oxígeno y la humedad del aire formando una capa blanca de óxido de actinio que evita una mayor oxidación. Al igual que la mayoría de los lantánidos y muchos actínidos , el actinio asume el estado de oxidación +3 en casi todos sus compuestos químicos. El actinio se encuentra solo en trazas en minerales de uranio y torio como el isótopo 227 Ac, que se desintegra con una vida media de 21,772 años, emitiendo predominantemente partículas beta y, a veces , alfa , y 228 Ac, que es beta activo con una vida media de 6,15 horas. Una tonelada de uranio natural en mineral contiene aproximadamente 0,2 miligramos de actinio-227, y una tonelada de torio contiene aproximadamente 5 nanogramos de actinio-228. La estrecha similitud de las propiedades físicas y químicas del actinio y el lantano hace que la separación del actinio del mineral sea poco práctica. En cambio, el elemento se prepara, en cantidades de miligramos, mediante la irradiación neutrónica de 226 Ra en un reactor nuclear . Debido a su escasez, su alto precio y su radiactividad, el actinio no tiene un uso industrial significativo. Sus aplicaciones actuales incluyen una fuente de neutrones y un agente para la radioterapia .
Historia
André-Louis Debierne , un químico francés, anunció el descubrimiento de un nuevo elemento en 1899. [5] Lo separó de los residuos de pechblenda que dejaron Marie y Pierre Curie después de haber extraído el radio . [6] En 1899, Debierne describió la sustancia como similar al titanio [7] y (en 1900) como similar al torio . [8] Friedrich Oskar Giesel encontró en 1902 [9] una sustancia similar al lantano y la llamó "emanium" en 1904. [10] Después de una comparación de las vidas medias de las sustancias determinadas por Debierne, [11] Harriet Brooks en 1904 y Otto Hahn y Otto Sackur en 1905, el nombre elegido por Debierne para el nuevo elemento se mantuvo porque tenía antigüedad, a pesar de las propiedades químicas contradictorias que afirmó para el elemento en diferentes momentos. [12] [13]
Los artículos publicados en la década de 1970 [14] y posteriormente [6] sugieren que los resultados de Debierne publicados en 1904 entran en conflicto con los informados en 1899 y 1900. Además, la química ahora conocida del actinio excluye su presencia como algo más que un constituyente menor de los resultados de Debierne de 1899 y 1900; de hecho, las propiedades químicas que informó hacen probable que, en cambio, hubiera identificado accidentalmente el protactinio , que no se descubriría hasta catorce años después, solo para que desapareciera debido a su hidrólisis y adsorción en su equipo de laboratorio . Esto ha llevado a algunos autores a defender que solo a Giesel se le debe atribuir el descubrimiento. [2] Adloff propone una visión menos confrontativa del descubrimiento científico. [6] Sugiere que las críticas retrospectivas a las primeras publicaciones deberían mitigarse por el estado naciente de la radioquímica en aquel momento: destacando la prudencia de las afirmaciones de Debierne en los artículos originales, señala que nadie puede afirmar que la sustancia de Debierne no contenía actinio. [6] Debierne, a quien ahora la gran mayoría de los historiadores considera el descubridor, perdió el interés en el elemento y abandonó el tema. A Giesel, por otro lado, se le puede atribuir con justicia la primera preparación de actinio radioquímicamente puro y la identificación de su número atómico 89. [14]
El nombre actinio proviene del griego antiguo aktis, aktinos (ακτίς, ακτίνος), que significa rayo. [15] Su símbolo Ac también se utiliza en abreviaturas de otros compuestos que no tienen nada que ver con el actinio, como acetilo , acetato [16] y, a veces, acetaldehído . [17]
Propiedades
El actinio es un elemento metálico radioactivo , de color blanco plateado y blando [18] [19] . Su módulo de corte estimado es similar al del plomo [20] . Debido a su fuerte radiactividad, el actinio brilla en la oscuridad con una luz azul pálida, que se origina en el aire circundante ionizado por las partículas energéticas emitidas [21] . El actinio tiene propiedades químicas similares al lantano y otros lantánidos, y por lo tanto estos elementos son difíciles de separar cuando se extraen de los minerales de uranio. La extracción con disolventes y la cromatografía iónica se utilizan comúnmente para la separación [22] .
El primer elemento de los actínidos , el actinio, dio al conjunto su nombre, de forma muy similar a como lo había hecho el lantano con los lantánidos . Los actínidos son mucho más diversos que los lantánidos [23] y, por lo tanto, no fue hasta 1945 que el cambio más significativo en la tabla periódica de Dmitri Mendeleev desde el reconocimiento de los lantánidos, la introducción de los actínidos , fue generalmente aceptado después de la investigación de Glenn T. Seaborg sobre los elementos transuránicos [24] (aunque había sido propuesto ya en 1892 por el químico británico Henry Bassett). [25]
El actinio reacciona rápidamente con el oxígeno y la humedad del aire formando una capa blanca de óxido de actinio que impide una mayor oxidación. [18] Al igual que con la mayoría de los lantánidos y actínidos, el actinio existe en el estado de oxidación +3, y los iones Ac 3+ son incoloros en soluciones. [26] El estado de oxidación +3 se origina a partir de la configuración electrónica [Rn] 6d 1 7s 2 del actinio, con tres electrones de valencia que se donan fácilmente para dar la estructura de capa cerrada estable del gas noble radón . [19] Aunque los orbitales 5f están desocupados en un átomo de actinio, se puede utilizar como orbital de valencia en complejos de actinio y, por lo tanto, los autores que trabajan en él generalmente lo consideran el primer elemento 5f. [27] [28] [29] Ac 3+ es el más grande de todos los iones tripositivos conocidos y su primera esfera de coordinación contiene aproximadamente 10,9 ± 0,5 moléculas de agua. [30]
Compuestos químicos
Debido a la intensa radiactividad del actinio, solo se conoce un número limitado de compuestos de actinio. Estos incluyen: AcF 3 , AcCl 3 , AcBr 3 , AcOF , AcOCl, AcOBr, Ac 2 S 3 , Ac 2 O 3 , AcPO 4 y Ac(NO 3 ) 3 . Todos ellos contienen actinio en el estado de oxidación +3. [26] [31] En particular, las constantes de red de los compuestos análogos de lantano y actinio difieren solo en un pequeño porcentaje. [31]
| Fórmula | color | simetría | grupo espacial | No | Símbolo de Pearson | a (p.m.) | b (de la tarde) | c (p.m.) | O | densidad, g/ cm3 |
|---|---|---|---|---|---|---|---|---|---|---|
| C.A | plateado | Comisión Federal de Comercio [32] | FM 3 m | 225 | cF4 | 531.1 | 531.1 | 531.1 | 4 | 10.07 |
| AcH2 | desconocido | cúbico [32] | FM 3 m | 225 | cF12 | 567 | 567 | 567 | 4 | 8.35 |
| Ac2O3 | blanco [18] | trigonal [33] | P3m1 | 164 | hP5 | 408 | 408 | 630 | 1 | 9.18 |
| Ac2S3 | negro | cúbico [34] | Yo 4 3d | 220 | cI28 | 778,56 | 778,56 | 778,56 | 4 | 6.71 |
| AcF3 | blanco [35] | hexagonal [31] [33] | P3c1 | 165 | hP24 | 741 | 741 | 755 | 6 | 7.88 |
| AcCl3 | blanco | hexagonal [31] [36] | P6 3 /metro | 165 | hP8 | 764 | 764 | 456 | 2 | 4.8 |
| AcBr3 | blanco [31] | hexagonal [36] | P6 3 /metro | 165 | hP8 | 764 | 764 | 456 | 2 | 5,85 |
| AcOF | blanco [37] | cúbico [31] | FM 3 m | 593.1 | 8.28 | |||||
| AcOCl | blanco | tetragonal [31] | 424 | 424 | 707 | 7.23 | ||||
| AcOBr | blanco | tetragonal [31] | 427 | 427 | 740 | 7,89 | ||||
| AcPO4 · 0,5H2O | desconocido | hexagonal [31] | 721 | 721 | 664 | 5.48 |
Aquí a , b y c son constantes de red, No es el número de grupo espacial y Z es el número de unidades de fórmula por celda unitaria . La densidad no se midió directamente, sino que se calculó a partir de los parámetros de red.
Óxidos
El óxido de actinio ( Ac2O3 ) se puede obtener calentando el hidróxido a 500 °C (932 °F) o el oxalato a 1100 °C (2010 °F), en vacío. Su red cristalina es isotípica con los óxidos de la mayoría de los metales de tierras raras trivalentes. [31]
Haluros
El trifluoruro de actinio se puede producir en solución o en una reacción sólida. La primera reacción se lleva a cabo a temperatura ambiente, añadiendo ácido fluorhídrico a una solución que contiene iones de actinio. En el segundo método, el metal actinio se trata con vapores de fluoruro de hidrógeno a 700 °C (1292 °F) en una configuración totalmente de platino. El tratamiento del trifluoruro de actinio con hidróxido de amonio a 900–1000 °C (1650–1830 °F) produce oxifluoruro AcOF. Mientras que el oxifluoruro de lantano se puede obtener fácilmente quemando trifluoruro de lantano en aire a 800 °C (1470 °F) durante una hora, un tratamiento similar del trifluoruro de actinio no produce AcOF y solo da como resultado la fusión del producto inicial. [31] [37]
- AcF3 + 2NH3 + H2O → AcOF + 2NH4F
El tricloruro de actinio se obtiene haciendo reaccionar hidróxido u oxalato de actinio con vapores de tetracloruro de carbono a temperaturas superiores a 960 °C (1760 °F). De manera similar al oxifluoruro, el oxicloruro de actinio se puede preparar hidrolizando el tricloruro de actinio con hidróxido de amonio a 1000 °C (1830 °F). Sin embargo, a diferencia del oxifluoruro, el oxicloruro se puede sintetizar fácilmente encendiendo una solución de tricloruro de actinio en ácido clorhídrico con amoníaco . [31]
La reacción del bromuro de aluminio y el óxido de actinio produce tribromuro de actinio:
- Ac 2 O 3 + 2 AlBr 3 → 2 AcBr 3 + Al 2 O 3
y tratándolo con hidróxido de amonio a 500 °C (932 °F) se obtiene el oxibromuro AcOBr. [31]
Otros compuestos
El hidruro de actinio se obtuvo por reducción del tricloruro de actinio con potasio a 300 °C (572 °F), y su estructura se dedujo por analogía con el hidruro LaH 2 correspondiente . La fuente de hidrógeno en la reacción fue incierta. [38]
La mezcla de fosfato monosódico (NaH 2 PO 4 ) con una solución de actinio en ácido clorhídrico produce fosfato de actinio hemihidrato de color blanco (AcPO 4 ·0,5H 2 O), y el calentamiento del oxalato de actinio con vapores de sulfuro de hidrógeno a 1400 °C (2550 °F) durante unos minutos da como resultado un sulfuro de actinio negro Ac 2 S 3 . Es posible que se produzca actuando con una mezcla de sulfuro de hidrógeno y disulfuro de carbono sobre óxido de actinio a 1000 °C (1830 °F). [31]
Isótopos
El actinio natural está compuesto principalmente de dos isótopos radiactivos :227
Ac (de la familia radiactiva de235
U ) y228
Ac (una nieta de232
El ).227
El Ac se desintegra principalmente como un emisor beta con una energía muy pequeña, pero en el 1,38% de los casos emite una partícula alfa , por lo que se puede identificar fácilmente mediante espectrometría alfa . [2] Se han identificado treinta y tres radioisótopos , siendo el más estable227
Ac con una vida media de 21,772 años,225
Ac con una vida media de 10,0 días y226
Ac con una vida media de 29,37 horas. Todos los demás isótopos radiactivos tienen vidas medias inferiores a 10 horas y la mayoría de ellos tienen vidas medias inferiores a un minuto. El isótopo conocido de vida media más corta del actinio es217
Ac (vida media de 69 nanosegundos) que se desintegra mediante desintegración alfa . El actinio también tiene dos estados meta conocidos . [39] Los isótopos más importantes para la química son 225 Ac, 227 Ac y 228 Ac. [2]
Purificado227
El ac entra en equilibrio con sus productos de desintegración después de aproximadamente medio año. Se desintegra de acuerdo con su vida media de 21,772 años emitiendo principalmente partículas beta (98,62%) y algunas partículas alfa (1,38%); [39] los productos de desintegración sucesivos son parte de la serie del actinio . Debido a las bajas cantidades disponibles, la baja energía de sus partículas beta (máximo 44,8 keV) y la baja intensidad de la radiación alfa,227
El Ac es difícil de detectar directamente por su emisión y, por lo tanto, se rastrea a través de sus productos de desintegración. [26] Los isótopos del actinio varían en peso atómico desde 203 u (203
Ac ) a 236 u (236
Ac ). [39]
| Isótopo | Producción | Decadencia | Vida media |
|---|---|---|---|
| 221 Ac | 232 Th(d,9n)→ 225 Pa(α)→ 221 Ac | alfa | 52 ms |
| 222 Ac | 232 Th(d,8n)→ 226 Pa(α)→ 222 Ac | alfa | 5,0 segundos |
| 223 Ac | 232 Th(d,7n)→ 227 Pa(α)→ 223 Ac | alfa | 2,1 minutos |
| 224 Ac | 232 Th(d,6n)→ 228 Pa(α)→ 224 Ac | alfa | 2,78 horas |
| 225 CA | 232 Th(n,γ)→ 233 Th(β − )→ 233 Pa(β − )→ 233 U(α)→ 229 Th(α)→ 225 Ra(β − )→ 225 Ac | alfa | 10 días |
| 226 Ac | 226 Ra(d,2n)→ 226 Ac | Captura de electrones α, β − | 29,37 horas |
| 227 Ac | 235 U(α)→ 231 Th(β − )→ 231 Pa(α)→ 227 Ac | α, β − | 21,77 años |
| 228 Ac | 232 Th(α)→ 228 Ra(β − )→ 228 Ac | β − | 6,15 horas |
| 229 Ac | 228 Ra(n,γ)→ 229 Ra(β − )→ 229 Ac | β − | 62,7 minutos |
| 230 Ac | 232 Th(d,α)→ 230 Ac | β − | 122 segundos |
| 231 Ac | 232Th (γ,p) → 231Ac | β − | 7,5 minutos |
| 232 Ac | 232 Th(n,p)→ 232 Ac | β − | 119 segundos |
Ocurrencia y síntesis

El actinio se encuentra solo en trazas en minerales de uranio (una tonelada de uranio en mineral contiene alrededor de 0,2 miligramos de 227 Ac [40] [41] ) y en minerales de torio , que contienen alrededor de 5 nanogramos de 228 Ac por una tonelada de torio. El isótopo de actinio 227 Ac es un miembro transitorio de la cadena de desintegración de la serie uranio-actinio , que comienza con el isótopo original 235 U (o 239 Pu ) y termina con el isótopo estable de plomo 207 Pb . El isótopo 228 Ac es un miembro transitorio de la cadena de desintegración de la serie del torio , que comienza con el isótopo original 232 Th y termina con el isótopo estable de plomo 208 Pb . Otro isótopo de actinio ( 225 Ac) está presente transitoriamente en la cadena de desintegración de la serie del neptunio , comenzando con 237 Np (o 233 U ) y terminando con talio ( 205 Tl ) y bismuto casi estable ( 209 Bi ); aunque todo el 237 Np primordial se ha desintegrado, se produce continuamente por reacciones de eliminación de neutrones en 238 U natural.
La baja concentración natural y la estrecha similitud de las propiedades físicas y químicas con las del lantano y otros lantánidos, que siempre son abundantes en los minerales que contienen actinio, hacen que la separación del actinio del mineral sea poco práctica. La muestra de actinio más concentrada preparada a partir de materia prima consistió en 7 microgramos de 227 Ac en menos de 0,1 miligramos de La 2 O 3 , y nunca se logró una separación completa. [42] En cambio, el actinio se prepara, en cantidades de miligramos, mediante la irradiación neutrónica de 226 Ra en un reactor nuclear . [41] [43]
El rendimiento de la reacción es de aproximadamente el 2% del peso del radio. El 227 Ac puede capturar neutrones adicionales, lo que da como resultado pequeñas cantidades de 228 Ac. Después de la síntesis, el actinio se separa del radio y de los productos de desintegración y fusión nuclear, como el torio, el polonio, el plomo y el bismuto. La extracción se puede realizar con una solución de tenoiltrifluoroacetona - benceno a partir de una solución acuosa de los productos de radiación, y la selectividad para un determinado elemento se logra ajustando el pH (a aproximadamente 6,0 para el actinio). [40] Un procedimiento alternativo es el intercambio aniónico con una resina apropiada en ácido nítrico , que puede dar como resultado un factor de separación de 1.000.000 para el radio y el actinio frente al torio en un proceso de dos etapas. Luego, el actinio se puede separar del radio, con una proporción de aproximadamente 100, utilizando una resina de intercambio catiónico de baja reticulación y ácido nítrico como eluyente . [44]
El 225 Ac se produjo artificialmente por primera vez en el Instituto de Elementos Transuránicos (ITU) en Alemania utilizando un ciclotrón y en el Hospital St George en Sydney utilizando un acelerador lineal en 2000. [45] Este isótopo raro tiene aplicaciones potenciales en radioterapia y se produce de manera más eficiente bombardeando un objetivo de radio-226 con iones de deuterio de 20 a 30 MeV . Esta reacción también produce 226 Ac que, sin embargo, se desintegra con una vida media de 29 horas y, por lo tanto, no contamina el 225 Ac. [46]
El metal actinio se ha preparado mediante la reducción de fluoruro de actinio con vapor de litio en vacío a una temperatura entre 1100 y 1300 °C (2010 y 2370 °F). Las temperaturas más altas dieron como resultado la evaporación del producto y las más bajas dieron lugar a una transformación incompleta. Se eligió el litio entre otros metales alcalinos porque su fluoruro es el más volátil. [15] [18]
Aplicaciones
Debido a su escasez, alto precio y radiactividad, el 227 Ac actualmente no tiene un uso industrial significativo, pero el 225 Ac se está estudiando actualmente para su uso en tratamientos contra el cáncer, como terapias alfa dirigidas. [15] [29] El 227 Ac es altamente radiactivo y, por lo tanto, se estudió para su uso como elemento activo de generadores termoeléctricos de radioisótopos , por ejemplo, en naves espaciales. El óxido de 227 Ac prensado con berilio también es una fuente de neutrones eficiente con una actividad que excede la de los pares estándar americio-berilio y radio-berilio. [47] En todas esas aplicaciones, el 227 Ac (una fuente beta) es simplemente un progenitor que genera isótopos emisores alfa tras su desintegración. El berilio captura partículas alfa y emite neutrones debido a su gran sección transversal para la reacción nuclear (α,n):
Las fuentes de neutrones de 227 AcBe se pueden aplicar en una sonda de neutrones , un dispositivo estándar para medir la cantidad de agua presente en el suelo, así como la humedad/densidad para el control de calidad en la construcción de carreteras. [48] [49] Estas sondas también se utilizan en aplicaciones de registro de pozos, en radiografía de neutrones , tomografía y otras investigaciones radioquímicas. [50]
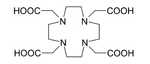
El 225 Ac se aplica en medicina para producir 213 Bi en un generador reutilizable [44] o se puede utilizar solo como agente para radioterapia , en particular terapia alfa dirigida (TAT). Este isótopo tiene una vida media de 10 días, lo que lo hace mucho más adecuado para la radioterapia que el 213 Bi (vida media de 46 minutos). [29] Además, el 225 Ac se desintegra en 209 Bi no tóxico en lugar de plomo tóxico , que es el producto final en las cadenas de desintegración de varios otros isótopos candidatos, a saber, 227 Th, 228 Th y 230 U. [29] No solo el propio 225 Ac, sino también sus hijas, emiten partículas alfa que matan las células cancerosas en el cuerpo. La principal dificultad con la aplicación del 225 Ac era que la inyección intravenosa de complejos de actinio simples daba como resultado su acumulación en los huesos y el hígado durante un período de decenas de años. Como resultado, después de que las células cancerosas fueran rápidamente eliminadas por las partículas alfa del 225 Ac, la radiación del actinio y sus descendientes podría inducir nuevas mutaciones. Para resolver este problema, el 225 Ac se unió a un agente quelante , como el citrato , el ácido etilendiaminotetraacético (EDTA) o el ácido dietilentriaminopentaacético (DTPA). Esto redujo la acumulación de actinio en los huesos, pero la excreción del cuerpo siguió siendo lenta. Se obtuvieron resultados mucho mejores con agentes quelantes como HEHA ( ácido 1,4,7,10,13,16-hexaazaciclohexadecano-N,N′,N″,N‴,N‴′,N‴″-hexaacético ) [51] o DOTA ( ácido 1,4,7,10-tetraazaciclododecano-1,4,7,10-tetraacético ) acoplado a trastuzumab , un anticuerpo monoclonal que interfiere con el receptor HER2/neu . La última combinación de administración se probó en ratones y demostró ser efectiva contra la leucemia , el linfoma , el cáncer de mama , de ovario , neuroblastoma y de próstata . [52] [53] [54]
La vida media media del 227 Ac (21,77 años) lo convierte en un isótopo radiactivo muy conveniente para modelar la lenta mezcla vertical de las aguas oceánicas. Los procesos asociados no se pueden estudiar con la precisión requerida mediante mediciones directas de las velocidades de la corriente (del orden de 50 metros por año). Sin embargo, la evaluación de los perfiles de profundidad de concentración para diferentes isótopos permite estimar las tasas de mezcla. La física detrás de este método es la siguiente: las aguas oceánicas contienen 235 U homogéneamente disperso. Su producto de desintegración, 231 Pa, precipita gradualmente al fondo, de modo que su concentración primero aumenta con la profundidad y luego permanece casi constante. El 231 Pa se desintegra en 227 Ac; sin embargo, la concentración de este último isótopo no sigue el perfil de profundidad del 231 Pa, sino que aumenta hacia el fondo del mar. Esto ocurre debido a los procesos de mezcla que elevan algo de 227 Ac adicional desde el fondo del mar. De esta forma, el análisis de los perfiles de profundidad de 231 Pa y 227 Ac permite a los investigadores modelar el comportamiento de la mezcla. [55] [56]
Hay predicciones teóricas de que los hidruros de AcHx ( en este caso con presión muy alta) son candidatos para un superconductor cercano a la temperatura ambiente , ya que tienen una Tc significativamente mayor que el H3S , posiblemente cerca de 250 K. [57]
Precauciones
El 227 Ac es altamente radiactivo y los experimentos con él se llevan a cabo en un laboratorio especialmente diseñado, equipado con una caja de guantes hermética . Cuando se administra tricloruro de actinio por vía intravenosa a ratas, aproximadamente el 33% del actinio se deposita en los huesos y el 50% en el hígado. Su toxicidad es comparable a la del americio y el plutonio, pero ligeramente inferior. [58] Para cantidades traza, son suficientes las campanas de extracción con buena aireación; para cantidades en gramos, son necesarias celdas calientes con protección contra la intensa radiación gamma emitida por el 227 Ac. [59]
Véase también
Notas
Referencias
- ^ Wall, Greg (8 de septiembre de 2003). "C&EN: It's Elemental: The Periodic Table - Actinium". C&EN: It's Elemental: The Periodic Table . Noticias de ingeniería y química . Consultado el 2 de junio de 2011 .
- ^ abcdef Kirby, Harold W.; Morss, Lester R. (2006). "Actinio". La química de los elementos actínidos y transactínidos . p. 18. doi :10.1007/1-4020-3598-5_2. ISBN 978-1-4020-3555-5.
- ^ Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ "Actinio (Ac) | AMERICAN ELEMENTS ®". American Elements: The Materials Science Company . Consultado el 25 de octubre de 2024 .
- ^ abcd Adloff, JP (2000). "El centenario de un descubrimiento controvertido: el actinio". Radiochim. Acta . 88 (3–4_2000): 123–128. doi :10.1524/ract.2000.88.3-4.123. S2CID 94016074.
- ^ Debierne, André-Louis (1899). "Sur un nouvelle matière radioactiva". Comptes Rendus (en francés). 129 : 593–595.
- ^ Debierne, André-Louis (1900-1901). "Sur un nouvelle matière radio-actif - l'actinium". Comptes Rendus (en francés). 130 : 906–908.
- ^ Giesel, Friedrich Oskar (1902). "Ueber Radium und radioactive Stoffe". Berichte der Deutschen Chemischen Gesellschaft (en alemán). 35 (3): 3608–3611. doi :10.1002/cber.190203503187.
- ^ Giesel, Friedrich Oskar (1904). "Ueber den Emanationskörper (Emanio)". Berichte der Deutschen Chemischen Gesellschaft (en alemán). 37 (2): 1696–1699. doi :10.1002/cber.19040370280.
- ^ Debierne, André-Louis (1904). "Sobre el actinio". Comptes Rendus (en francés). 139 : 538–540.
- ^ Giesel, Friedrich Oskar (1904). "Ueber Emanio". Berichte der Deutschen Chemischen Gesellschaft (en alemán). 37 (2): 1696–1699. doi :10.1002/cber.19040370280.
- ^ Giesel, Friedrich Oskar (1905). "Ueber Emanio". Berichte der Deutschen Chemischen Gesellschaft (en alemán). 38 (1): 775–778. doi :10.1002/cber.190503801130.
- ^ ab Kirby, Harold W. (1971). "El descubrimiento del actinio". Isis . 62 (3): 290–308. doi :10.1086/350760. JSTOR 229943. S2CID 144651011.
- ^ abc Hammond, CR Los elementos en Lide, DR, ed. (2005). Manual de química y física del CRC (86.ª ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Gilley, Cynthia Brooke; Universidad de California, San Diego. Química (2008). Nuevos isocianuros convertibles para la reacción de Ugi; aplicación a la síntesis estereoselectiva de omuralida. p. 11. ISBN 978-0-549-79554-4.
- ^ Reimers, Jeffrey R. (2011). Métodos computacionales para sistemas grandes: enfoques de estructura electrónica para biotecnología y nanotecnología. John Wiley and Sons. pág. 575. ISBN 978-0-470-48788-4.
- ^ abcd Stites, Joseph G.; Salutsky, Murrell L.; Stone, Bob D. (1955). "Preparación de actinio metálico". J. Am. Chem. Soc . 77 (1): 237–240. doi :10.1021/ja01606a085.
- ^ ab Actinium , en Encyclopædia Britannica, 15ª edición, 1995, p. 70
- ^ Seitz, Frederick y Turnbull, David (1964) Física del estado sólido: avances en investigación y aplicaciones. Academic Press. ISBN 0-12-607716-9 pp. 289–291
- ^ Richard A. Muller (2010). Física y tecnología para futuros presidentes: una introducción a la física esencial que todo líder mundial necesita saber. Princeton University Press. pp. 136–. ISBN 978-0-691-13504-5.
- ^ Katz, JJ; Manning, WM (1952). "Química de los elementos actínidos". Revista anual de ciencia nuclear . 1 : 245–262. Código Bibliográfico :1952ARNPS...1..245K. doi :10.1146/annurev.ns.01.120152.001333.
- ^ Jørgensen, Christian (1973). "La conexión débil entre la configuración electrónica y el comportamiento químico de los elementos pesados (transuránicos)". Angewandte Chemie International Edition . 12 (1): 12–19. doi :10.1002/anie.197300121.
- ^ Seaborg, Glenn T. (1946). "Los elementos transuránicos". Science . 104 (2704): 379–386. Bibcode :1946Sci...104..379S. doi :10.1126/science.104.2704.379. JSTOR 1675046. PMID 17842184.
- ^ Thyssen, P.; Binnemans, K. (2011). "Acomodación de las tierras raras en la tabla periódica: un análisis histórico". En Gschneidner, KA Jr.; Bünzli, JC.G; Vecharsky, Bünzli (eds.). Manual sobre la física y la química de las tierras raras . Vol. 41. Ámsterdam: Elsevier. págs. 1–94. doi :10.1016/B978-0-444-53590-0.00001-7. ISBN 978-0-444-53590-0.
- ^ abc Actinium, Gran Enciclopedia Soviética (en ruso)
- ^ Tomeček, Josef; Li, Cen; Schreckenbach, Georg (2023). "Química de coordinación del actinio: un estudio de la teoría funcional de la densidad con ligandos monodentados y bidentados". Journal of Computational Chemistry . 44 (3): 334–345. doi :10.1002/jcc.26929. PMID 35668552. S2CID 249433367.
- ^ Deblonde, Gauthier J.-P.; Zavarin, Mavrik; Kersting, Annie B. (2021). "Las propiedades de coordinación y el radio iónico del actinio: un enigma de 120 años". Coordination Chemistry Reviews . 446 : 214130. doi : 10.1016/j.ccr.2021.214130 .
- ^ abcd Deblonde, Gauthier J.-P.; Abergel, Rebecca J. (21 de octubre de 2016). "Actinio activo". Nature Chemistry . 8 (11): 1084. Bibcode :2016NatCh...8.1084D. doi : 10.1038/nchem.2653 . ISSN 1755-4349. OSTI 1458479 . PMID 27768109.
- ^ Ferrier, Maryline G.; Stein, Benjamin W.; Batista, Enrique R.; Berg, John M.; Birnbaum, Eva R.; Engle, Jonathan W.; John, Kevin D.; Kozimor, Stosh A.; Lezama Pacheco, Juan S.; Redman, Lindsay N. (2017). "Síntesis y caracterización del ion aquo de actinio". ACS Central Science . 3 (3): 176–185. doi :10.1021/acscentsci.6b00356. PMC 5364452 . PMID 28386595.
- ^ abcdefghijklmn Fried, Sherman; Hagemann, French; Zachariasen, WH (1950). "La preparación e identificación de algunos compuestos puros de actinio". Revista de la Sociedad Química Americana . 72 (2): 771–775. doi :10.1021/ja01158a034.
- ^ ab Farr, J.; Giorgi, AL; Bowman, MG; Money, RK (1961). "La estructura cristalina del metal actinio y del hidruro de actinio". Journal of Inorganic and Nuclear Chemistry . 18 : 42–47. doi :10.1016/0022-1902(61)80369-2. OSTI 4397640.
- ^ ab Zachariasen, WH (1949). "Estudios químicos cristalinos de la serie 5f de elementos. XII. Nuevos compuestos que representan tipos de estructura conocidos". Acta Crystallographica . 2 (6): 388–390. Bibcode :1949AcCry...2..388Z. doi : 10.1107/S0365110X49001016 .
- ^ Zachariasen, WH (1949). «Estudios químicos cristalinos de la serie 5f de elementos. VI. El tipo de estructura Ce2S3-Ce3S4» (PDF) . Acta Crystallographica . 2 (1): 57–60. Código Bibliográfico :1949AcCry...2...57Z. doi :10.1107/S0365110X49000126. Archivado (PDF) desde el original el 9 de octubre de 2022.
- ^ Meyer, pág. 71
- ^ ab Zachariasen, WH (1948). "Estudios químicos cristalinos de la serie 5f de elementos. I. Nuevos tipos de estructura". Acta Crystallographica . 1 (5): 265–268. Código Bibliográfico :1948AcCry...1..265Z. doi : 10.1107/S0365110X48000703 .
- ^ por Meyer, págs. 87-88
- ^ Meyer, pág. 43
- ^ abc Audi, G.; Kondev, FG; Wang, M.; Huang, WJ; Naimi, S. (2017). "La evaluación NUBASE2016 de las propiedades nucleares" (PDF) . Chinese Physics C . 41 (3): 030001. Bibcode :2017ChPhC..41c0001A. doi :10.1088/1674-1137/41/3/030001.
- ^ ab Hagemann, French (1950). "El aislamiento del actinio". Revista de la Sociedad Química Americana . 72 (2): 768–771. doi :10.1021/ja01158a033.
- ^ ab Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 946. ISBN 978-0-08-037941-8.
- ^ Kirby, HW; Morss, Lester R. (2010). Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean (eds.). Actinio. Dordrecht: Springer Países Bajos. págs. 18–51. doi :10.1007/978-94-007-0211-0_2. ISBN 978-94-007-0210-3.
- ^ Emeleus, HJ (1987). Avances en química inorgánica y radioquímica. Academic Press. pp. 16–. ISBN 978-0-12-023631-2.
- ^ ab Bolla, Rose A.; Malkemus, D.; Mirzadeh, S. (2005). "Producción de actinio-225 para radioinmunoterapia mediada por partículas alfa". Applied Radiation and Isotopes . 62 (5): 667–679. Bibcode :2005AppRI..62..667B. doi :10.1016/j.apradiso.2004.12.003. PMID 15763472.
- ^ Melville, G; Allen, Bj (2009). "Producción de Ac-225 mediante ciclotrón y acelerador lineal". Applied Radiation and Isotopes . 67 (4): 549–55. Bibcode :2009AppRI..67..549M. doi :10.1016/j.apradiso.2008.11.012. PMID 19135381.
- ^ Russell, Pamela J.; Jackson, Paul; Kingsley, Elizabeth Anne (2003). Métodos y protocolos para el cáncer de próstata. Humana Press. p. 336. ISBN 0-89603-978-1.[ enlace muerto permanente ]
- ^ Russell, Alan M. y Lee, Kok Loong (2005) Relaciones estructura-propiedad en metales no ferrosos. Wiley. ISBN 0-471-64952-X , págs. 470–471
- ^ Majumdar, DK (2004) Gestión del agua de riego: principios y práctica. ISBN 81-203-1729-7 pág. 108
- ^ Chandrasekharan, H. y Gupta, Navindu (2006) Fundamentos de la ciencia nuclear: aplicación en la agricultura. ISBN 81-7211-200-9 pp. 202 y siguientes
- ^ Dixon, WR; Bielesch, Alice; Geiger, KW (1957). "Espectro de neutrones de una fuente de actinio-berilio". Can. J. Phys . 35 (6): 699–702. Código Bibliográfico :1957CaJPh..35..699D. doi :10.1139/p57-075.
- ^ Deal KA; Davis IA; Mirzadeh S.; Kennel SJ y Brechbiel MW (1999). "Mejora de la estabilidad in vivo de los complejos macrocíclicos de actinio-225". J Med Chem . 42 (15): 2988–9. doi :10.1021/jm990141f. PMID 10425108.
- ^ McDevitt, Michael R.; Mamá, Dangshe; Lai, Lawrence T.; et al. (2001). "Terapia tumoral con nanogeneradores atómicos dirigidos". Ciencia . 294 (5546): 1537-1540. Código bibliográfico : 2001 Ciencia... 294.1537M. doi : 10.1126/ciencia.1064126. PMID 11711678. S2CID 11782419.
- ^ Borchardt, Paul E.; et al. (2003). "Generadores in vivo de actinio-225 dirigidos para la terapia del cáncer de ovario" (PDF) . Cancer Research . 63 (16): 5084–5090. PMID 12941838. Archivado (PDF) del original el 9 de octubre de 2022.
- ^ Ballangrud, AM; et al. (2004). "Trastuzumab (herceptin) marcado con un generador atómico emisor de partículas alfa (actinio-225) dirigido a esferoides de cáncer de mama: eficacia frente a expresión de HER2/neu". Clinical Cancer Research . 10 (13): 4489–97. doi : 10.1158/1078-0432.CCR-03-0800 . PMID 15240541.
- ^ Nozaki, Yoshiyuki (1984). "Exceso de 227 Ac en aguas oceánicas profundas". Nature . 310 (5977): 486–488. Código Bibliográfico :1984Natur.310..486N. doi :10.1038/310486a0. S2CID 4344946.
- ^ Geibert, W.; Rutgers Van Der Loeff, MM; Hanfland, C.; Dauelsberg, H.-J. (2002). "Actinio-227 como trazador de aguas profundas: fuentes, distribución y aplicaciones". Earth and Planetary Science Letters . 198 (1–2): 147–165. Código Bibliográfico :2002E&PSL.198..147G. doi :10.1016/S0012-821X(02)00512-5.
- ^ Semenok, Dmitrii V.; Kvashnin, Alexander G.; Kruglov, Ivan A.; Oganov, Artem R. (19 de abril de 2018). "Hidruros de actinio AcH 10 , AcH 12 , AcH 16 como superconductores convencionales de alta temperatura". The Journal of Physical Chemistry Letters . 9 (8): 1920–1926. arXiv : 1802.05676 . doi :10.1021/acs.jpclett.8b00615. ISSN 1948-7185. PMID 29589444. S2CID 4620593.
- ^ Langham, W.; Storer, J. (1952). "Toxicología de la mezcla de equilibrio de actinio". Los Alamos Scientific Lab.: Informe técnico . doi :10.2172/4406766.
- ^ Keller, Cornelius; Wolf, Walter; Shani, Jashovam. "Radionucleidos, 2. Elementos radiactivos y radionucleidos artificiales". Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi :10.1002/14356007.o22_o15. ISBN 978-3527306732.
Bibliografía
- Meyer, Gerd; Morss, Lester R. (1991). Síntesis de compuestos lantánidos y actínidos. Springer. ISBN 0-7923-1018-7.
Enlaces externos
- Actinio en la Tabla Periódica de Videos (Universidad de Nottingham)
- Banco de datos de sustancias peligrosas de la NLM: actinio radiactivo
- Actinio en Kirby, HW; Morss, LR (2006). Morss; Edelstein, Norman M.; Fuger, Jean (eds.). La química de los elementos actínidos y transactínidos (3.ª ed.). Dordrecht, Países Bajos: Springer. ISBN 978-1-4020-3555-5.




![{\displaystyle {\ce {^{226}_{88}Ra + ^{1}_{0}n -> ^{227}_{88}Ra ->[\beta^-][42.2 \ {\ ce {min}}] ^{227}_{89}Ac}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0971e4ce21fbf7bb4673856bff635b1a64d11fb2)



