Radio

- Fuente de radiación de radio-226.
- Actividad 3300 Bq (3,3 kBq)
El radio es un elemento químico ; su símbolo es Ra y su número atómico es 88. Es el sexto elemento del grupo 2 de la tabla periódica , también conocido como los metales alcalinotérreos . El radio puro es de color blanco plateado, pero reacciona fácilmente con el nitrógeno (en lugar del oxígeno) al exponerse al aire, formando una capa superficial negra de nitruro de radio (Ra 3 N 2 ). Todos los isótopos del radio son radiactivos , siendo el isótopo más estable el radio-226 con una vida media de 1.600 años. Cuando el radio se desintegra, emite radiación ionizante como subproducto, que puede excitar sustancias químicas fluorescentes y causar radioluminiscencia . Por esta propiedad, se utilizó ampliamente en pinturas autoluminiscentes después de su descubrimiento. De los elementos radiactivos que se encuentran en cantidad, el radio se considera particularmente tóxico y es cancerígeno debido a su radiactividad y a la de su producto de desintegración inmediata, el radón, así como a su tendencia a acumularse en los huesos .
El radio, en forma de cloruro de radio , fue descubierto por Marie y Pierre Curie en 1898 a partir de un mineral extraído en Jáchymov . Extrajeron el compuesto de radio de la uraninita y publicaron el descubrimiento en la Academia Francesa de Ciencias cinco días después. El radio fue aislado en su estado metálico por Marie Curie y André-Louis Debierne mediante la electrólisis del cloruro de radio en 1910, y poco después el metal comenzó a producirse a mayor escala en Austria , Estados Unidos y Bélgica . Sin embargo, la cantidad de radio producida a nivel mundial siempre ha sido pequeña en comparación con otros elementos, y en la década de 2010, la producción anual de radio, principalmente a través de la extracción de combustible nuclear gastado , era inferior a 100 gramos.
En la naturaleza, el radio se encuentra en los minerales de uranio en cantidades tan pequeñas como una séptima parte de un gramo por tonelada de uraninita, y en los minerales de torio en cantidades traza. El radio no es necesario para los organismos vivos , y su radiactividad y reactividad química hacen que sea probable que se produzcan efectos adversos para la salud cuando se incorpora a los procesos bioquímicos debido a su imitación química del calcio . A partir de 2018, aparte de en medicina nuclear , el radio no tiene aplicaciones comerciales. Anteriormente, desde la década de 1910 hasta la de 1970, se utilizó como fuente radiactiva para dispositivos radioluminiscentes y también en la curanderismo radiactivo por su supuesto poder curativo. En casi todas sus aplicaciones, el radio ha sido reemplazado por radioisótopos menos peligrosos , y uno de sus pocos usos no médicos restantes es la producción de actinio en reactores nucleares .
Propiedades a granel
El radio es el metal alcalinotérreo más pesado conocido y es el único miembro radiactivo de su grupo. Sus propiedades físicas y químicas se asemejan más a las de su congénere más ligero , el bario . [3]
El radio puro es un metal blanco plateado , lustroso y volátil , aunque sus congéneres más ligeros, el calcio , el estroncio y el bario, tienen un ligero tinte amarillo. [3] La superficie lustrosa del radio se vuelve negra rápidamente al exponerse al aire, probablemente debido a la formación de nitruro de radio (Ra 3 N 2 ). [4] Su punto de fusión es de 700 °C (1292 °F) o 960 °C (1760 °F) [a] y su punto de ebullición es de 1737 °C (3159 °F); sin embargo, esto no está bien establecido. [5] Ambos valores son ligeramente inferiores a los del bario, lo que confirma las tendencias periódicas hacia abajo en los elementos del grupo 2. [6] Al igual que el bario y los metales alcalinos , el radio cristaliza en la estructura cúbica centrada en el cuerpo a temperatura y presión estándar : la distancia de enlace radio-radio es de 514,8 picómetros . [7] El radio tiene una densidad de 5,5 g/cm 3 , superior a la del bario, lo que confirma nuevamente las tendencias periódicas; la relación de densidad radio-bario es comparable a la relación de masa atómica radio-bario, [8] debido a las estructuras cristalinas similares de los dos elementos. [8] [9]
Isótopos
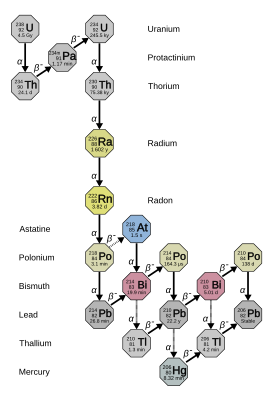
El radio tiene 33 isótopos conocidos con números másicos de 202 a 234, todos los cuales son radiactivos . [2] Cuatro de ellos – 223 Ra ( vida media 11,4 días), 224 Ra (3,64 días), 226 Ra (1600 años) y 228 Ra (5,75 años) – se producen naturalmente en las cadenas de desintegración del torio-232 primordial , uranio-235 y uranio-238 ( 223 Ra del uranio-235, 226 Ra del uranio-238 y los otros dos del torio-232). Sin embargo, estos isótopos todavía tienen vidas medias demasiado cortas para ser radionucleidos primordiales , y solo existen en la naturaleza a partir de estas cadenas de desintegración. [10] Junto con el 225 Ra (15 d), en su mayoría artificial , que se produce en la naturaleza solo como un producto de desintegración de trazas diminutas de neptunio-237 , [11] estos son los cinco isótopos más estables del radio. [2] Todos los otros 27 isótopos de radio conocidos tienen vidas medias inferiores a dos horas, y la mayoría tienen vidas medias inferiores a un minuto. [2] De estos, el 221 Ra (vida media de 28 s) también se produce como un hijo del 237 Np, y el 220 Ra y el 222 Ra se producirían por la desintegración beta doble aún no observada de los isótopos naturales del radón . [12] Se han informado al menos 12 isómeros nucleares , el más estable de los cuales es el radio-205m con una vida media entre 130~230 milisegundos; esto es todavía más corto que veinticuatro isótopos de radio en estado fundamental . [2]
El 226 Ra es el isótopo más estable del radio y es el último isótopo en la cadena de desintegración (4 n + 2) del uranio-238 con una vida media de más de un milenio; constituye casi la totalidad del radio natural. Su producto de desintegración inmediata es el gas noble radiactivo denso radón (específicamente el isótopo 222 Rn ), que es responsable de gran parte del peligro del radio ambiental. [13] [b] Es 2,7 millones de veces más radiactivo que la misma cantidad molar de uranio natural (principalmente uranio-238), debido a su vida media proporcionalmente más corta. [14] [15]
Una muestra de radio metálico se mantiene a una temperatura más alta que su entorno debido a la radiación que emite. El radio natural (que es principalmente 226 Ra) emite principalmente partículas alfa , pero otros pasos en su cadena de desintegración (la serie del uranio o del radio ) emiten partículas alfa o beta , y casi todas las emisiones de partículas están acompañadas de rayos gamma . [16]
Los estudios de física nuclear experimental han demostrado que los núcleos de varios isótopos del radio, como 222 Ra, 224 Ra y 226 Ra, tienen formas asimétricas de reflexión ("similares a una pera"). [17] En particular, esta información experimental sobre el radio-224 se ha obtenido en ISOLDE utilizando una técnica llamada excitación de Coulomb . [18] [19]
Química
El radio solo exhibe el estado de oxidación de +2 en solución. [4] Forma el catión incoloro Ra 2+ en solución acuosa , que es altamente básico y no forma complejos fácilmente. [4] Por lo tanto, la mayoría de los compuestos de radio son compuestos iónicos simples , [4] aunque se espera la participación de los electrones 6s y 6p (además de los electrones de valencia 7s) debido a los efectos relativistas y mejoraría el carácter covalente de los compuestos de radio como RaF 2 y Ra At 2 . [20] Por esta razón, el potencial de electrodo estándar para la semirreacción Ra 2+ (aq) + 2e - → Ra (s) es −2,916 V , incluso ligeramente inferior al valor −2,92 V para el bario, mientras que los valores previamente habían aumentado suavemente hacia abajo en el grupo (Ca: −2,84 V; Sr: −2,89 V; Ba: −2,92 V). [21] Los valores del bario y el radio son casi exactamente los mismos que los de los metales alcalinos más pesados: potasio , rubidio y cesio . [21]
Compuestos
Los compuestos de radio sólidos son blancos, ya que los iones de radio no proporcionan una coloración específica, pero gradualmente se vuelven amarillos y luego oscuros con el tiempo debido a la autorradiólisis de la desintegración alfa del radio . [4] Los compuestos de radio insolubles coprecipitan con todo el bario, la mayoría de los compuestos de estroncio y la mayoría de los compuestos de plomo . [22]
El óxido de radio (RaO) está poco caracterizado, ya que la reacción del radio con el aire da como resultado la formación de nitruro de radio . [23] El hidróxido de radio (Ra(OH) 2 ) se forma a través de la reacción del metal radio con agua, y es el más soluble entre los hidróxidos alcalinotérreos y una base más fuerte que su congénere de bario, el hidróxido de bario . [24] También es más soluble que el hidróxido de actinio y el hidróxido de torio : estos tres hidróxidos adyacentes pueden separarse precipitándolos con amoníaco . [24]
El cloruro de radio (RaCl 2 ) es un compuesto incoloro y luminiscente . Se vuelve amarillo después de un tiempo debido al daño autoinfligido por la radiación alfa emitida por el radio cuando se desintegra. Pequeñas cantidades de impurezas de bario le dan al compuesto un color rosa . [24] Es soluble en agua, aunque menos que el cloruro de bario , y su solubilidad disminuye con el aumento de la concentración de ácido clorhídrico . La cristalización a partir de una solución acuosa da el dihidrato RaCl 2 ·2H 2 O, isomorfo con su análogo de bario. [24]
El bromuro de radio (RaBr 2 ) también es un compuesto incoloro y luminoso. [24] En agua, es más soluble que el cloruro de radio. Al igual que el cloruro de radio, la cristalización a partir de una solución acuosa da el dihidrato RaBr 2 ·2H 2 O, isomorfo con su análogo de bario. La radiación ionizante emitida por el bromuro de radio excita las moléculas de nitrógeno en el aire, haciéndolo brillar. Las partículas alfa emitidas por el radio ganan rápidamente dos electrones para convertirse en helio neutro , que se acumula en el interior y debilita los cristales de bromuro de radio. Este efecto a veces hace que los cristales se rompan o incluso exploten. [24]
El nitrato de radio (Ra(NO 3 ) 2 ) es un compuesto blanco que se puede obtener disolviendo carbonato de radio en ácido nítrico . A medida que aumenta la concentración de ácido nítrico, disminuye la solubilidad del nitrato de radio, una propiedad importante para la purificación química del radio. [24]
El radio forma prácticamente las mismas sales insolubles que su congénere más ligero, el bario: forma el sulfato insoluble (RaSO 4 , el sulfato más insoluble conocido), el cromato (RaCrO 4 ), el carbonato (RaCO 3 ), el yodato (Ra(IO 3 ) 2 ), el tetrafluoroberilato (RaBeF 4 ) y el nitrato (Ra(NO 3 ) 2 ). Con excepción del carbonato, todos ellos son menos solubles en agua que las sales de bario correspondientes, pero todos son isoestructurales con sus homólogos de bario. Además, el fosfato, el oxalato y el sulfito de radio probablemente también sean insolubles, ya que coprecipitan con las sales de bario insolubles correspondientes. [25] La gran insolubilidad del sulfato de radio (a 20 °C, solo 2,1 mg se disolverán en 1 kg de agua) significa que es uno de los compuestos de radio biológicamente menos peligrosos. [26] El gran radio iónico de Ra 2+ (148 pm) da como resultado una capacidad débil para formar complejos de coordinación y una extracción deficiente de radio de soluciones acuosas cuando no están a un pH alto. [27]
Aparición
Todos los isótopos del radio tienen vidas medias mucho más cortas que la edad de la Tierra , de modo que cualquier radio primordial se habría desintegrado hace mucho tiempo. No obstante, el radio todavía se encuentra en el medio ambiente , ya que los isótopos 223 Ra, 224 Ra, 226 Ra y 228 Ra son parte de las cadenas de desintegración de los isótopos naturales del torio y el uranio; dado que el torio y el uranio tienen vidas medias muy largas, estos isótopos hijos se regeneran continuamente por su desintegración. [10] De estos cuatro isótopos, el de vida más larga es el 226 Ra (vida media de 1600 años), un producto de desintegración del uranio natural. Debido a su longevidad relativa, el 226 Ra es el isótopo más común del elemento, y constituye aproximadamente una parte por billón de la corteza terrestre; esencialmente, todo el radio natural es 226 Ra. [28] Así, el radio se encuentra en cantidades minúsculas en el mineral de uranio uraninita y en varios otros minerales de uranio , y en cantidades aún más minúsculas en los minerales de torio. Una tonelada de pechblenda normalmente produce alrededor de una séptima parte de un gramo de radio. [29] Un kilogramo de la corteza terrestre contiene alrededor de 900 picogramos de radio, y un litro de agua de mar contiene alrededor de 89 femtogramos de radio. [30]
Historia


El radio fue descubierto por Marie Skłodowska-Curie y su esposo Pierre Curie el 21 de diciembre de 1898 en una muestra de uraninita (pechblenda) de Jáchymov . [31] Mientras estudiaban el mineral anteriormente, los Curie extrajeron uranio de él y descubrieron que el material restante todavía era radiactivo. En julio de 1898, mientras estudiaban la pechblenda, aislaron un elemento similar al bismuto que resultó ser polonio . Luego aislaron una mezcla radiactiva que constaba de dos componentes: compuestos de bario , que daban un color de llama verde brillante, y compuestos radiactivos desconocidos que daban líneas espectrales carmín que nunca antes se habían documentado. Los Curie descubrieron que los compuestos radiactivos eran muy similares a los compuestos de bario, excepto que eran menos solubles. Este descubrimiento hizo posible que los Curie aislaran los compuestos radiactivos y descubrieran un nuevo elemento en ellos. Los Curie anunciaron su descubrimiento a la Academia Francesa de Ciencias el 26 de diciembre de 1898. [32] El nombre del radio data de alrededor de 1899, de la palabra francesa radium , formada en latín moderno a partir de radio ( rayo ): esto fue en reconocimiento de la emisión de energía del radio en forma de rayos. [33] Las emisiones gaseosas de radio, radón, fueron reconocidas y estudiadas extensamente por Friedrich Ernst Dorn a principios de la década de 1900, aunque en ese momento se caracterizaron como "emanaciones de radio". [34]
En septiembre de 1910, Marie Curie y André-Louis Debierne anunciaron que habían aislado el radio como metal puro a través de la electrólisis de una solución de cloruro de radio puro (RaCl 2 ) utilizando un cátodo de mercurio , produciendo una amalgama de radio-mercurio . [35] Esta amalgama se calentó luego en una atmósfera de gas hidrógeno para eliminar el mercurio, dejando el radio metálico puro. [36] Más tarde ese mismo año, E. Eoler aisló el radio por descomposición térmica de su azida , Ra(N 3 ) 2 . [10] El radio metálico fue producido industrialmente por primera vez a principios del siglo XX por Biraco , una empresa subsidiaria de Union Minière du Haut Katanga (UMHK) en su planta de Olen en Bélgica. [37] El metal se convirtió en un importante producto de exportación de Bélgica desde 1922 hasta la Segunda Guerra Mundial. [38]
La unidad histórica general para la radiactividad, el curie , se basa en la radiactividad del 226 Ra. Originalmente se definió como la radiactividad de un gramo de radio-226, [39] pero la definición se refinó posteriormente para ser3,7 × 10 10 desintegraciones por segundo . [40]
Aplicaciones históricas
Pintura luminiscente

El radio se utilizaba antiguamente en pinturas autoluminiscentes para relojes, interruptores de aviones, relojes de pared y diales y paneles de instrumentos. Un reloj autoluminiscente típico que utiliza pintura de radio contiene alrededor de 1 microgramo de radio. [41] A mediados de la década de 1920, cinco " Radium Girls " moribundas, pintoras de diales que habían pintado pintura luminosa a base de radio en los componentes de relojes, presentaron una demanda contra la United States Radium Corporation . [42] Se les indicó a las pintoras de diales que lamieran sus pinceles para darles una punta fina, ingiriendo así radio. [43] Su exposición al radio les causó graves efectos sobre la salud que incluyeron llagas, anemia y cáncer de huesos . [13]
Durante el litigio se determinó que los científicos y la dirección de la empresa habían tomado precauciones considerables para protegerse de los efectos de la radiación, pero no parecía que eso protegiera a sus empleados. Además, durante varios años las empresas habían intentado encubrir los efectos y evitar la responsabilidad insistiendo en que las Radium Girls padecían sífilis . [44]
Como resultado de la demanda y de un estudio exhaustivo del Servicio de Salud Pública de los Estados Unidos, los efectos adversos de la radiactividad se hicieron ampliamente conocidos y se instruyó a los pintores de esferas de radio sobre las precauciones de seguridad adecuadas y se les proporcionó equipo de protección. En particular, los pintores de esferas ya no lamían los pinceles para darles forma (lo que causaba cierta ingestión de sales de radio). El radio todavía se utilizaba en esferas hasta la década de 1960, pero no hubo más lesiones entre los pintores de esferas. [42]
A partir de la década de 1960, se dejó de utilizar pintura de radio. En muchos casos, se implementaron diales luminosos con materiales fluorescentes no radiactivos excitados por la luz; estos dispositivos brillan en la oscuridad después de la exposición a la luz, pero el brillo se desvanece. [13] Cuando se requería una autoluminosidad duradera en la oscuridad, se utilizó pintura radiactiva más segura de prometio -147 (vida media de 2,6 años) o tritio (vida media de 12 años); ambos siguen utilizándose en 2018. [45] Estos tenían la ventaja adicional de no degradar el fósforo con el tiempo, a diferencia del radio. [46] El tritio tal como se usa en estas aplicaciones se considera más seguro que el radio, [47] ya que emite radiación beta de muy baja energía (incluso menor que la radiación beta emitida por el prometio) [48] que no puede penetrar la piel, [49] a diferencia de la radiación gamma emitida por los isótopos del radio. [47]

Los relojes y otros instrumentos de la primera mitad del siglo XX, a menudo de uso militar, pueden haber sido pintados con pintura luminosa radiactiva. Normalmente ya no son luminosos; sin embargo, esto no se debe a la desintegración radiactiva del radio (que tiene una vida media de 1600 años), sino al desgaste de la fluorescencia del medio fluorescente de sulfuro de cinc por la radiación del radio. [50] La aparición de una capa a menudo gruesa de pintura verde o marrón amarillenta en los dispositivos de este período sugiere un peligro radiactivo. La dosis de radiación de un dispositivo intacto es relativamente baja y normalmente no supone un riesgo agudo, pero la pintura es peligrosa si se libera y se inhala o se ingiere. [5] [51]
Curanderismo

El radio era un aditivo en productos como cosméticos, pasta de dientes, cremas para el cabello e incluso alimentos debido a sus supuestos poderes curativos. [53] Muchos productos contemporáneos fueron anunciados falsamente como radiactivos. [54] Estos productos pronto pasaron de moda y fueron prohibidos por las autoridades en muchos países después de que se descubrió que podían tener graves efectos adversos para la salud. (Véase, por ejemplo, los tipos Radithor o Revigator de "agua con radio" o "Solución de radio estándar para beber"). [50] Los spas que contienen agua rica en radio todavía se promocionan ocasionalmente como beneficiosos, como los de Misasa, Tottori , Japón, [55] aunque las fuentes de radiactividad en estos spas varían y pueden atribuirse al radón y otros radioisótopos. [56]
Usos médicos y de investigación
El radio (generalmente en forma de cloruro de radio o bromuro de radio ) se utilizaba en medicina para producir gas radón, que a su vez se utilizaba como tratamiento contra el cáncer . [5] Varias de estas fuentes de radón se utilizaron en Canadá en las décadas de 1920 y 1930. [57] Sin embargo, muchos tratamientos que se utilizaban a principios de la década de 1900 ya no se utilizan debido a los efectos nocivos que causaba la exposición al bromuro de radio. Algunos ejemplos de estos efectos son la anemia , el cáncer y las mutaciones genéticas . [58] A partir de 2011, se utilizaron emisores gamma más seguros como el 60Co , que es menos costoso y está disponible en mayores cantidades, para reemplazar el uso histórico del radio en esta aplicación, [27] pero factores como el aumento de los costos del cobalto y los riesgos de mantener fuentes radiactivas en el sitio han llevado a un aumento en el uso de aceleradores de partículas lineales para las mismas aplicaciones. [59]
En los EE. UU., desde 1940 hasta la década de 1960, el radio se utilizó en la irradiación nasofaríngea con radio, un tratamiento que se administraba a los niños para tratar la pérdida de audición y la otitis crónica . El procedimiento también se administró a los aviadores y a la tripulación de submarinos para tratar el barotrauma . [60] [61]
A principios del siglo XX, los biólogos utilizaron el radio para inducir mutaciones y estudiar la genética . Ya en 1904, Daniel MacDougal utilizó el radio en un intento de determinar si podía provocar grandes mutaciones repentinas y causar grandes cambios evolutivos. Thomas Hunt Morgan utilizó el radio para inducir cambios que dieron lugar a moscas de la fruta de ojos blancos. El biólogo ganador del Nobel Hermann Muller estudió brevemente los efectos del radio en las mutaciones de la mosca de la fruta antes de recurrir a experimentos con rayos X más asequibles. [62]
Producción

El uranio no tenía aplicaciones a gran escala a finales del siglo XIX y, por lo tanto, no existían grandes minas de uranio. Al principio, las minas de plata en Jáchymov , Austria-Hungría (hoy República Checa ) eran las únicas grandes fuentes de mineral de uranio. [31] El mineral de uranio era solo un subproducto de las actividades mineras. [63]
En la primera extracción de radio, Curie utilizó los residuos después de la extracción de uranio de la pechblenda. El uranio había sido extraído por disolución en ácido sulfúrico dejando sulfato de radio, que es similar al sulfato de bario pero aún menos soluble en los residuos. Los residuos también contenían cantidades bastante sustanciales de sulfato de bario que actuaba así como portador del sulfato de radio. Los primeros pasos del proceso de extracción de radio implicaban hervir con hidróxido de sodio, seguido de un tratamiento con ácido clorhídrico para minimizar las impurezas de otros compuestos. El residuo restante se trataba luego con carbonato de sodio para convertir el sulfato de bario en carbonato de bario (que transportaba el radio), haciéndolo así soluble en ácido clorhídrico. Después de la disolución, el bario y el radio se reprecipitaron como sulfatos; esto se repitió luego para purificar aún más el sulfato mixto. Algunas impurezas que forman sulfuros insolubles se eliminaron tratando la solución de cloruro con sulfuro de hidrógeno , seguido de filtrado. Cuando los sulfatos mixtos fueron lo suficientemente puros, se convirtieron una vez más en cloruros mixtos; Posteriormente, el bario y el radio se separaron mediante cristalización fraccionada mientras se monitoreaba el progreso utilizando un espectroscopio (el radio da líneas rojas características en contraste con las líneas verdes del bario) y el electroscopio . [64]
Después de que Marie y Pierre Curie aislaran el radio del mineral de uranio de Jáchymov , varios científicos comenzaron a aislarlo en pequeñas cantidades. Más tarde, pequeñas empresas compraron los desechos mineros de las minas de Jáchymov y comenzaron a aislar el radio. En 1904, el gobierno austríaco nacionalizó las minas y dejó de exportar mineral en bruto. Hasta 1912, cuando aumentó la producción de radio, la disponibilidad de radio era baja. [63]
La formación de un monopolio austríaco y la fuerte necesidad de otros países de tener acceso al radio llevaron a una búsqueda mundial de minerales de uranio. Estados Unidos asumió el liderazgo como productor a principios de la década de 1910, [31] produciendo un total de 70 g entre 1913 y 1920 solo en Pittsburgh . [65]
En 1940, el proceso de Curie todavía se utilizaba para la extracción industrial de radio, pero en ese entonces se utilizaban bromuros mixtos para el fraccionamiento. Si el contenido de bario del mineral de uranio no es lo suficientemente alto, se puede añadir bario adicional para transportar el radio. Estos procesos se aplicaron a minerales de uranio de alta calidad, pero es posible que no hayan funcionado bien con minerales de baja calidad. [66] Hasta la década de 1990, todavía se extraían pequeñas cantidades de radio del mineral de uranio mediante este método de precipitación mixta e intercambio iónico, [28] pero a partir de 2011, solo se extrae del combustible nuclear gastado. [67] El radio metálico puro se aísla reduciendo el óxido de radio con aluminio metálico en vacío a 1200 °C. [27]
En 1954, el suministro mundial total de radio purificado ascendía a aproximadamente 5 libras (2,3 kg). [41] Zaire y Canadá fueron brevemente los mayores productores de radio a fines de la década de 1970. [65] En 1997, los principales países productores de radio eran Bélgica, Canadá, la República Checa, Eslovaquia, el Reino Unido y Rusia. [28] La producción anual de compuestos de radio era solo de unos 100 g en total en 1984; [28] la producción anual de radio se había reducido a menos de 100 g en 2018. [68]
Aplicaciones modernas
El radio se utiliza cada vez más en el campo de la física atómica, molecular y óptica . [69] [19] Las fuerzas de ruptura de simetría se escalan proporcionalmente a [70], lo que hace que el radio, el elemento alcalinotérreo más pesado, sea muy adecuado para restringir la nueva física más allá del modelo estándar . Algunos isótopos del radio, como el radio-225, tienen dobletes de paridad deformados por octupolo que mejoran la sensibilidad a la paridad de carga que viola la nueva física en dos o tres órdenes de magnitud en comparación con el 199 Hg. [71]
El radio también es un candidato prometedor para los relojes ópticos de iones atrapados . El ion radio tiene dos transiciones de ancho de línea de subhercios desde el estado fundamental que podrían servir como transición de reloj en un reloj óptico. [72] Se ha demostrado un reloj atómico de iones atrapados de 226 Ra+ en la transición a , que se ha considerado para la creación de un reloj óptico transportable, ya que todas las transiciones necesarias para el funcionamiento del reloj se pueden abordar con láseres de diodo directos en longitudes de onda comunes. [73]
Algunos de los pocos usos prácticos del radio se derivan de sus propiedades radiactivas. Los radioisótopos descubiertos más recientemente , como el cobalto-60 y el cesio-137 , están reemplazando al radio incluso en estos usos limitados porque varios de estos isótopos son emisores más potentes, más seguros de manipular y están disponibles en forma más concentrada. [74]
El isótopo 223 Ra fue aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos en 2013 para su uso en medicina como tratamiento del cáncer de metástasis ósea en forma de una solución que incluye cloruro de radio-223. [75] La principal indicación del tratamiento es la terapia de metástasis óseas del cáncer de próstata resistente a la castración. [76] El 225 Ra también se ha utilizado en experimentos relacionados con la irradiación terapéutica, ya que es el único isótopo de radio de vida razonablemente larga que no tiene al radón como uno de sus hijos. [77]
El radio todavía se utilizaba en 2007 como fuente de radiación en algunos dispositivos de radiografía industrial para comprobar si había piezas metálicas defectuosas, de forma similar a la obtención de imágenes por rayos X. [13] Cuando se mezcla con berilio , el radio actúa como fuente de neutrones . [50] [78] Hasta al menos 2004, todavía se utilizaban a veces fuentes de neutrones de radio-berilio, [13] [79] pero otros materiales como el polonio y el americio se han vuelto más comunes para su uso en fuentes de neutrones. Las fuentes de neutrones basadas en RaBeF 4 (α, n) han quedado obsoletas a pesar del alto número de neutrones que emiten (1,84 × 10 6 neutrones por segundo) en favor de las fuentes de 241 Am –Be. [80] A partir de 2011 [actualizar], el isótopo 226 Ra se utiliza principalmente para formar 227 Ac mediante irradiación de neutrones en un reactor nuclear. [27]
Peligros
El radio es altamente radiactivo, al igual que su producto de desintegración inmediata, el gas radón . Cuando se ingiere, el 80% del radio ingerido sale del cuerpo a través de las heces , mientras que el otro 20% va al torrente sanguíneo , acumulándose principalmente en los huesos. Esto se debe a que el cuerpo trata el radio como calcio y lo deposita en los huesos , donde la radiactividad degrada la médula y puede mutar las células óseas . La exposición al radio, interna o externa, puede causar cáncer y otros trastornos, porque el radio y el radón emiten rayos alfa y gamma al desintegrarse, que matan y mutan las células. [13] El radio generalmente se considera el más tóxico de los elementos radiactivos. [80]
Algunos de los efectos biológicos del radio incluyen el primer caso de "dermatitis por radio", reportado en 1900, dos años después del descubrimiento del elemento. El físico francés Antoine Becquerel llevó una pequeña ampolla de radio en el bolsillo de su chaleco durante seis horas e informó que su piel se ulceró . Pierre Curie se colocó un tubo lleno de radio en el brazo durante diez horas, lo que resultó en la aparición de una lesión en la piel, lo que sugiere el uso del radio para atacar el tejido canceroso como había atacado el tejido sano. [81] Se ha culpado a la manipulación del radio por la muerte de Marie Curie, debido a anemia aplásica . Una cantidad significativa del peligro del radio proviene de su hijo, el radón, que como gas puede ingresar al cuerpo mucho más fácilmente que su padre, el radio. [13]
Regulación
Las primeras recomendaciones publicadas para la protección contra el radio y la radiación en general fueron realizadas por el Comité Británico de Protección contra el Radio y los Rayos X y fueron adoptadas internacionalmente en 1928 en la primera reunión de la Comisión Internacional de Protección Radiológica (ICRP), siguiendo las directrices preliminares escritas por la Sociedad Röntgen . [82] Esta reunión condujo a nuevos desarrollos de programas de protección radiológica [83] coordinados entre todos los países representados por la comisión. [84]
La exposición al radio todavía está regulada internacionalmente por la CIPR, junto con la Organización Mundial de la Salud . [85] El Organismo Internacional de Energía Atómica (OIEA) publica normas de seguridad y proporciona recomendaciones para la manipulación y la exposición al radio en sus trabajos sobre materiales radiactivos naturales y las Normas Básicas Internacionales de Seguridad más amplias, [86] que no son aplicadas por el OIEA pero están disponibles para su adopción por los miembros de la organización. [87] Además, en un esfuerzo por reducir la cantidad de dispositivos de radioterapia antiguos que contienen radio, el OIEA ha trabajado desde 2022 [88] para gestionar y reciclar fuentes de 226 Ra en desuso . [89] [90]
En varios países existen y se aplican otras reglamentaciones además de las recomendadas por el OIEA y la ICRP. Por ejemplo, en los Estados Unidos, el nivel máximo de contaminación definido por la Agencia de Protección Ambiental para el radio es de 5 pCi/L para el agua potable; [91] en la época del Proyecto Manhattan en la década de 1940, el "nivel de tolerancia" para los trabajadores se estableció en 0,1 microgramos de radio ingerido. [92] La Administración de Seguridad y Salud Ocupacional no establece límites específicos de exposición para el radio, y en su lugar limita la exposición a la radiación ionizante en unidades de roentgen equivalente hombre en función del área expuesta del cuerpo. Las fuentes de radio en sí mismas, en lugar de las exposiciones de los trabajadores, están reguladas más de cerca por la Comisión Reguladora Nuclear , [93] que exige una licencia para cualquier persona que posea 226 Ra con una actividad de más de 0,01 μCi. [94] Los órganos rectores particulares que regulan los materiales radiactivos y la energía nuclear están documentados por la Agencia de Energía Nuclear para los países miembros [95] – por ejemplo, en la República de Corea , las normas de seguridad radiológica de la nación son administradas por el Instituto de Radioisótopos de Corea, establecido en 1985, y el Instituto de Seguridad Nuclear de Corea, establecido en 1990 [96] – y el OIEA lidera los esfuerzos para establecer órganos rectores en lugares que no tienen regulaciones gubernamentales sobre materiales radiactivos. [97] [98]
Notas
- ^ Ambos valores se encuentran en las fuentes y no hay acuerdo entre los científicos en cuanto al verdadero valor del punto de fusión del radio. [4]
- ^ Ver mitigación del radón .
Referencias
- ^ Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ abcde Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ desde Greenwood y Earnshaw 1997, pág. 112.
- ^ abcdef Kirby y Salutsky 1964, pág. 4.
- ^ abc «Radium». Encyclopædia Britannica . Archivado desde el original el 15 de junio de 2013.
- ^ Lide, DR; et al., eds. (2004). Manual de química y física del CRC (84.ª ed.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0484-2.
- ^ Weigel, F.; Trinkl, A. (1968). "Zur Kristallchemie des Radiums" [Sobre la cristalografía química del radio]. Radiochim. Acta (en alemán). 10 (1–2): 78. doi :10.1524/ract.1968.10.12.78. S2CID 100313675.
- ^ ab Young, David A. (1991). "Radio". Diagramas de fases de los elementos . University of California Press. pág. 85. ISBN 978-0-520-91148-2.
- ^ "Estructuras cristalinas de los elementos químicos a 1 bar". uni-bielefeld.de . Archivado desde el original el 26 de agosto de 2014.
- ^ abc Kirby y Salutsky 1964, pág. 3.
- ^ Peppard, DF; Mason, GW; Gray, PR; Mech, JF (1952). «Ocurrencia de la serie (4n + 1) en la naturaleza». Journal of the American Chemical Society . 74 (23): 6081–6084. doi :10.1021/ja01143a074. Archivado desde el original el 28 de julio de 2019. Consultado el 6 de julio de 2019 .
- ^ Tretyak, VI; Zdesenko, Yu.G. (2002). "Tablas de datos de desintegración beta doble: una actualización". En. Data Nucl. Data Tables . 80 (1): 83–116. Bibcode :2002ADNDT..80...83T. doi :10.1006/adnd.2001.0873.
- ^ abcdefg Protección radiológica. Radio. epa.gov (Informe). Radiación / Radionúclidos. Agencia de Protección Ambiental de los Estados Unidos . Archivado desde el original el 11 de febrero de 2015.
- ^ Soddy, Frederick (25 de agosto de 2004). La interpretación del radio. Courier Corporation. pág. 139 y siguientes. ISBN 978-0-486-43877-1. Archivado desde el original el 5 de septiembre de 2015 . Consultado el 27 de junio de 2015 – a través de Google Books.
- ^ Malley, Marjorie C. (2011). Radiactividad . Oxford University Press. pág. 115 y siguientes. ISBN 978-0-19-983178-4. Recuperado el 27 de junio de 2015 – vía Internet Archive (archive.org).
- ^ Strutt, RJ (7 de septiembre de 2004). Los rayos Becquerel y las propiedades del radio. Courier Corporation. pág. 133. ISBN 978-0-486-43875-7Archivado desde el original el 5 de septiembre de 2015 . Consultado el 27 de junio de 2015 .
- ^ Butler, PA (2020). "Núcleos atómicos en forma de pera". Actas de la Royal Society A . 476 (2239): 20200202. Bibcode :2020RSPSA.47600202B. doi :10.1098/rspa.2020.0202. PMC 7426035 . PMID 32821242. .
- ^ "Primeras observaciones de núcleos atómicos de vida corta con forma de pera – CERN". home.cern . Archivado desde el original el 12 de junio de 2018 . Consultado el 8 de junio de 2018 .
- ^ ab Gaffney, LP; Butler, PA; Scheck, M.; et al. (2013). "Estudios de núcleos en forma de pera utilizando haces radiactivos acelerados". Nature . 497 (7448): 199–204. Bibcode :2013Natur.497..199G. doi :10.1038/nature12073. PMID 23657348. S2CID 4380776.
- ^ Thayer, John S. (2010). "Efectos relativistas y la química de los elementos más pesados del grupo principal". Métodos relativistas para químicos . Desafíos y avances en química y física computacional. Vol. 10. Dordrecht: Springer. pág. 81. doi :10.1007/978-1-4020-9975-5_2. ISBN 978-1-4020-9974-8.
- ^ desde Greenwood y Earnshaw 1997, pág. 111.
- ^ Kirby y Salutsky 1964, pág. 8.
- ^ Tyler, Paul McIntosh (1930). Radio. Departamento de Comercio de los Estados Unidos, Oficina de Minas.
- ^ abcdefg Kirby y Salutsky 1964, págs. 4–8.
- ^ Kirby y Salutsky 1964, págs. 8-9.
- ^ Kirby y Salutsky 1964, pág. 12.
- ^ abcd Keller, Wolf y Shani 2011, págs. 97–98.
- ^ abcd Greenwood y Earnshaw 1997, págs. 109-110.
- ^ "Radium" Archivado el 15 de noviembre de 2012 en Wayback Machine , Laboratorio Nacional de Los Álamos. Consultado el 5 de agosto de 2009.
- ^ Sección 14, Geofísica, astronomía y acústica; abundancia de elementos en la corteza terrestre y en el mar, en Lide, David R. (ed.), CRC Handbook of Chemistry and Physics , 85.ª edición . CRC Press. Boca Raton, Florida (2005).
- ^ abc Hammond, CR "Radium" en Haynes, William M., ed. (2011). Manual de química y física del CRC (92.ª edición). Boca Raton, FL: CRC Press . ISBN 1-4398-5511-0.
- ^
- Curie, Pedro; Curie, Marie y Bémont, Gustave (1898). "Sur une nouvelle sustancia fuerte radiactiva, contenue dans la pechblenda" [Sobre una nueva sustancia fuertemente radiactiva contenida en la pechblenda]. Cuentas Rendus . 127 : 1215-1217. Archivado desde el original el 6 de agosto de 2009 . Consultado el 1 de agosto de 2009 .
- Weeks, Mary Elvira (1933). "El descubrimiento de los elementos. XIX. Los elementos radiactivos". Revista de Educación Química . 10 (2): 79. Bibcode :1933JChEd..10...79W. doi :10.1021/ed010p79.
- ^
- Ball, David W. (1985). "Etimología elemental: ¿Qué hay en un nombre?". Journal of Chemical Education . 62 (9): 787–788. Bibcode :1985JChEd..62..787B. doi :10.1021/ed062p787.
- Carvalho, Fernando P. (2011). "Marie Curie y el descubrimiento del radio". El nuevo auge de la minería del uranio . Springer Geology. Berlín, Heidelberg: Springer. pp. 3–13. doi :10.1007/978-3-642-22122-4_1. ISBN 978-3-642-22121-7.
- Weeks, Mary Elvira (1933). "El descubrimiento de los elementos. XIX. Los elementos radiactivos". Revista de Educación Química . 10 (2): 79. Bibcode :1933JChEd..10...79W. doi :10.1021/ed010p79.
- ^ Stwertka, Albert (1998). Una guía de los elementos (edición revisada). Oxford University Press. pág. 194. ISBN 978-0-19-508083-4.
- ^ Frank Moore Colby; Allen Leon Churchill (1911). Nuevo Anuario Internacional: Un compendio del progreso mundial. Dodd, Mead and Co., pág. 152 y siguientes.
- ^ Curie, Marie y Debierne, André (1910). "Sur le radium métallique" [Sobre el radio metálico]. Comptes Rendus (en francés). 151 : 523–525. Archivado desde el original el 20 de julio de 2011 . Consultado el 1 de agosto de 2009 .
- ^ Ronneau, C.; Bitchaeva, O. (1997). Biotecnología para la gestión de residuos y la restauración de sitios: aspectos tecnológicos, educativos, comerciales y políticos. División de Asuntos Científicos, Organización del Tratado del Atlántico Norte. p. 206. ISBN 978-0-7923-4769-9Archivado desde el original el 5 de septiembre de 2015 . Consultado el 27 de junio de 2015 .
- ^ Adams, A (enero de 1993). "El origen y el desarrollo temprano de la industria belga del radio". Environment International . 19 (5): 491–501. doi :10.1016/0160-4120(93)90274-l. ISSN 0160-4120.
- ^ Frame, Paul W. (octubre-noviembre de 1996). «Cómo surgió la Curie». Boletín de la Health Physics Society . Archivado desde el original el 20 de marzo de 2012. Consultado el 9 de mayo de 2023 a través de Oak Ridge Associated Universities (orau.org).
{{cite magazine}}: CS1 maint: URL no apta ( enlace ) - ^ Comité del Consejo Nacional de Investigación (EE. UU.) para la evaluación de las directrices de la EPA sobre exposición a materiales radiactivos naturales (1999). "Apéndice, Cantidades y unidades de radiación, definiciones, acrónimos". Evaluación de las directrices para la exposición a materiales radiactivos naturales mejorados tecnológicamente. Washington (DC): National Academies Press (EE. UU.).
- ^ ab Terrill, JG Jr.; Ingraham, SC, 2.º; Moeller, DW (1954). "El radio en las artes curativas y en la industria: exposición a la radiación en los Estados Unidos". Public Health Reports . 69 (3): 255–262. doi :10.2307/4588736. JSTOR 4588736. PMC 2024184 . PMID 13134440.
{{cite journal}}: CS1 maint: nombres múltiples: lista de autores ( enlace ) CS1 maint: nombres numéricos: lista de autores ( enlace ) - ^ desde
- Rowland, RE (1995) El radio en los seres humanos: una revisión de estudios estadounidenses Archivado el 9 de noviembre de 2011 en Wayback Machine . Laboratorio Nacional Argonne. p. 22
- Coursey, Bert M. (2021). "La Oficina Nacional de Normas y los pintores de diales de radio" (PDF) . Revista de investigación del Instituto Nacional de Normas y Tecnología . 126 . doi :10.6028/jres.126.051. ISSN 2165-7254. PMC 10046820 . PMID 38469446.
- ^ Frame, Paul (1999). "Pintura radioluminiscente". Museo de Radiación y Radiactividad . Oak Ridge Associated Universities . Archivado desde el original el 31 de julio de 2014.
- ^ "Cronología de la historia medioambiental – Radium Girls". 20 de julio de 2012. Archivado desde el original el 2 de septiembre de 2018. Consultado el 1 de septiembre de 2018 .
- ^
- Broderick, Kathleen; Lusk, Rita; Obstáculo, James; Griswold, Justin; Bollo, rosa; Guirnalda, Marc; Heilbronn, Lorenzo; Mirzadeh, Saed (febrero de 2019). "Producción del reactor de prometio-147". Radiaciones Aplicadas e Isótopos . 144 : 54–63. Código Bib : 2019AppRI.144...54B. doi :10.1016/j.apradiso.2018.10.025. PMID 30529496.
- Eyrolle, Frédérique; Ducros, Loïc; Le Dizès, Séverine; Beaugelin-Seiller, Karine; Charmasson, Sabina; Boyer, Patricio; Cossonnet, Catherine (enero de 2018). "Una revisión actualizada sobre el tritio en el medio ambiente". Revista de radiactividad ambiental . 181 : 128-137. Código Bib : 2018JEnvR.181..128E. doi :10.1016/j.jenvrad.2017.11.001. PMID 29149670.
- ^ Lavrukhina, Avgusta Konstantinovna; Pozdnyakov, Aleksandr Aleksandrovich (1966). Аналитическая химия технеция, прометия, астатина и франция[ Química analítica del tecnecio, prometio, astato y francio ] (en ruso). Nauka . p. 118.
- ^ ab Zerriffi, Hisham (enero de 1996). "Tritio: efectos ambientales, sanitarios, presupuestarios y estratégicos de la decisión del Departamento de Energía de producir tritio". Instituto de Investigación Energética y Ambiental . Archivado desde el original el 13 de julio de 2010. Consultado el 15 de septiembre de 2010 .
- ^ Audi, G.; Kondev, FG; Wang, M.; Huang, WJ; Naimi, S. (2017). "La evaluación NUBASE2016 de las propiedades nucleares" (PDF) . Chinese Physics C . 41 (3): 030001. Bibcode :2017ChPhC..41c0001A. doi :10.1088/1674-1137/41/3/030001.
- ^ Hidrógeno-3 (PDF) (Informe). Ficha de datos de seguridad de nucleidos. Oficina de Salud y Seguridad Ambiental, Universidad Emory . Archivado desde el original (PDF) el 20 de mayo de 2013 – vía ehso.emory.edu.
- ^ abc Emsley 2003, pág. 351.
- ^ "Pintura luminosa con radio". vintagewatchstraps.com . Archivado desde el original el 4 de marzo de 2013.
- ^ Díaz Díaz, RM; Garrido Gutiérrez, C.; Maldonado Cid, P. (diciembre 2020). "Cosmética Radiactiva y Belleza Radiante". Actas Dermo-Sifiliográficas (Edición Inglesa) . 111 (10): 863–865. doi : 10.1016/j.adengl.2020.09.014.
- ^ "Sitio web francés que presenta productos (medicamentos, agua mineral, incluso ropa interior) que contienen radio". Archivado desde el original el 15 de marzo de 2011. Consultado el 1 de agosto de 2009 .
- ^ Prisco, Jacopo (3 de marzo de 2020). "Cuando los productos de belleza eran radiactivos". CNN . Consultado el 13 de octubre de 2024 .
- ^ Morinaga, H.; Mifune, M.; Furuno, K. (1984). "Radioactividad del agua y el aire en Misasa Spa, Japón". Dosimetría de protección radiológica . 7 (1–4): 295–297. doi :10.1093/oxfordjournals.rpd.a083014. ISSN 0144-8420 – vía Sistema Internacional de Información Nuclear.
- ^
- Gulan, Ljiljana; Penjišević, Ivana; Stajic, Jelena M.; Milenkovic, Biljana; Zeremski, Tijana; Stevanović, Vladica; Valjarević, Aleksandar (marzo de 2020). "Entornos de spa en el centro de Serbia: potencial geotérmico, radiactividad, metales pesados y HAP". Quimiosfera . 242 : 125171. Código bibliográfico : 2020Chmsp.24225171G. doi : 10.1016/j.chemosphere.2019.125171. PMID 31671300.
- Sainz, Carlos; Rábago, Daniel; Fuente, Ismael; Celaya, Santiago; Quindós, Luis Santiago (febrero de 2016). "Descripción del comportamiento de un acuífero mediante monitorización continua de radón en un balneario termal". Ciencia del Medio Ambiente Total . 543 (Parte A): 460–466. Código Bib : 2016ScTEn.543..460S. doi :10.1016/j.scitotenv.2015.11.052. hdl : 10902/31301 . PMID 26599146.
- Uzun, Sefa Kemal; Demiröz, Işık (septiembre de 2016). "Evaluación de dosis de radón y de origen de la progenie en empleados de spa en sitios balneológicos". Dosimetría de protección radiológica . 170 (1–4): 331–335. doi :10.1093/rpd/ncv413. ISSN 0144-8420. PMID 26424134.
- Walencik-Łata, A.; Kozłowska, B.; Dorda, J.; Przylibski, TA (noviembre de 2016). "El análisis detallado de radionucleidos naturales disueltos en aguas termales del valle de Kłodzko, montañas de los Sudetes, Polonia". Ciencia del Medio Ambiente Total . 569–570: 1174–1189. Código Bib : 2016ScTEn.569.1174W. doi :10.1016/j.scitotenv.2016.06.192. PMID 27432727.
- Karakaya, Muazzez Çelik; Doğru, Mahmut; Karakaya, Necati; Kuluöztürk, Fatih; Nalbantçılar, Mahmut Tahir (1 de agosto de 2017). "Radiactividad y propiedades hidroquímicas de determinadas aguas termales de balnearios turcos". Revista de Agua y Salud . 15 (4): 591–601. doi :10.2166/wh.2017.263. ISSN 1477-8920. PMID 28771156.
- Duran, Selcen Uzun; Kucukomeroglu, Belgin; Damla, Nevzat; Taskin, Halim; Celik, Necati; Cevik, Uğur; Ersoy, Hakan (2 de enero de 2017). "Mediciones de radiactividad y evaluaciones de riesgos de las aguas termales en algunas áreas de Turquía". Isótopos en estudios ambientales y de salud . 53 (1): 91–103. Bibcode :2017IEHS...53...91D. doi :10.1080/10256016.2016.1116986. ISSN 1025-6016. PMID 27008087.
- ^ Hayter, Charles (2005). "La política de la terapia con radón en la década de 1930". Un elemento de esperanza: el radio y la respuesta al cáncer en Canadá, 1900-1940 . McGill-Queen's Press. ISBN 978-0-7735-2869-7– a través de Google Books.
- ^ Harvie, David I. (1999). "El siglo del radio". Endeavour . 23 (3): 100–105. doi :10.1016/S0160-9327(99)01201-6. PMID 10589294.
- ^ Van Dyk, J.; Battista, JJ; Almond, PR (2020). "UNA RETROSPECTIVA DE LA RADIOTERAPIA CON COBALTO-60: "LA BOMBA ATÓMICA QUE SALVA VIDAS"" (PDF) . Medical Physics International .
- ^ Ronckers, Cécile M; Land, Charles E; Hayes, Richard B; Verduijn, Pieter G; Stovall, Marilyn; van Leeuwen, Flora E (diciembre de 2002). "Efectos tardíos en la salud de la irradiación nasofaríngea con radio en la infancia: cánceres de piel no melanoma, tumores benignos y trastornos hormonales". Investigación pediátrica . 52 (6): 850–858. doi :10.1203/00006450-200212000-00007. ISSN 0031-3998.
- ^ CDC (20 de febrero de 2024). «Datos sobre la irradiación nasofaríngea con radio (NRI)». Radiation and Your Health (Radiación y salud ). Consultado el 13 de octubre de 2024 .
- ^ Hamilton, Vivien (2016). «Los secretos de la vida: el historiador Luis Campos resucita el papel del radio en las primeras investigaciones genéticas». Destilaciones . 2 (2): 44–45. Archivado desde el original el 23 de marzo de 2018 . Consultado el 22 de marzo de 2018 .
- ^ ab Ceranski, Beate (2008). "Tauschwirtschaft, Reputationsökonomie, Bürokratie". NTM Zeitschrift für Geschichte der Wissenschaften, Technik und Medizin (en alemán). 16 (4): 413–443. doi : 10.1007/s00048-008-0308-z .
- ^ "Lateral Science" Archivado el 2 de abril de 2015 en Wayback Machine . lateralscience.blogspot.se . Noviembre de 2012
- ^ ab "Producción, importación, uso y eliminación". Perfil toxicológico del radio. Atlanta (Georgia): Agencia para Sustancias Tóxicas y Registro de Enfermedades (EE. UU.). 4 de diciembre de 1990.
- ^ Kuebel, A. (1940). "Extracción de radio de la pechblenda canadiense". Revista de educación química . 17 (9): 417. Bibcode :1940JChEd..17..417K. doi :10.1021/ed017p417.
- ^ Emsley 2003, pág. 437.
- ^ Cantrill, Vikki (20 de julio de 2018). "Las realidades del radio". Nature Chemistry . 10 (8): 898. doi :10.1038/s41557-018-0114-8. ISSN 1755-4330.
- ^
- Fan, Mingyu (junio de 2023). Iones de radio y moléculas radiactivas para investigar nueva física (tesis). Universidad de California, Santa Bárbara. ProQuest 2857719184.
- Athanasakis, M.; Wilkins, SG; Cocolios, TE; Flanagan, KT; García Ruiz, RF; Neyens, G.; Yang, XF; Au, M.; Berger, R.; Bissell, ML; Borschevsky, A.; Breier, AA; Brinson, A.; de Groote, RP; Düllmann, Ch.E.; Galia, K.; Geldhof, S.; Giesen, TF; Gustafsson, FP; Karthein, J.; Koszorús, Á.; Lechner, S.; Malbrunot-Ettenauer, S.; Rothe, S.; Sels, S.; Stohner, J.; Udrescu, S.; Van Duppen, P.; Vernon, AR; Vilén, M. (6 de enero de 2021). «Moléculas radiactivas en ISOLDE» (PDF) . Organización Europea para la Investigación Nuclear .
- ^
- Bouchiat, Marie-Anne; Bouchiat, Claude (28 de noviembre de 1997). "Violación de paridad en átomos". Informes sobre el progreso en física . 60 (11): 1351–1396. Bibcode :1997RPPh...60.1351B. doi :10.1088/0034-4885/60/11/004. S2CID 250910046 – vía Instituto de Física.
- Commins, Eugene D.; Jackson, JD; DeMille, David P. (10 de mayo de 2007). "El momento dipolar eléctrico del electrón: una explicación intuitiva para la evasión del teorema de Schiff". American Journal of Physics . 75 (6): 532–536. Bibcode :2007AmJPh..75..532C. doi :10.1119/1.2710486 – vía aapt.scitation.org (Atypon).
- ^
- Dobaczewski, J.; Engel, J. (13 de junio de 2005). "Violación de la inversión temporal nuclear y el momento de Schiff de $^{225}\mathrm{Ra}$". Physical Review Letters . 94 (23): 232502. arXiv : nucl-th/0503057 . doi :10.1103/PhysRevLett.94.232502. PMID 16090465. S2CID 328830 – vía APS.org.
- Graner, B.; Chen, Y.; Lindahl, EG; Heckel, BR (18 de abril de 2016). "Límite reducido del momento dipolar eléctrico permanente de 199Hg". Physical Review Letters . 116 (16): 161601. arXiv : 1601.04339 . doi :10.1103/PhysRevLett.116.161601. PMID 27152789. S2CID 2230011 – vía APS.org.
- Parker, RH; Dietrich, MR; Kalita, MR; Lemke, ND; Bailey, KG; Bishof, M.; et al. (9 de junio de 2015). "Primera medición del momento dipolar eléctrico atómico de 225Ra". Physical Review Letters . 114 (23): 233002. arXiv : 1504.07477 . doi :10.1103/PhysRevLett.114.233002. PMID 26196797. S2CID 41982867 – vía APS.org.
- ^ Nuñez Portela, M.; Dijck, EA; Mohanty, A.; Bekker, H.; van den Berg, JE; Giri, GS; et al. (1 de enero de 2014). "Atrapamiento de iones Ra+: hacia una medición de violación de paridad atómica y un reloj óptico". Applied Physics B . 114 (1): 173–182. Bibcode :2014ApPhB.114..173N. doi :10.1007/s00340-013-5603-2. S2CID 119948902 – vía Springer Link.
- ^ Holliman, CA; Fan, M.; Contractor, A.; Brewer, SM; Jayich, AM (20 de enero de 2022). "Reloj óptico de iones de radio". Physical Review Letters . 128 (3): 033202. arXiv : 2201.07330 . Código Bibliográfico :2022PhRvL.128c3202H. doi :10.1103/PhysRevLett.128.033202. PMID 35119894. S2CID 246035333 – vía APS.
- ^
- Uso y reemplazo de fuentes de radiación: versión abreviada (informe). Comité sobre uso y reemplazo de fuentes de radiación / Junta de estudios nucleares y de radiación. Washington, DC: Consejo Nacional de Investigación de los Estados Unidos / National Academies Press. Enero de 2008. pág. 24. ISBN 978-0-309-11014-3. Archivado desde el original el 5 de septiembre de 2015 . Consultado el 27 de junio de 2015 – a través de Google Books.
- Bentel, Gunilla Carleson (1996). Planificación de la radioterapia. McGraw Hill Professional. pág. 8. ISBN 978-0-07-005115-7. Archivado desde el original el 5 de septiembre de 2015 . Consultado el 27 de junio de 2015 – a través de Google Books.
- ^
- "La FDA aprueba el fármaco de radioterapia Xofigo de Bayer y Algeta contra el cáncer de próstata". Archivado desde el original el 28 de junio de 2013. Consultado el 1 de octubre de 2014 .
- "La FDA aprueba Xofigo para el cáncer de próstata avanzado". cancer.org . 15 de mayo de 2013. Archivado desde el original el 6 de julio de 2013.
- ^ Maffioli, L.; Florimonte, L.; Costa, DC; Correia Castanheira, J.; Grana, C.; Luster, M.; et al. (2015). "Nuevos agentes radiofarmacéuticos para el tratamiento del cáncer de próstata resistente a la castración". QJ Nucl Med Mol Imaging . 59 (4): 420–438. PMID 26222274.
- ^ Stoll, Wolfgang (2005). "Torio y compuestos de torio". Ullmann's Encyclopedia of Industrial Chemistry . Wiley-VCH . pág. 717. doi :10.1002/14356007.a27_001. ISBN 978-3-527-31097-5.
- ^ l'Annunziata, Michael F. (2007). "Reacciones nucleares inducidas por partículas alfa". Radiactividad: Introducción e historia . Elsevier. pp. 260–261. ISBN 978-0-444-52715-8.
- ^ Holden, NE; Reciniello, RN; Hu, JP; Rorer, David C. (2004). "Dosimetría de radiación de una fuente de radio-berilio moderada con grafito" (PDF) . Health Physics . 86 (5 Suplemento): S110–S112. Bibcode :2003rdtc.conf..484H. doi :10.1142/9789812705563_0060. PMID 15069300. Archivado (PDF) desde el original el 23 de julio de 2018 . Consultado el 25 de octubre de 2017 .
- ^ ab Keller, Wolf y Shani 2011, págs. 96–98.
- ^ Redniss, Lauren (2011). Radioactive: Marie & Pierre Curie: A tale of love and fallout [Radiactivo: Marie y Pierre Curie: una historia de amor y repercusión] . Nueva York, NY: HarperCollins. pág. 70. ISBN. 978-0-06-135132-7.
- ^ Coppes-Zantinga, Arty R.; Coppes, Max J. (1 de diciembre de 1998). "Los primeros años de la protección radiológica: un homenaje a Madame Curie" (PDF) . CMAJ . 159 (11).
- ^ Gottfried, KLD; Penn, G, eds. (1996). "Historia de la regulación de la radiación en medicina". Radiación en medicina: una necesidad de reforma regulatoria. Washington (DC): National Academies Press (EE. UU.).
- ^ Clarke, RH; Valentin, J. (2009). "La historia de la ICRP y la evolución de sus políticas" (PDF) . Anales de la ICRP .
- ^ "7. Normas y advertencias". Perfil toxicológico del radio. Atlanta (Georgia): Agencia para Sustancias Tóxicas y Registro de Enfermedades (EE.UU.). 7 de diciembre de 1990.
- ^ "Materiales radiactivos de origen natural (NORM)". Asociación Nuclear Mundial . 29 de abril de 2024.
- ^ "Normas básicas internacionales de seguridad: Requisitos generales de seguridad, parte 3" (PDF) , Protección radiológica y seguridad de las fuentes de radiación , OIEA, julio de 2014, doi :10.61092/iaea.u2pu-60vm
- ^ "ARAO exporta con éxito Ra-226 a Canadá". Gestión de residuos radiactivos de ARAO . 29 de julio de 2024.
- ^ "Canadá utilizará fuentes radiactivas de Tailandia para tratamientos contra el cáncer". World Nuclear News . 24 de julio de 2024.
- ^ Evans, Melissa; Dahse, Zoe (5 de abril de 2024). "El OIEA permite la gestión segura de fuentes heredadas de radio-226". OIEA .
- ^ Datos de la EPA sobre el radio (PDF) . semspub.epa.gov (Informe). Agencia de Protección Ambiental de Estados Unidos . Consultado el 6 de marzo de 2023 .
- ^
- Weisgall, Jonathan M. (1994). Operación Crossroads: Las pruebas atómicas en el atolón Bikini . Naval Institute Press. pág. 238. ISBN 978-1-55750-919-2. Recuperado el 20 de agosto de 2011 .
- Fry, Shirley A. (1998). "Suplemento: El descubrimiento del radio por parte de Madame Curie (1898): una conmemoración de las mujeres en las ciencias de la radiación". Radiation Research . 150 (5): S25. Bibcode :1998RadR..150S..21F. doi :10.2307/3579805. JSTOR 3579805. PMID 9806606.
- ^ "Radiación ionizante". Administración de Seguridad y Salud Ocupacional . Consultado el 13 de agosto de 2024 .
- ^ "Preguntas frecuentes (FAQ) sobre el radio-226" (PDF) . Comisión Reguladora Nuclear de los Estados Unidos . Octubre de 2008 . Consultado el 12 de octubre de 2024 .
- ^ "Marcos jurídicos para las actividades nucleares". Agencia de Energía Nuclear (AEN) . Consultado el 22 de octubre de 2024 .
- ^ Kang, Keon Wook (febrero de 2016). "Historia y organizaciones para la protección radiológica". Revista de ciencia médica coreana . 31 Supl. 1 (Supl. 1): S4–5. doi :10.3346/jkms.2016.31.S1.S4. ISSN 1598-6357. PMC 4756341. PMID 26908987 .
- ^ Al Khatibeh, Ahmad; Dojcanova, Lenka (31 de julio de 2017). "El OIEA apoya a los países africanos para fortalecer la infraestructura regulatoria". www.iaea.org . Consultado el 22 de octubre de 2024 .
- ^ Aksenova, Nataliia; Troubat, Alix (12 de agosto de 2024). "Mejora del marco jurídico nuclear de la República del Congo". www.iaea.org . Consultado el 22 de octubre de 2024 .
Bibliografía
- Emsley, John (2003). Los elementos básicos de la naturaleza: una guía de la A a la Z de los elementos . Oxford University Press. pág. 351 y siguientes. ISBN 978-0-19-850340-8. Recuperado el 27 de junio de 2015 .
- Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- Keller, Cornelius; Wolf, Walter; Shani, Jashovam (15 de octubre de 2011). "Radionucleidos, 2. Elementos radiactivos y radionucleidos artificiales". Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. págs. 97–98. doi :10.1002/14356007.o22_o15. ISBN . 978-3527306732.
- Kirby, HW y Salutsky, Murrell L. (diciembre de 1964). Radioquímica del radio (informe). Acreditación: Departamento de Documentos Gubernamentales de las Bibliotecas de la UNT, a través de la Universidad del Norte de Texas , Biblioteca Digital de la UNT.Fuente alternativa: https://sgp.fas.org/othergov/doe/lanl/lib-www/books/rc000041.pdf
Lectura adicional
- Nanny Fröman (1 de diciembre de 1996). «Marie y Pierre Curie y el descubrimiento del polonio y el radio». Fundación Nobel . Consultado el 25 de diciembre de 2007 .
- Macklis, RM (1993). "El gran escándalo del radio". Scientific American . Vol. 269, no. 2. págs. 94–99. Bibcode :1993SciAm.269b..94M. doi :10.1038/scientificamerican0893-94. PMID 8351514.
- Marie Curie (1921), El descubrimiento del radio: discurso de Madame M. Curie en el Vassar College el 14 de mayo de 1921 (1.ª ed.), Poughkeepsie: Vassar College , Wikidata Q22920166
- Santos, Lucy Jane (2020). Half Lives: La improbable historia del radio . Icon Books. ISBN 9781785786082.OCLC 1158229829 .
Enlaces externos
- "El descubrimiento del radio". Lateral Science . Reino Unido. 8 de julio de 2012. Archivado desde el original el 9 de marzo de 2016 . Consultado el 13 de mayo de 2017 .
- Baño de agua con radio en Oklahoma. markwshead.com (imágenes fotográficas).
- "Radio, radiactivo". Banco de datos de sustancias peligrosas de la NLM . Institutos Nacionales de Salud de EE. UU .
- "Bibliografía comentada sobre el radio". Biblioteca digital Alsos para cuestiones nucleares . Lexington, VA: Washington and Lee University . Archivado desde el original el 25 de junio de 2019.
- "Radio". Tabla periódica de vídeos . Universidad de Nottingham .










