Adefovir
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Hepsera |
| AHFS / Drogas.com | Monografía |
Categoría de embarazo |
|
| Vías de administración | Oral |
| Código ATC |
|
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Biodisponibilidad | 59% |
| Unión de proteínas | <4% |
| Vida media de eliminación | 7,5 horas |
| Excreción | Orina |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| EBICh | |
| Química biológica | |
| Base de datos de sustancias químicas del NIAID |
|
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.106.235 |
| Datos químicos y físicos | |
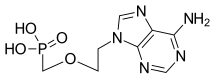
| Fórmula | C8H12N5O4P |
| Masa molar | 273,189 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
 norte norte Y (¿que es esto?) (verificar) Y (¿que es esto?) (verificar) | |
El adefovir es un medicamento de venta con receta que se utiliza para tratar infecciones (crónicas) por el virus de la hepatitis B. Anteriormente, una forma profármaco del adefovir se denominaba bis-POM PMEA , con los nombres comerciales Preveon y Hepsera . Es un inhibidor de la transcriptasa inversa análogo de nucleótidos (ntRTI) administrado por vía oral. Puede formularse como el profármaco pivoxil adefovir dipivoxil .
Usos
Se utiliza para el tratamiento de la hepatitis B. [1] [2] [3] [4]
Los ensayos de adefovir en pacientes con VIH no han demostrado ningún beneficio claro. [3] [5]
Historia
El adefovir fue inventado en el Instituto de Química Orgánica y Bioquímica de la Academia de Ciencias de la República Checa por Antonín Holý y fue desarrollado por Gilead Sciences para el VIH con el nombre comercial Preveon. Sin embargo, en noviembre de 1999, un panel de expertos recomendó a la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) que no aprobara el medicamento debido a las preocupaciones sobre la gravedad y la frecuencia de la toxicidad renal cuando se administraba en dosis de 60 o 120 mg. La FDA siguió ese consejo y se negó a aprobar el adefovir como tratamiento para el VIH. [ cita requerida ]
Gilead Sciences interrumpió su desarrollo para el tratamiento del VIH en diciembre de 1999, pero continuó desarrollando el fármaco para la hepatitis B (VHB), donde es eficaz con una dosis mucho menor de 10 mg. La FDA aprobó su uso en el tratamiento de la hepatitis B el 20 de septiembre de 2002, y el adefovir se vende para esta indicación bajo la marca Hepsera. El adefovir se convirtió en un tratamiento aprobado para el VHB en la Unión Europea en marzo de 2003. [ cita requerida ]
Mecanismo de acción

El adefovir actúa bloqueando la transcriptasa inversa , una enzima crucial para que el VHB se reproduzca en el organismo. Está aprobado para el tratamiento de la hepatitis B crónica en adultos con evidencia de replicación viral activa y evidencia de elevaciones persistentes de las aminotransferasas séricas (principalmente ALT) o enfermedad histológicamente activa.
El principal beneficio del adefovir sobre la lamivudina (el primer INTI aprobado para el tratamiento del VHB) es que el virus tarda mucho más tiempo en desarrollar resistencia a él.
El dipivoxil de adefovir contiene dos unidades de pivaloiloximetilo , lo que lo convierte en una forma profármaco de adefovir.
Referencias
- ^ Marcellin P, Chang TT, Lim SG, Tong MJ, Sievert W, Shiffman ML, et al. (febrero de 2003). "Adefovir dipivoxil para el tratamiento de la hepatitis B crónica con antígeno e positivo". The New England Journal of Medicine . 348 (9): 808–16. doi : 10.1056/NEJMoa020681 . PMID 12606735.
- ^ Manolakopoulos S, Bethanis S, Koutsounas S, Goulis J, Vlachogiannakos J, Christias E, et al. (febrero de 2008). "Terapia a largo plazo con adefovir dipivoxil en pacientes negativos al antígeno e de la hepatitis B que desarrollan resistencia a la lamivudina". Farmacología y terapéutica alimentaria . 27 (3): 266–73. doi : 10.1111/j.1365-2036.2007.03567.x . PMID 17988233.
- ^ ab Comité Directivo Internacional de ADHOC (octubre de 2002). "Un ensayo aleatorizado y controlado con placebo de adefovir dipivoxil en la infección avanzada por VIH: el ensayo ADHOC". Medicina del VIH . 3 (4): 229–38. doi : 10.1046/j.1468-1293.2002.00111.x . PMID 12444940.
- ^ "Etiqueta de adefovir dipivoxil en EE. UU." (PDF) . FDA. Abril de 2013 . Consultado el 12 de febrero de 2017 .
- ^ Fisher EJ, Chaloner K, Cohn DL, Grant LB, Alston B, Brosgart CL, et al. (septiembre de 2001). "Seguridad y eficacia de adefovir dipivoxil en pacientes con enfermedad avanzada por VIH: un ensayo aleatorizado, controlado con placebo". AIDS . 15 (13): 1695–700. doi : 10.1097/00002030-200109070-00013 . PMID 11546945. S2CID 9425407.
Enlaces externos
- CID {{{1}}} de PubChem- Adefovir dipivoxil