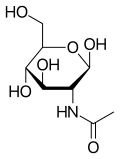
N-acetilglucosamina
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC β- D -(Acetilamino)-2-desoxi-glucopiranosa | |
| Otros nombres N -acetil- D -glucosamina GlcNAc NAG | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 1247660 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.028.517 |
| Número CE |
|
| 721281 | |
| BARRIL |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C8H15NO6 | |
| Masa molar | 221.21 |
| Punto de fusión | 211 |
| Compuestos relacionados | |
Monosacáridos relacionados | N-acetilgalactosamina |
Compuestos relacionados | Glucosamina Glucosa |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La N -acetilglucosamina (GlcNAc) es un derivado amida del monosacárido glucosa . Es una amida secundaria entre la glucosamina y el ácido acético . Es importante en varios sistemas biológicos.
Forma parte de un biopolímero de la pared celular bacteriana , que está formada por unidades alternas de GlcNAc y ácido N -acetilmurámico (MurNAc), reticuladas con oligopéptidos en el residuo de ácido láctico de MurNAc. Esta estructura en capas se denomina peptidoglicano (antes llamado mureína).
La GlcNAc es la unidad monomérica del polímero quitina , que forma los exoesqueletos de los artrópodos como los insectos y los crustáceos . Es el componente principal de las rádulas de los moluscos , los picos de los cefalópodos y un componente principal de las paredes celulares de la mayoría de los hongos .
Polimerizado con ácido glucurónico , forma hialuronano .
Se ha informado que la GlcNAc es un inhibidor de la liberación de elastasa de los leucocitos polimorfonucleares humanos (rango de inhibición del 8 al 17 %), sin embargo, esto es mucho más débil que la inhibición observada con la N -acetilgalactosamina (rango del 92 al 100 %). [1]
Usos médicos
Se ha propuesto como tratamiento para enfermedades autoinmunes y pruebas recientes han demostrado cierto éxito. [2] [3]
Oh-GlcNAcilación
La O -GlcNAcilación es el proceso de añadir un solo azúcar N -acetilglucosamina a la serina o treonina de una proteína. [4] Comparable a la fosforilación , la adición o eliminación de N -acetilglucosamina es un medio para activar o desactivar enzimas o factores de transcripción . [4] De hecho, la O -GlcNAcilación y la fosforilación a menudo compiten por los mismos sitios de serina/treonina. [4] La O -GlcNAcilación ocurre con mayor frecuencia en las proteínas de la cromatina y a menudo se observa como una respuesta al estrés. [4]
La hiperglucemia aumenta la O -GlcNAcilación, lo que conduce a la resistencia a la insulina . [5] El aumento de la O -GlcNAcilación debido a la hiperglucemia es evidentemente una forma disfuncional de O -GlcNAcilación. La disminución de la O -GlcNAcilación en el cerebro con la edad se asocia con el deterioro cognitivo . Cuando se aumentó la O -GlcNAcilación en el hipocampo de ratones viejos, el aprendizaje espacial y la memoria mejoraron. [6]
Véase también
- Sulfato de queratán
- N -acetilgalactosamina (GalNAc)
- N -acetil-lactosamina sintasa
- Aglutinina de germen de trigo , una lectina vegetal que se une a este sustrato.
Referencias
- ^ Kamel M, Hanafi M, Bassiouni M (1991). "Inhibición de la liberación de la enzima elastasa de los leucocitos polimorfonucleares humanos por N-acetil-galactosamina y N-acetil-glucosamina". Reumatología clínica y experimental . 9 (1): 17–21. PMID 2054963.
- ^ Grigorian A, Araujo L, Naidu NN, Place DJ, Choudhury B, Demetriou M (noviembre de 2011). "La N-acetilglucosamina inhibe las respuestas de las células T-helper 1 (Th1)/T-helper 17 (Th17) y trata la encefalomielitis autoinmune experimental". The Journal of Biological Chemistry . 286 (46): 40133–40141. doi : 10.1074/jbc.M111.277814 . PMC 3220534 . PMID 21965673.
- ^ Sy M, Newton BL, Pawling J, Hayama KL, Cordon A, Yu Z, et al. (septiembre de 2023). "La N-acetilglucosamina inhibe los marcadores de inflamación y neurodegeneración en la esclerosis múltiple: un ensayo mecanicista". Journal of Neuroinflammation . 20 (1): 209. doi : 10.1186/s12974-023-02893-9 . PMC 10498575 . PMID 37705084.
- ^ abcd Hart GW, Slawson C, Ramirez-Correa G, Lagerlof O (2011). "Interacción entre la O-GlcNAcilación y la fosforilación: funciones en la señalización, la transcripción y la enfermedad crónica". Revisión anual de bioquímica . 80 : 825–858. doi :10.1146/annurev-biochem-060608-102511. PMC 3294376 . PMID 21391816.
- ^ Ma J, Hart GW (agosto de 2013). "O-GlcNAcilación de proteínas en diabetes y complicaciones diabéticas". Expert Review of Proteomics . 10 (4): 365–380. doi :10.1586/14789450.2013.820536. PMC 3985334 . PMID 23992419.
- ^ Wheatley EG, Albarran E, White CW, Bieri G, Sanchez-Diaz C, Pratt K, et al. (octubre de 2019). "La O-GlcNAcylation neuronal mejora la función cognitiva en el cerebro de ratón envejecido". Current Biology . 29 (20): 3359–3369.e4. doi : 10.1016/j.cub.2019.08.003 . PMC 7199460 . PMID 31588002.
Enlaces externos
- Re la esclerosis múltiple


