5α-reductasa
| 3-Oxo-5α-esteroide 4-deshidrogenasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
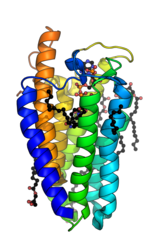 SDR5A bacteriano en complejo con NADPH y monooleína PDB : 7C83 | |||||||||
| Identificadores | |||||||||
| N.º CE | 1.3.1.22 | ||||||||
| N.º CAS | 9036-43-5 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| Ontología genética | AmiGO / QuickGO | ||||||||
| |||||||||
| Esteroide-5α-reductasa 1 | |||||||
|---|---|---|---|---|---|---|---|
| Identificadores | |||||||
| Símbolo | SRD5A1 | ||||||
| Gen NCBI | 6715 | ||||||
| HGNC | 11284 | ||||||
| OMI | 184753 | ||||||
| Secuencia de referencia | Número nuevo_001047 | ||||||
| Protección unificada | P18405 | ||||||
| Otros datos | |||||||
| Número CE | 1.3.1.22 | ||||||
| Lugar | Cap. 5 pág. 15 | ||||||
| |||||||
| Esteroide-5α-reductasa 2 | |||||||
|---|---|---|---|---|---|---|---|
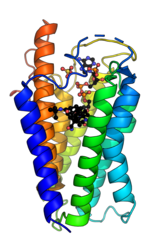 SRD5A2 humano en complejo con NADPH y Finasterida PDB : 7BW1 | |||||||
| Identificadores | |||||||
| Símbolo | SRD5A2 | ||||||
| Gen NCBI | 6716 | ||||||
| HGNC | 11285 | ||||||
| OMI | 607306 | ||||||
| Secuencia de referencia | Número de modelo_000348 | ||||||
| Protección unificada | P31213 | ||||||
| Otros datos | |||||||
| Número CE | 1.3.1.22 | ||||||
| Lugar | Cap. 2 pág. 23 | ||||||
| |||||||

Las 5α-reductasas , también conocidas como 3-oxo-5α-esteroide 4-deshidrogenasas , son enzimas implicadas en el metabolismo de los esteroides. Participan en tres vías metabólicas : biosíntesis de ácidos biliares , metabolismo de andrógenos y estrógenos . Existen tres isoenzimas de la 5α-reductasa codificadas por los genes SRD5A1 , SRD5A2 y SRD5A3 .
Las 5α-reductasas catalizan la siguiente reacción química generalizada :
- un 3-oxo-5α-esteroide + aceptor ⇌ un 3-oxo-Δ 4 -esteroide + aceptor reducido
Donde un 3-oxo-5α-esteroide y un aceptor son sustratos y un 3-oxo-Δ4-esteroide correspondiente y el aceptor reducido son productos . Un ejemplo de esta reacción generalizada que cataliza la 5α-reductasa tipo 2 es:
- dihidrotestosterona + NADP + testosterona + NADPH + H +
donde la dihidrotestosterona es el 3-oxo-5α-esteroide, NADP + es el aceptor y la testosterona es el 3-oxo-Δ4-esteroide y NADPH el aceptor reducido.
Producción y actividad
La enzima se produce en muchos tejidos tanto en hombres como en mujeres, en el tracto reproductivo, testículos y ovarios, [1] piel , vesículas seminales , próstata , epidídimo y muchos órganos, [2] incluido el sistema nervioso . [3] [4] Hay tres isoenzimas de la 5α-reductasa: esteroide 5α-reductasa 1, 2 y 3 ( SRD5A1 , SRD5A2 y SRD5A3 ). [2] [5] [6] [7]
Las 5α-reductasas actúan sobre los esteroides 3-oxo (3-ceto), Δ 4,5 C19/C21 como sustratos; "3-ceto" se refiere al doble enlace del tercer carbono al oxígeno. Los carbonos 4 y 5 también tienen un doble enlace, representado por 'Δ 4,5 '. La reacción implica una ruptura estereoespecífica y permanente del Δ 4,5 con la ayuda de NADPH como cofactor. También se coloca un anión hidruro (H−) en la cara α en el quinto carbono, y un protón en la cara β en el carbono 4. [8]
Distribución con la edad
El 5α-R1 se expresa en el cuero cabelludo fetal y en la piel no genital de la espalda, entre 5 y 50 veces menos que en el adulto. El 5α-R2 se expresa en las próstatas fetales de manera similar a los adultos. El 5α-R1 se expresa principalmente en el epitelio y el 5α-R2 en el estroma de la próstata fetal. Los científicos buscaron la expresión del 5α-R2 en el hígado fetal, las glándulas suprarrenales, los testículos, los ovarios, el cerebro, el cuero cabelludo, el pecho y la piel genital, mediante inmunotransferencia, y solo pudieron encontrarlo en la piel genital. [8]
Después del nacimiento, el 5α-R1 se expresa en más lugares, incluidos el hígado, la piel, el cuero cabelludo y la próstata. El 5α-R2 se expresa en la próstata, las vesículas seminales, el epidídimo, el hígado y, en menor medida, el cuero cabelludo y la piel. La expresión hepática tanto del 5α-R1 como del 5α-R2 es inmediata, pero desaparece en la piel y el cuero cabelludo al mes 18. Luego, en la pubertad, solo el 5α-R2 se vuelve a expresar en la piel y el cuero cabelludo.
5α-R1 y 5α-R2 parecen expresarse en la próstata en fetos masculinos y durante toda la vida postnatal. 5α-R1 y 5α-R2 también se expresan, aunque en diferentes grados en el hígado, la piel genital y no genital, la próstata, el epidídimo, la vesícula seminal, los testículos, los ovarios, el útero, los riñones, el páncreas exocrino y el cerebro. [3] [8]
En la edad adulta, 5α-R1-3 [ aclaración necesaria ] se expresa de forma ubicua.
Sustratos
Los sustratos específicos incluyen testosterona , progesterona , androstenediona , [9] epitestosterona , cortisol , aldosterona y desoxicorticosterona . Fuera de la dihidrotestosterona, se desconoce gran parte del papel fisiológico de los esteroides 5α-reducidos. [8] Más allá de reducir la testosterona a dihidrotestosterona, las isoformas I y II de la enzima 5alfa-reductasa reducen la progesterona a dihidroprogesterona (DHP) y la desoxicorticosterona a dihidrodesoxicorticosterona (DHDOC). Los modelos in vitro y animales sugieren que la posterior reducción 3alfa de DHT, DHP y DHDOC conduce a metabolitos esteroides con efectos sobre la función cerebral logrados al mejorar la inhibición GABAérgica . Estos derivados esteroides neuroactivos mejoran el GABA a través de la modulación alostérica en los receptores GABA(A) y tienen efectos anticonvulsivos, antidepresivos y ansiolíticos, y también alteran el comportamiento sexual y relacionado con el alcohol. [10] El 5α-dihidrocortisol está presente en el humor acuoso del ojo, se sintetiza en el cristalino y podría ayudar a producir el propio humor acuoso. [11] La alopregnanolona y el THDOC son neuroesteroides , y este último tiene efectos sobre la susceptibilidad de los animales a las convulsiones. En ratones socialmente aislados, el 5α-R1 se regula a la baja específicamente en las neuronas piramidales glutamatérgicas que convergen en la amígdala desde las regiones corticales e hipocampales. Esta regulación a la baja puede explicar la aparición de trastornos del comportamiento como la ansiedad, la agresión y la disfunción cognitiva. [3] [4] La 5α-dihidroaldosterona es un potente agente antinatriurético , aunque diferente de la aldosterona . Su formación en el riñón se ve favorecida por la restricción de sal en la dieta, lo que sugiere que puede ayudar a retener el sodio de la siguiente manera: [12]

Este es el mecanismo de la 5α-reductasa sobre la testosterona para convertirla en DHT (dihidrotestosterona). La 5α-reductasa funciona utilizando el poder reductor del NADPH para realizar un desplazamiento de hidruro en el doble enlace de carbono del anillo, lo que provoca la formación de enolato y la posterior tautamerización para formar DHT. [13]
La 5α-DHP es una hormona importante en la circulación de mujeres con ciclo normal y embarazadas. [14]
Testosterona
La 5α-reductasa es más conocida por convertir la testosterona , la hormona sexual masculina , en la más potente dihidrotestosterona :
La principal diferencia es el doble enlace Δ 4,5 en el anillo A (el más a la izquierda). Las demás diferencias entre los diagramas no están relacionadas con la estructura.
Lista de conversiones
Se sabe que las siguientes reacciones son catalizadas por la 5α-reductasa: [9]
- Colestenona → 5α-Colestanona
- Progesterona → 5α-Dihidroprogesterona
- 3α-Dihidroprogesterona → Alopregnanolona
- 3β-Dihidroprogesterona → Isopregnanolona
- Desoxicorticosterona → 5α-Dihidrodesoxicorticosterona
- Corticosterona → 5α-Dihidrocorticosterona
- Aldosterona → 5α-Dihidroaldosterona
- Androstenediona → 5α-Androstanediona
- Testosterona → 5α-Dihidrotestosterona
- Nandrolona → 5α-Dihidronandrolona
Estructura

La 5α-reductasa es una enzima unida a la membrana que cataliza la reducción dependiente de NADPH de los enlaces dobles en sustratos esteroides para aumentar la potencia. [15] La estructura cristalina de un homólogo de las isoenzimas 1 y 2 de la 5α-reductasa se ha encontrado en Proteobacteria (proteobacteria 5α-reductasa). Esta existe como un monómero con una estructura transmembrana de siete hélices alfa que alberga un bolsillo hidrofóbico que contiene el cofactor NADPH y la monooleína que ocupa el bolsillo de unión del sustrato esteroide. [16] En las células de insectos no se encuentra la monooleína, pero se sustituye por otros andrógenos e inhibidores. [17] La topología integral de siete transmembrana probablemente se conserva en todas las especies, con el extremo N en el lumen del retículo endoplásmico y el extremo C orientado hacia el citosol . La alta dinámica conformacional de la región citosólica probablemente regule el intercambio de NADPH/NADP+. [17] La conservación de secuencias en estructuras cristalinas conocidas ha corroborado una alta conservación en la estructura de la enzima. [16]
Inhibición
El mecanismo de inhibición de la 5α reductasa es complejo, pero implica la unión de NADPH a la enzima seguida del sustrato. Los fármacos inhibidores de la 5α-reductasa se utilizan en la hiperplasia prostática benigna , el cáncer de próstata , la pérdida de cabello de patrón (alopecia androgenética) y la terapia de reemplazo hormonal para mujeres transgénero .
La inhibición de la enzima se puede clasificar en dos categorías: esteroides, que son irreversibles, y no esteroides. Hay más inhibidores esteroides, con ejemplos que incluyen finasterida (MK-906), dutasterida (GG745), 4-MA, turosterida, MK-386, MK-434 y MK-963. Los investigadores han buscado la síntesis de no esteroides para inhibir la 5α-reductasa debido a los efectos secundarios no deseados de los esteroides. Los inhibidores más potentes y selectivos de 5α-R1 se encuentran en esta clase, e incluyen benzoquinolonas, ácidos arílicos no esteroides, derivados del ácido butanoico y, más reconocibles, ácidos grasos poliinsaturados (especialmente ácido linolénico ), zinc y té verde . [8] La riboflavina también se identificó como un inhibidor de la 5α-reductasa. [18]
Además, se ha afirmado que el alfatradiol actúa a través de este mecanismo de actividad (5α-reductasa), así como los ácidos ganodéricos del hongo lingzhi y el saw palmetto .
La inhibición de la 5α-reductasa produce una disminución de la conversión de testosterona en DHT, lo que conduce a un aumento de la testosterona y el estradiol . Otras enzimas compensan hasta cierto punto la falta de conversión, específicamente con la expresión local en la piel de las enzimas 17β-hidroxiesteroide deshidrogenasa reductora , 3α-hidroxiesteroide deshidrogenasa oxidativa y 3β-hidroxiesteroide deshidrogenasa . [19]
La ginecomastia , la disfunción eréctil , el deterioro de la función cognitiva, la fatiga , la hipoglucemia , el deterioro de la función hepática, el estreñimiento y la depresión son sólo algunos de los posibles efectos secundarios de la inhibición de la 5α-reductasa. Se han notificado efectos secundarios a largo plazo que continuaron incluso después de suspender el fármaco. [20]
Finasterida
La finasterida inhibe dos isoenzimas de la 5α-reductasa (II y III), mientras que la dutasterida inhibe las tres. [2] La finasterida inhibe potentemente la 5α-R2 a una concentración inhibitoria media IC50 de 69 nM, pero es menos eficaz con la 5α-R1 con una IC50 de 360 nM. [21] La finasterida disminuye el nivel sérico medio de DHT en un 71% después de 6 meses, [22] y se ha demostrado in vitro que inhibe la 5α-R3 con una potencia similar a la 5α-R2 en líneas celulares transfectadas. [2]
Dutasterida
La dutasterida inhibe las isoenzimas 5α-reductasa tipo 1 y 2 mejor que la finasterida, lo que lleva a una reducción más completa de la DHT a las 24 semanas (94,7% frente a 70,8%). [23] También reduce la DHT intraprostática en un 97% en hombres con cáncer de próstata a 5 mg/día durante tres meses. [24] Un segundo estudio con 3,5 mg/día durante 4 meses redujo la DHT intraprostática aún más en un 99%. [25] La supresión de DHT in vivo y el informe de que la dutasterida inhibe la 5α-R3 in vitro [26] sugieren que la dutasterida puede ser un triple inhibidor de la 5α reductasa. [8]

Deficiencias congénitas
5α-reductasa 1
Los ratones machos con 5α-reductasa tipo 1 inactivada tienen una masa ósea reducida y una fuerza de agarre muscular en las extremidades anteriores reducida, lo que se ha propuesto que se debe a la falta de expresión de 5α-reductasa tipo 1 en los huesos y los músculos. [29] En los machos deficientes en 5α-reductasa tipo 2, se cree que la isoenzima tipo 1 es responsable de su virilización en la pubertad. [6]
5α-reductasa 2
La actividad alterada de la 5α-reductasa 2 puede ser resultado de mutaciones en el gen subyacente SRD5A2. La afección, conocida como deficiencia de 5α-reductasa 2 , tiene una variedad de presentaciones como apariencias atípicas de los genitales externos en los hombres. Esto se debe a que la 5α-reductasa 2 cataliza la transformación de la testosterona en el potente andrógeno dihidrotestosterona, que es necesario para la masculinización adecuada de los genitales masculinos. [30]
5α-reductasa 3
Cuando se utiliza un ARN interferente pequeño para reducir la expresión de la isoenzima 5α-R3 en líneas celulares , se produce una disminución del crecimiento celular, la viabilidad y una disminución de las proporciones DHT/T. [31] También se ha demostrado la capacidad de reducir la testosterona, la androstenediona y la progesterona en líneas celulares de próstata estimuladas por andrógenos mediante vectores de adenovirus. [8]
La deficiencia congénita de 5α-R3 en el gen SRD53A se ha relacionado con una enfermedad autosómica recesiva poco común en la que los pacientes nacen con disfunción intelectual grave y defectos cerebelosos y oculares. La presunta deficiencia es la reducción del enlace terminal del poliprenol a dolicol, un paso importante en la N-glicosilación de las proteínas, que a su vez es importante para el plegamiento adecuado de los residuos de asparagina en la proteína naciente en el retículo endoplasmático . [32]
Sistema nervioso
Trastornos afectivos
Se ha demostrado que la crianza en aislamiento reduce la expresión proteica de las isoenzimas 1 y 2 de la 5α-reductasa en las regiones cerebrales corticales y subcorticales de los modelos de rata. Sin embargo, la cantidad de metabolito 5α-reducido no se vio afectada. Esto significa que la crianza en aislamiento probablemente conduce a cambios en la expresión y actividad de la 5α-reductasa en el cerebro, lo que lleva a la desregulación de la neurotransmisión de dopamina , lo que resulta en estrés crónico temprano [33] Se ha demostrado que el tratamiento con finasterida , un inhibidor de la 5α-reductasa, imita los efectos de los ISRS que causan disfunción sexual . [34] La investigación ha demostrado que la 5α-reductasa es la enzima limitante de la velocidad en la síntesis de neuroesteroides , específicamente en la conversión de progesterona a alopregnanolona , [35] los niveles bajos de alopregnanolona se han relacionado con la depresión , la ansiedad y la esquizofrenia . La falta de sueño puede aumentar la expresión y la actividad de la 5α-reductasa en la corteza prefrontal , lo que provoca síntomas relacionados con la manía en ratas. [35] También se discute si el uso de inhibidores de la 5α-reductasa está asociado con la ideación suicida y la depresión en poblaciones de pacientes que los utilizan para la hiperplasia prostática benigna . [36] [37] Estos síntomas se han encontrado durante el uso activo de inhibidores y en el seguimiento inmediato. [36] Sin embargo, se desconoce si estos síntomas surgen naturalmente de la hiperplasia prostática benigna. [37]
Disfunción del eje hipotálamo-hipofisario-suprarrenal
Un mecanismo alternativo de regulación del cortisol se regula a través de la 5α-reductasa que cataliza una reducción del anillo A del cortisol, metabolizando el compuesto. [38] Los tipos 1 y 2 de la 5α-reductasa son las principales enzimas implicadas en la depuración del cortisol a través del hígado . [39] El exceso de cortisol se ha relacionado con la enfermedad del hígado graso no alcohólico (NAFLD), pero los estudios in vitro han encontrado que una sobreexpresión de la 5α-reductasa tipo 2 puede suprimir la lipogénesis . [40] El papel clave de la 5α-reductasa en la descomposición del cortisol y la acumulación de grasa ha dilucidado algunos de los efectos secundarios de los inhibidores de la 5α-reductasa. En estudios aleatorizados en voluntarios humanos se encontró que la inhibición de la 5α-reductasa mediante el uso de dutasterida y finasterida puede conducir a la acumulación de lípidos hepáticos en hombres. [41] En enfermedades críticas, la sobreestimulación del cortisol como parte de una respuesta al estrés puede conducir a una disminución de la depuración de cortisol a través del hígado a través de la 5α-reductasa y de los riñones a través de la 11β-hidroxiesteroide deshidrogenasa tipo 2 , [39] la elevación a largo plazo del cortisol puede conducir al síndrome de Cushing .
Nomenclatura
Esta enzima pertenece a la familia de las oxidorreductasas , concretamente a aquellas que actúan sobre el grupo CH-CH del donador con otros aceptores. El nombre sistemático de esta clase de enzimas es 3-oxo-5α-esteroide:aceptor Δ 4 -oxidorreductasa . Otros nombres de uso común son:
- 5α-reductasa
- 3-Oxoesteroide Δ 4 -deshidrogenasa
- 3-Oxo-5α-esteroide Δ 4 -deshidrogenasa
- Esteroide Δ 4 -5α-reductasa
- Δ 4-3 -Ceto esteroide 5α-reductasa
- Δ 4-3 -Oxo esteroide reductasa
- Δ 4-3- cetoesteroide-5α-oxidorreductasa
- Δ 4-3 -Oxoesteroide-5α-reductasa
- 3-ceto-Δ 4 -esteroide-5α-reductasa
- Testosterona 5α-reductasa
- 4-Ene-3-cetoesteroide-5α-oxidorreductasa
- Δ 4 -5α-deshidrogenasa
- 3-Oxo-5α-esteroide:(aceptor) Δ 4 -oxidorreductasa
Véase también
- Enzima esteroidogénica
- Acné vulgar
- Colestenona 5α-reductasa
- Hirsutismo
- Síntomas del tracto urinario inferior
- Síndrome de ovario poliquístico
- Lista de moduladores del metabolismo de esteroides
Referencias
- ^ Pinna G, Agis-Balboa RC, Pibiri F, Nelson M, Guidotti A, Costa E (octubre de 2008). "La biosíntesis de neuroesteroides regula el miedo sexualmente dimórfico y el comportamiento agresivo en ratones". Neurochemical Research . 33 (10): 1990–2007. doi :10.1007/s11064-008-9718-5. PMID 18473173. S2CID 19338424.
- ^ abcd Yamana K, Labrie F, Luu-The V (agosto de 2010). "La 5α-reductasa humana de tipo 3 se expresa en los tejidos periféricos en niveles más altos que los tipos 1 y 2 y su actividad es inhibida de forma potente por la finasterida y la dutasterida". Hormone Molecular Biology and Clinical Investigation . 2 (3): 293–9. doi :10.1515/hmbci.2010.035. PMID 25961201. S2CID 28841145.
- ^ abc Agís-Balboa RC, Pinna G, Zhubi A, Maloku E, Veldic M, Costa E, et al. (septiembre de 2006). "Caracterización de neuronas cerebrales que expresan enzimas que median la biosíntesis de neuroesteroides". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (39): 14602–7. Bibcode :2006PNAS..10314602A. doi : 10.1073/pnas.0606544103 . PMC 1600006 . PMID 16984997.
- ^ ab Agís-Balboa RC, Pinna G, Pibiri F, Kadriu B, Costa E, Guidotti A (noviembre de 2007). "La regulación negativa de la biosíntesis de neuroesteroides en circuitos corticolímbicos media el comportamiento inducido por el aislamiento social en ratones". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 104 (47): 18736–41. Bibcode :2007PNAS..10418736A. doi : 10.1073/pnas.0709419104 . PMC 2141846 . PMID 18003893.
- ^ Killian J, Pratis K, Clifton RJ, Stanton PG, Robertson DM, O'Donnell L (mayo de 2003). "Isoenzimas 1 y 2 de la 5alfa-reductasa en el testículo de la rata durante el desarrollo postnatal". Biología de la reproducción . 68 (5): 1711–8. doi : 10.1095/biolreprod.102.009142 . PMID 12606426.
- ^ ab Thiele S, Hoppe U, Holterhus PM, Hiort O (junio de 2005). "La isoenzima tipo 1 de la 5-alfa-reductasa se transcribe abundantemente en fibroblastos de la piel genital humana normal y puede desempeñar un papel importante en la masculinización de los varones con deficiencia de 5-alfa-reductasa tipo 2". Revista Europea de Endocrinología . 152 (6): 875–80. doi : 10.1530/eje.1.01927 . PMID 15941927.
- ^ Godoy A, Kawinski E, Li Y, Oka D, Alexiev B, Azzouni F, et al. (julio de 2011). "Expresión de la 5α-reductasa tipo 3 en tejidos humanos benignos y malignos: un análisis comparativo durante la progresión del cáncer de próstata". The Prostate . 71 (10): 1033–46. doi :10.1002/pros.21318. PMC 4295561 . PMID 21557268.
- ^ abcdefg Azzouni F, Godoy A, Li Y, Mohler J (2012). "La familia de isoenzimas de la 5 alfa-reductasa: una revisión de la biología básica y su papel en las enfermedades humanas". Avances en Urología . 2012 : 530121. doi : 10.1155/2012/530121 . PMC 3253436. PMID 22235201 .
- ^ ab Paba S, Frau R, Godar SC, Devoto P, Marrosu F, Bortolato M (2011). "Esteroide 5α-reductasa como un nuevo objetivo terapéutico para la esquizofrenia y otros trastornos neuropsiquiátricos". Current Pharmaceutical Design . 17 (2): 151–67. doi :10.2174/138161211795049589 (inactivo 2024-04-11). PMID 21361868.
{{cite journal}}: CS1 maint: DOI inactivo a partir de abril de 2024 ( enlace ) - ^ Finn DA, Beadles-Bohling AS, Beckley EH, Ford MM, Gililland KR, Gorin-Meyer RE, et al. (2006). "Una nueva mirada al inhibidor de la 5-alfa-reductasa finasterida". CNS Drug Reviews . 12 (1): 53–76. doi :10.1111/j.1527-3458.2006.00053.x. PMC 6741762 . PMID 16834758.
- ^ Weinstein BI, Kandalaft N, Ritch R, Camras CB, Morris DJ, Latif SA, et al. (junio de 1991). "5 alfa-dihidrocortisol en el humor acuoso humano y metabolismo del cortisol por lentes humanos in vitro". Oftalmología investigativa y ciencia visual . 32 (7): 2130–5. PMID 2055703.
- ^ Kenyon CJ, Brem AS, McDermott MJ, Deconti GA, Latif SA, Morris DJ (mayo de 1983). "Actividades antinatriuréticas y kaliuréticas de los derivados reducidos de la aldosterona". Endocrinología . 112 (5): 1852–6. doi :10.1210/endo-112-5-1852. PMID 6403339.
- ^ Ahmed S, Denison S (septiembre de 1998). "Representación basada en mecanismos del sitio activo de la 5 alfa-reductasa (5AR)". Bioorganic & Medicinal Chemistry Letters . 8 (18): 2615–70. doi :10.1016/S0960-894X(98)00463-6. PMID 9873591.
- ^ Milewich L, Gomez-Sanchez C, Crowley G, Porter JC, Madden JD, MacDonald PC (octubre de 1977). "Progesterona y 5alfa-pregnano-3,20-diona en sangre periférica de mujeres jóvenes normales: mediciones diarias durante todo el ciclo menstrual". The Journal of Clinical Endocrinology and Metabolism . 45 (4): 617–22. doi : 10.1210/jcem-45-4-617 . PMID 914969.
- ^ Wilson JD (8 de febrero de 2002). "El papel de la reducción de 5alfa en la fisiología de las hormonas esteroides". Reproducción, fertilidad y desarrollo . 13 (7–8): 673–8. doi :10.1071/rd01074. PMID 11999320. Archivado desde el original el 26 de mayo de 2021. Consultado el 6 de marzo de 2021 .
- ^ ab Han Y, Zhuang Q, Sun B, Lv W, Wang S, Xiao Q, et al. (enero de 2021). "La estructura cristalina de la esteroide reductasa SRD5A revela un mecanismo conservado de reducción de esteroides". Nature Communications . 12 (1): 449. Bibcode :2021NatCo..12..449H. doi :10.1038/s41467-020-20675-2. PMC 7815742 . PMID 33469028.
- ^ ab Xiao Q, Wang L, Supekar S, Shen T, Liu H, Ye F, et al. (octubre de 2020). "Estructura de la esteroide 5α-reductasa 2 humana con el fármaco antiandrógeno finasterida". Nature Communications . 11 (1): 5430. Bibcode :2020NatCo..11.5430X. doi :10.1038/s41467-020-19249-z. PMC 7591894 . PMID 33110062.
- ^ Nakayama O, Yagi M, Kiyoto S, Okuhara M, Kohsaka M (diciembre de 1990). "Riboflavina, un inhibidor de la testosterona 5 alfa-reductasa". La revista de antibióticos . 43 (12): 1615–6. doi : 10.7164/antibióticos.43.1615 . PMID 2276981.
- ^ Andersson S (2001). "Enzimas esteroidogénicas en la piel". Revista Europea de Dermatología . 11 (4): 293–5. PMID 11399532.
- ^ Irwig MS, Kolukula S (junio de 2011). "Efectos secundarios sexuales persistentes de la finasterida para la pérdida de cabello de patrón masculino". The Journal of Sexual Medicine . 8 (6): 1747–53. doi :10.1111/j.1743-6109.2011.02255.x. PMID 21418145.
- ^ Tian G, Stuart JD, Moss ML, Domanico PL, Bramson HN, Patel IR, et al. (marzo de 1994). "17 beta-(N-terc-butilcarbamoil)-4-aza-5 alfa-androstan-1-en-3-ona es un inhibidor activo dependiente del tiempo y dirigido al sitio de la esteroide 5 alfa-reductasa 1 humana". Bioquímica . 33 (8): 2291–6. doi :10.1021/bi00174a041. PMID 8117686.
- ^ McConnell JD, Wilson JD, George FW, Geller J, Pappas F, Stoner E (marzo de 1992). "Finasteride, un inhibidor de la 5 alfa-reductasa, suprime la dihidrotestosterona prostática en hombres con hiperplasia prostática benigna". The Journal of Clinical Endocrinology and Metabolism . 74 (3): 505–8. doi :10.1210/jcem.74.3.1371291. PMID 1371291.
- ^ Clark RV, Hermann DJ, Cunningham GR, Wilson TH, Morrill BB, Hobbs S (mayo de 2004). "Supresión marcada de dihidrotestosterona en hombres con hiperplasia prostática benigna mediante dutasterida, un inhibidor dual de la 5-alfa-reductasa". The Journal of Clinical Endocrinology and Metabolism . 89 (5): 2179–84. doi : 10.1210/jc.2003-030330 . PMID 15126539.
- ^ Andriole GL, Humphrey P, Ray P, Gleave ME, Trachtenberg J, Thomas LN, et al. (septiembre de 2004). "Efecto del inhibidor dual de la 5alfa-reductasa dutasterida sobre los marcadores de regresión tumoral en el cáncer de próstata". The Journal of Urology . 172 (3): 915–9. doi :10.1097/01.ju.0000136430.37245.b9. PMID 15310997.
- ^ Gleave M, Qian J, Andreou C, Pommerville P, Chin J, Casey R, et al. (noviembre de 2006). "Los efectos del inhibidor dual de la 5alfa-reductasa dutasterida en el cáncer de próstata localizado: resultados de un estudio de 4 meses previo a la prostatectomía radical". The Prostate . 66 (15): 1674–85. doi : 10.1002/pros.20499 . PMID 16927304. S2CID 40446842.
- ^ Moss GP (diciembre de 1989). "IUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN). La nomenclatura de los esteroides. Recomendaciones 1989". Revista Europea de Bioquímica . 186 (3): 429–58. doi :10.1111/j.1432-1033.1989.tb15228.x. PMID 2606099.
- ^ Drury JE, Di Costanzo L, Penning TM, Christianson DW (julio de 2009). "Inhibición de la esteroide 5beta-reductasa humana (AKR1D1) por finasterida y estructura del complejo enzima-inhibidor". The Journal of Biological Chemistry . 284 (30): 19786–90. doi : 10.1074/jbc.c109.016931 . PMC 2740403 . PMID 19515843.
- ^ Hulin-Curtis SL, Petit D, Figg WD, Hsing AW, Reichardt JK (diciembre de 2010). "Metabolismo y farmacogenética de la finasterida: nuevos enfoques para la prevención personalizada del cáncer de próstata". Future Oncology . 6 (12): 1897–913. doi :10.2217/fon.10.149. PMC 6300128 . PMID 21142863.
- ^ Windahl SH, Andersson N, Börjesson AE, Swanson C, Svensson J, Movérare-Skrtic S, et al. (2011). Vanacker JM (ed.). "Reducción de la masa ósea y la fuerza muscular en ratones machos inactivados con 5α-reductasa tipo 1". PLOS ONE . 6 (6): e21402. Bibcode :2011PLoSO...621402W. doi : 10.1371/journal.pone.0021402 . PMC 3120862 . PMID 21731732.
- ^ Sinnecker GH, Hiort O, Dibbelt L, Albers N, Dörr HG, Hauß H, et al. (3 de mayo de 1996). "Clasificación fenotípica del pseudohermafroditismo masculino debido a la deficiencia de la esteroide 5α-reductasa 2". American Journal of Medical Genetics . 63 (1): 223–230. doi :10.1002/(SICI)1096-8628(19960503)63:1<223::AID-AJMG39>3.0.CO;2-O. PMID 8723114.
- ^ Uemura M, Tamura K, Chung S, Honma S, Okuyama A, Nakamura Y, et al. (enero de 2008). "La nueva 5 alfa-esteroide reductasa (SRD5A3, tipo 3) se sobreexpresa en el cáncer de próstata refractario a las hormonas". Cancer Science . 99 (1): 81–6. doi : 10.1111/j.1349-7006.2007.00656.x . PMC 11158902 . PMID 17986282. S2CID 51733620.
- ^ Cantagrel V, Lefeber DJ, Ng BG, Guan Z, Silhavy JL, Bielas SL, et al. (julio de 2010). "SRD5A3 es necesaria para convertir poliprenol en dolicol y está mutada en un trastorno congénito de la glicosilación". Cell . 142 (2): 203–17. doi :10.1016/j.cell.2010.06.001. PMC 2940322 . PMID 20637498.
- ^ Bortolato M, Devoto P, Roncada P, Frau R, Flore G, Saba P, et al. (junio de 2011). "Reducción de la expresión de la 5α-reductasa cerebral inducida por la crianza en aislamiento: relevancia para los deterioros dopaminérgicos". Neurofarmacología . 60 (7–8): 1301–8. doi :10.1016/j.neuropharm.2011.01.013. PMID 21256141. S2CID 20164197.
- ^ Giatti S, Diviccaro S, Panzica G, Melcangi RC (agosto de 2018). "Síndrome posfinasterida y disfunción sexual posinhibición de la recaptación de serotonina: ¿dos caras de la misma moneda?". Endocrine . 61 (2): 180–193. doi :10.1007/s12020-018-1593-5. PMID 29675596. S2CID 4974636.
- ^ ab Frau R, Bini V, Soggiu A, Scheggi S, Pardu A, Fanni S, et al. (octubre de 2017). "La enzima neuroesteroidogénica 5α-reductasa media las complicaciones psicóticas de la privación del sueño". Neuropsicofarmacología . 42 (11): 2196–2205. doi :10.1038/npp.2017.13. PMC 5603808 . PMID 28102229.
- ^ ab Welk B, McArthur E, Ordon M, Anderson KK, Hayward J, Dixon S (mayo de 2017). "Asociación de la tendencia suicida y la depresión con inhibidores de la 5α-reductasa". JAMA Internal Medicine . 177 (5): 683–691. doi :10.1001/jamainternmed.2017.0089. PMC 5818776 . PMID 28319231.
- ^ ab Dyson TE, Cantrell MA, Lund BC (octubre de 2020). "Falta de asociación entre los inhibidores de la 5α-reductasa y la depresión". The Journal of Urology . 204 (4): 793–798. doi :10.1097/JU.0000000000001079. PMID 32294395. S2CID 215794669.
- ^ Petrescu AD, Kain J, Liere V, Heavener T, DeMorrow S (2018). "Disfunción hipotálamo-hipofisaria-suprarrenal en la enfermedad hepática colestásica". Frontiers in Endocrinology . 9 : 660. doi : 10.3389/fendo.2018.00660 . PMC 6240761 . PMID 30483216.
- ^ ab Boonen E, Vervenne H, Meersseman P, Andrew R, Mortier L, Declercq PE, et al. (abril de 2013). "Metabolismo reducido del cortisol durante una enfermedad crítica". The New England Journal of Medicine . 368 (16): 1477–88. doi :10.1056/NEJMoa1214969. PMC 4413428 . PMID 23506003.
- ^ Nasiri M, Nikolaou N, Parajes S, Krone NP, Valsamakis G, Mastorakos G, et al. (agosto de 2015). "La 5α-reductasa tipo 2 regula la acción de los glucocorticoides y el fenotipo metabólico en los hepatocitos humanos". Endocrinología . 156 (8): 2863–71. doi :10.1210/en.2015-1149. PMC 4511138 . PMID 25974403.
- ^ Hazlehurst JM, Oprescu AI, Nikolaou N, Di Guida R, Grinbergs AE, Davies NP, et al. (enero de 2016). "La inhibición de la 5α-reductasa dual promueve la acumulación de lípidos hepáticos en el hombre". The Journal of Clinical Endocrinology and Metabolism . 101 (1): 103–13. doi :10.1210/jc.2015-2928. PMC 4701851 . PMID 26574953.
Lectura adicional
Enlaces externos
- Testosterona+5-alfa-reductasa en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.





