2-Metiltetrahidrofurano
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido 2-Metiloxolano | |
| Otros nombres 2-Metiltetrahidrofurano, 2-Metil-THF | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) |
|
| Química biológica |
|
| Araña química |
|
| Tarjeta informativa de la ECHA | 100.002.281 |
| Número CE |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD |
|
| Número de la ONU | 2536 |
Panel de control CompTox ( EPA ) |
|
| Propiedades | |
| C5H10O | |
| Masa molar | 86,134 g·mol −1 |
| Densidad | 0,854 g/ml |
| Punto de fusión | -136 °C (-213 °F; 137 K) [2] |
| Punto de ebullición | 80,2 °C (176,4 °F; 353,3 K) [2] |
| 21,0 % en peso (0,0 °C) 17,8 % en peso (9,5 °C) 14,4 % en peso (19,3 °C) 11,4 % en peso (29,5 °C) 9,2 % en peso (39,6 °C) 7,8 % en peso (50,1 °C) 6,6 % en peso (60,7 °C) 6,0 % en peso (70,6 °C) [1] | |
| Peligros | |
| Etiquetado SGA : | |
   | |
| Advertencia | |
| H225 , H302 , H315 , H318 , H319 , H335 , H336 | |
| P210 , P233 , P240 , P241 , P242 , P243 , P261 , P264 , P270 , P271 , P280 , P301+P312 , P302+P352 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P312 , P321 , P330 , P332+P313 , P337+P313 , P362 , P370+P378 , P403+P233 , P403+P235 , P405 , P501 | |
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El 2-metiltetrahidrofurano (2-MeTHF) es un compuesto orgánico con la fórmula molecular C 5 H 10 O. Es un líquido altamente inflamable y móvil. Se utiliza principalmente como sustituto del tetrahidrofurano (THF) en aplicaciones especializadas por su mejor rendimiento, como para obtener temperaturas de reacción más altas o separaciones más fáciles (ya que, a diferencia del THF, no es miscible con agua). Se deriva de los azúcares a través del furfural y, en ocasiones, se promociona como biocombustible . [3]
Estructuras y propiedades
El 2-metiltetrahidrofurano es "inversamente soluble" en agua, es decir, su solubilidad disminuye con el aumento de la temperatura, lo que es una propiedad poco común. [4] Se informa que la solubilidad del agua en 2-metiltetrahidrofurano es de 4,4 g/100 g a 23 °C. [5] Al igual que el tetrahidrofurano, el 2-metiltetrahidrofurano puede actuar como una base de Lewis en reacciones organometálicas. [2] El 2-metiltetrahidrofurano se produce generalmente como una mezcla racémica .
Preparación
El 2-metiltetrahidrofurano se sintetiza generalmente mediante hidrogenación catalítica del furfural . [6]
- OC 4 H 3 CHO + 4 H 2 → OC 4 H 7 CH 3 + H 2 O
El furfural se produce mediante la digestión catalizada por ácido de los azúcares pentosanos , polisacáridos C 5 , en la biomasa . Por lo tanto, las materias primas del 2-metiltetrahidrofurano son biomasa renovable rica en celulosa , hemicelulosas y lignina , como las mazorcas de maíz o el bagazo y otros desechos vegetales y agrícolas. [7]
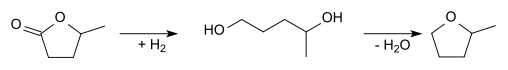
El 2-metiltetrahidrofurano también se puede producir a partir del ácido levulínico . La ciclización y reducción da como resultado γ-valerolactona :
La γ-valerolactona se puede hidrogenar a 1,4-pentanodiol, que luego se puede deshidratar para dar 2-metiltetrahidrofurano:
Aplicaciones
El 2-metiltetrahidrofurano se utiliza principalmente como un sustituto de mayor punto de ebullición del tetrahidrofurano como disolvente especial . También se utiliza en la formulación de electrolitos para electrodos secundarios de litio y como componente de combustibles alternativos . Es un disolvente valioso para reacciones a baja temperatura. El 2-metiltetrahidrofurano forma un vidrio, que no cristaliza, y se utiliza con frecuencia como disolvente para estudios espectroscópicos a -196 °C. [2]
Otros usos comunes del 2-metiltetrahidrofurano son como disolvente para reactivos de Grignard utilizados en procesos químicos organometálicos y bifásicos , debido a la capacidad del átomo de oxígeno de coordinarse con el componente de iones de magnesio del reactivo de Grignard, o para secar productos azeotrópicamente. El uso de 2-metiltetrahidrofurano proporciona separaciones de fases acuosas orgánicas muy limpias . Es un sustituto popular, pero más costoso, del tetrahidrofurano.
El 2-metiltetrahidrofurano está aprobado por el Departamento de Energía de los Estados Unidos como aditivo para la gasolina. El furfural y otros compuestos furílicos (alcohol furfurílico, metilfurano, alcohol tetrahidrofurílico) tienen tendencia a polimerizarse y son bastante volátiles. Sin embargo, el 2-metiltetrahidrofurano en sí es más estable y menos volátil, por lo que es adecuado para su uso como combustible para motores.
El 2-metiltetrahidrofurano se ha promocionado como una alternativa ecológica al THF. [8] Si bien el 2-MeTHF es más caro, puede proporcionar una mayor economía general del proceso. El 2-MeTHF tiene propiedades solvatantes intermedias entre el éter dietílico y el THF, tiene una miscibilidad limitada con el agua y forma un azeótropo con el agua en la destilación. Su punto de fusión más bajo lo hace útil para reacciones a temperaturas más bajas, y su punto de ebullición más alto permite procedimientos bajo reflujo a temperaturas más altas (en relación con el THF).
Referencias
- ^ Sicaire, Anne-Gaëlle; Vian, Maryline Abert; Filly, Aurore; Li, Ying; Bily, Antoine; Chemat, Farid (2014), Chemat, Farid; Vian, Maryline Abert (eds.), "2-Metiltetrahidrofurano: principales propiedades, procesos de producción y aplicación en la extracción de productos naturales", Solventes alternativos para la extracción de productos naturales, Berlín, Heidelberg: Springer Berlin Heidelberg, págs. 253–268, doi:10.1007/978-3-662-43628-8_12, ISBN 978-3-662-43627-1
- ^ abcd Aycock, David F. (2007). "Aplicaciones de disolventes de 2-metiltetrahidrofurano en reacciones organometálicas y bifásicas". Org. Process Res. Dev. 11 : 156–159. doi :10.1021/op060155c.
- ^ Leal Silva, Jean Felipe; Mariano, Adriano Pinto; Maciel Filho, Rubens (2018). "Potencial económico del 2-metiltetrahidrofurano (MTHF) y el levulinato de etilo (EL) producidos a partir de furfural derivado de hemicelulosas". Biomasa y bioenergía . 119 (diciembre de 2018): 492–502. Código Bibliográfico :2018BmBe..119..492L. doi :10.1016/j.biombioe.2018.10.008. S2CID 104836889.
- ^ Sicaire, Anne-Gaëlle; Vian, Maryline Abert; Filly, Aurore; Li, Ying; Bily, Antoine; Chemat, Farid (2014), Chemat, Farid; Vian, Maryline Abert (eds.), "2-Metiltetrahidrofurano: principales propiedades, procesos de producción y aplicación en la extracción de productos naturales", Solventes alternativos para la extracción de productos naturales , Berlín, Heidelberg: Springer Berlin Heidelberg, págs. 253–268, doi :10.1007/978-3-662-43628-8_12, ISBN 978-3-662-43627-1
- ^ "Zeon Corporation" (PDF) . Archivado desde el original (PDF) el 22 de julio de 2011. Consultado el 5 de agosto de 2024 .
- ^ Huber, GW; Iborra, S; Corma, A (septiembre de 2006). "Síntesis de combustibles para el transporte a partir de biomasa: química, catalizadores e ingeniería". Chem. Rev. 106 ( 9): 4044–98. doi :10.1021/cr068360d. PMID 16967928.referencia 306
- ^ Hoydonckx, ÉL; Van Rhijn, WM; Van Rhijn, W.; De Vos, DE; Jacobs, PA "Furfural y derivados". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a12_119.pub2. ISBN 978-3527306732.
- ^ "Alternativas a los disolventes más ecológicos: folleto" (PDF) . Sigmaaldrich.com . Consultado el 15 de febrero de 2010 .
- Huber, George W.; Iborra, Sara; Corma, Avelino (2006). "Síntesis de combustibles para el transporte a partir de biomasa: química, catalizadores e ingeniería". Chemical Reviews . 106 (9): 4044–4098. doi :10.1021/cr068360d. PMID 16967928.
Lectura adicional
- Zheng, Hong-Yan; Zhu, Yu-Lei; Teng, Bo-Tao; Bai, Zong-Qing; Zhang, Cheng-Hua; Xiang, Hong-Wei; Li, Yong-Wang (2006). "Hacia la comprensión de la vía de reacción en la hidrogenación en fase de vapor de furfural a 2-metilfurano". Revista de Catálisis Molecular A: Química . 246 (1–2): 18–23. doi :10.1016/j.molcata.2005.10.003.
- https://cms.chempoint.com/ChemPoint/media/ChemPointSiteMedia/Emails/MeTHF-System-Advantages-in-Organometallic-Chemistry-and-Biphasic-Reactions.pdf