1,1,1-Tricloroetano
| |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido 1,1,1-Tricloroetano | |||
| Otros nombres 1,1,1-TCA, metilcloroformo, cloroteno, disolvente 111, R-140a, Genklene, cloruro de monocloroetilideno (arcaico) | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.000.688 | ||
| Número CE |
| ||
| 82076 | |||
| |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 2831 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C2H3Cl3 o CH3CCl3 | |||
| Masa molar | 133,40 g/mol | ||
| Apariencia | Líquido incoloro | ||
| Olor | suave, similar al cloroformo [1] | ||
| Densidad | 1,32 g/ cm3 | ||
| Punto de fusión | -33 °C (-27 °F; 240 K) | ||
| Punto de ebullición | 74 °C (165 °F; 347 K) | ||
| 0,4% (20 °C) [1] 0,480 g/litro a 20 °C [2] | |||
| Presión de vapor | 100 mmHg (20 °C) [1] | ||
Índice de refracción ( n D ) | 1.437 [3] | ||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Impacto en la capa de ozono. Irritante para las vías respiratorias superiores. Provoca irritación grave e hinchazón en los ojos. | ||
| Etiquetado SGA : | |||
 | |||
| Advertencia | |||
| H332 , H420 | |||
| P261 , P271 , P304+P312 , P304+P340 , P312 , P502 | |||
| NFPA 704 (rombo cortafuegos) | |||
| Límites de explosividad | 7,5%-12,5% [1] | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 9600 mg/kg (oral, rata) 6000 mg/kg (oral, ratón) 5660 mg/kg (oral, conejo) [4] | ||
LC 50 ( concentración media ) | 3911 ppm (ratón, 2 horas) 18000 ppm (rata, 4 horas) [4] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 350 ppm (1900 mg/m3 ) [ 1] | ||
REL (recomendado) | C 350 ppm (1900 mg/m 3 ) [15 minutos] [1] | ||
IDLH (Peligro inmediato) | 700 ppm [1] | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El compuesto orgánico 1,1,1-tricloroetano , también conocido como metilcloroformo y cloroteno , es un cloroalcano con la fórmula química CH 3 CCl 3 . Es un isómero del 1,1,2-tricloroetano . Es un líquido incoloro y de olor dulce, que alguna vez se produjo industrialmente en grandes cantidades para su uso como disolvente . [5] Está regulado por el Protocolo de Montreal como una sustancia que agota la capa de ozono y, como tal, su uso ha disminuido desde 1996. El tricloroetano no debe confundirse con el tricloroeteno, que tiene un nombre similar y que también se usa comúnmente como disolvente.
Producción
El 1,1,1-tricloroetano fue descrito por primera vez por Henri Victor Regnault en 1840. Industrialmente, se produce generalmente en un proceso de dos pasos a partir de cloruro de vinilo . En el primer paso, el cloruro de vinilo reacciona con cloruro de hidrógeno a 20-50 °C para producir 1,1-dicloroetano :
- CH2 =CHCl + HCl → CH3CHCl2
Esta reacción es catalizada por una variedad de ácidos de Lewis , principalmente cloruro de aluminio , cloruro de hierro (III) o cloruro de cinc . El 1,1-dicloroetano se convierte luego en 1,1,1-tricloroetano por reacción con cloro bajo irradiación ultravioleta :
- CH3CHCl2 + Cl2 → CH3CCl3 + HCl
Esta reacción se lleva a cabo con un rendimiento del 80-90% y el subproducto cloruro de hidrógeno se puede reciclar en el primer paso del proceso. El principal subproducto es el compuesto relacionado 1,1,2-tricloroetano , del cual el 1,1,1-tricloroetano se puede separar por destilación .
Se produce una cantidad algo menor de 1,1,1-tricloroetano a partir de la reacción de 1,1-dicloroeteno y cloruro de hidrógeno en presencia de un catalizador de cloruro de hierro (III) :
- CH2 = CCl2 + HCl → CH3CCl3
El 1,1,1-tricloroetano se vende con estabilizadores porque es inestable con respecto a la deshidrocloración y ataca a algunos metales. Los estabilizadores comprenden hasta el 8% de la formulación, incluidos los depuradores de ácidos (epóxidos, aminas) y los complejantes .
Usos
El 1,1,1-tricloroetano es un excelente disolvente para muchos compuestos orgánicos y también uno de los hidrocarburos clorados menos tóxicos . Generalmente se considera no polar , pero debido a la buena polarizabilidad de los átomos de cloro, es un disolvente superior para compuestos orgánicos que no se disuelven bien en hidrocarburos como el hexano . Antes del Protocolo de Montreal, se usaba ampliamente para limpiar piezas metálicas y placas de circuitos , como disolvente fotorresistente en la industria electrónica , como propulsor de aerosoles , como aditivo de fluido de corte y como disolvente para tintas, pinturas, adhesivos y otros revestimientos. El 1,1,1-tricloroetano se usaba para limpiar en seco cuero y gamuza . [6] El 1,1,1-tricloroetano también se usa como fumigante insecticida .
También era el limpiador estándar para películas fotográficas (películas/diapositivas/negativos, etc.). Otros disolventes comúnmente disponibles dañan la emulsión y la base ( la acetona dañará gravemente la base de triacetato en la mayoría de las películas) y, por lo tanto, no son adecuados para esta aplicación. El reemplazo estándar, Forane 141, es mucho menos efectivo y tiende a dejar un residuo. El 1,1,1-tricloroetano se usaba como diluyente en productos líquidos correctores como el papel líquido . Muchas de sus aplicaciones usaban anteriormente tetracloruro de carbono (que fue prohibido en los productos de consumo de EE. UU. en 1970). A su vez, el propio 1,1,1-tricloroetano ahora está siendo reemplazado por otros disolventes en el laboratorio. [7]
Investigación anestésica
El 1,1,1-tricloroetano fue uno de los organoclorados volátiles que se probaron como alternativas al cloroformo en la anestesia. [8] En la década de 1880, se descubrió que era un sustituto seguro y fuerte del cloroformo [9] pero su producción era costosa y difícil. [10]
En 1880 se sugirió el uso del 1,1,1-tricloroetano como anestésico. Ese mismo año se lo denominó por primera vez "metilcloroformo". En aquel momento, los efectos narcóticos del hidrato de cloral se debían a una vía metabólica hipotética hacia el cloroformo en la "sangre alcalina". Se estudió el tricloroetano por su similitud estructural con el cloral y sus posibles efectos anestésicos. Sin embargo, el tricloroetano no mostró ninguna conversión a cloroformo en experimentos de laboratorio. El isómero 1,1,2-tricloroetano , que carecía de un grupo triclorometilo , mostró efectos anestésicos incluso más fuertes que el isómero 1,1,1. [11]
Seguridad
Aunque no es tan tóxico como muchos compuestos similares, el 1,1,1-tricloroetano inhalado o ingerido actúa como un depresor del sistema nervioso central y puede causar efectos similares a los de la intoxicación por etanol , incluidos mareos , confusión y, en concentraciones suficientemente altas, pérdida del conocimiento y muerte. [12] Se han reportado envenenamientos y enfermedades fatales relacionadas con la inhalación intencional de tricloroetano. [13] [14] [15] [16] La eliminación de la sustancia química del líquido corrector comenzó debido a la Proposición 65 que lo declaró peligroso y tóxico. [17] [18]
El contacto prolongado de la piel con el líquido puede provocar la eliminación de grasas de la piel , lo que produce irritación cutánea.
La Agencia Internacional para la Investigación sobre el Cáncer clasifica al 1,1,1-tricloroetano en el Grupo 2A como probable carcinógeno . [19]
Concentración atmosférica
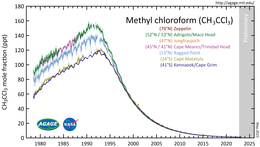

El 1,1,1-tricloroetano es un gas de efecto invernadero bastante potente , con un potencial de calentamiento global de 169 en 100 años en relación con el dióxido de carbono . [20] Sin embargo, esto es menos de una décima parte del tetracloruro de carbono (al que reemplazó como solvente) debido a su vida atmosférica relativamente corta de aproximadamente 5 años. [21]
El Protocolo de Montreal consideró al 1,1,1-tricloroetano como un compuesto responsable del agotamiento de la capa de ozono y prohibió su uso a partir de 1996. Desde entonces, su fabricación y uso se han eliminado gradualmente en la mayor parte del mundo y su concentración atmosférica ha disminuido sustancialmente. [21]
Referencias
- ^ abcdefg Guía de bolsillo del NIOSH sobre peligros químicos. "#0404". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "Programa Internacional de Seguridad Química, Criterios de Salud Ambiental 136". Organización Mundial de la Salud, Ginebra. 1990. Consultado el 25 de diciembre de 2017 .
- ^ Timmermans, Jean , Constantes fisicoquímicas de compuestos orgánicos puros (1950), pág. 242
- ^ ab "Metilcloroformo". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Manfred Rossberg, Wilhelm Lendle, Gerhard Pfleiderer, Adolf Tögel, Eberhard-Ludwig Dreher, Ernst Langer, Heinz Rassaerts, Peter Kleinschmidt, Heinz Strack, Richard Cook, Uwe Beck, Karl-August Lipper, Theodore R. Torkelson, Eckhard Löser, Klaus K. Beutel, Trevor Mann "Hidrocarburos clorados" en la Enciclopedia de química industrial de Ullmann 2006, Wiley-VCH, Weinheim. doi :10.1002/14356007.a06_233.pub2.
- ^ Morrison, R. D., Murphy, B. L. (2013). Disolventes clorados: una evaluación forense. Real Sociedad de Química del Reino Unido. Página 203
- ^ Uso de sustancias que dañan la capa de ozono en laboratorios. TemaNord 516/2003 Archivado el 27 de febrero de 2008 en Wayback Machine.
- ^ The American Practitioner 1881-01: Volumen 23, página 28
- ^ Metilcloroformo (1887) en Saint Louis Medical and Surgical Journal, página 121
- ^ Introducción a la terapéutica moderna (1892), Brunton, T. Lauder, página 122
- ^ Sobre dos nuevos anestésicos (1880), The American Journal of Pharmacy 1881-03: Vol 53, páginas 119-120
- ^ Perfil toxicológico del 1,1,1-tricloroetano Archivado el 9 de mayo de 2008 en Wayback Machine , Agencia para Sustancias Tóxicas y el Registro de Enfermedades (ATSDR). 2006
- ^ King, Gregory S.; Smialek, John E.; Troutman, William G. (15 de marzo de 1985). "Muerte súbita en adolescentes como resultado de la inhalación de líquido corrector para máquina de escribir". JAMA: The Journal of the American Medical Association . 253 (11): 1604–1606. doi :10.1001/jama.253.11.1604. PMID 3974043. Archivado desde el original el 23 de febrero de 2013 . Consultado el 5 de enero de 2010 .
Describimos cuatro casos de muerte súbita en adolescentes asociados con la inhalación recreativa de líquido corrector para máquina de escribir que ocurrieron durante el período de 1979 a mediados de 1984.
- ^ D'costa, DF; Gunasekera, NP (agosto de 1990). "Edema cerebral fatal tras el abuso de tricloroetano". Revista de la Royal Society of Medicine . 83 (8): 533–534. doi :10.1177/014107689008300823. PMC 1292788 . PMID 2231588.
- ^ Winekab, Charles L.; Wahba, Wagdy W.; Huston, Robert; Rozin, Leon (6 de junio de 1997). "Inhalación fatal de 1,1,1-tricloroetano". Forensic Science International . 87 (2): 161–165. doi :10.1016/S0379-0738(97)00040-6. PMID 9237378.
Un niño de 13 años fue encontrado muerto en el bosque después de la inhalación de 1,1,1-tricloroetano (TCE).
- ^ Wodka, Richard M.; Jeong, Erwin WS (1 de enero de 1989). "Cardiac Effects of Inhaled Typewriter Correction Fluid". Annals of Internal Medicine . 110 (1): 91–92. doi :10.7326/0003-4819-110-1-91_2. PMID 2908837. Archivado desde el original el 14 de abril de 2013. Consultado el 5 de enero de 2010 .
- ^ Paddock, Richard C. (29 de septiembre de 1989). «Gillette acepta eliminar los tóxicos de su corrector de papel». Los Angeles Times . Sacramento. Archivado desde el original el 15 de julio de 2012 . Consultado el 5 de enero de 2010 .
- ^ Estrin, Norman F.; Akerson, James M. (2000). "Proposición 65". Regulación de los cosméticos en un entorno competitivo . Nueva York, Nueva York: Marcel Dekker . pág. 138. ISBN. 0-8247-7516-3. Recuperado el 5 de enero de 2010.
Gillette aceptó reformular el producto para que no representara un riesgo que requiriera una advertencia de la Proposición 65.
- ^ IARC. 1,1,1-Tricloroetano y otras cuatro sustancias químicas industriales. ISBN 978-92-832-0197-7.
- ^ Hodnebrog Ø, Aamaas B, Fuglestvedt JS, Marston G, Myhre G, Nielsen CJ, Sandstad M, Shine KP, Wallington TJ (septiembre de 2020). "Potenciales de calentamiento global actualizados y eficiencias radiativas de halocarbonos y otros absorbentes atmosféricos débiles". Reseñas de Geofísica . 58 (3): e2019RG000691. Bibcode :2020RvGeo..5800691H. doi :10.1029/2019RG000691. PMC 7518032 . PMID 33015672.
- ^ ab "Capítulo 8, Cuadro 8.A.1". Informe de Evaluación del Cambio Climático 2013: Bases científicas físicas. pág. 733.
Lectura adicional
- Doherty, RE (2000). "Una historia de la producción y el uso de tetracloruro de carbono, tetracloroetileno, tricloroetileno y 1,1,1-tricloroetano en los Estados Unidos: Parte 2 - Tricloroetileno y 1,1,1-tricloroetano". Environmental Forensics . 1 (2): 83–93. Bibcode :2000EnvFo...1...83D. doi :10.1006/enfo.2000.0011. S2CID 97370778.