Antibiótico β-lactámico
| Antibiótico β-lactámico | |
|---|---|
| Clase de droga | |
 Estructura central de las penicilinas (arriba) y las cefalosporinas (abajo), los dos grupos más comunes de antibióticos β-lactámicos. Anillo β-lactámico en rojo. | |
| Identificadores de clase | |
| Usar | Infección bacteriana |
| Código ATC | J01C |
| Objetivo biológico | Proteína de unión a penicilina |
| Enlaces externos | |
| Malla | D047090 |
| Estatus legal | |
| En Wikidata | |
Los antibióticos β-lactámicos ( antibióticos beta -lactámicos ) son antibióticos que contienen un anillo β-lactámico en su estructura química. Esto incluye derivados de penicilina ( penams ), cefalosporinas y cefamicinas ( cefems ), monobactámicos , carbapenémicos [1] y carbacefems . [2] La mayoría de los antibióticos β-lactámicos funcionan inhibiendo la biosíntesis de la pared celular en el organismo bacteriano y son el grupo de antibióticos más utilizado. Hasta 2003, cuando se midió por ventas, más de la mitad de todos los antibióticos disponibles comercialmente en uso eran compuestos β-lactámicos. [3] El primer antibiótico β-lactámico descubierto, la penicilina , fue aislado de una cepa de Penicillium rubens (nombrada como Penicillium notatum en ese momento). [4] [5]
Las bacterias suelen desarrollar resistencia a los antibióticos β-lactámicos mediante la síntesis de una β-lactamasa , una enzima que ataca el anillo β-lactámico. Para superar esta resistencia, los antibióticos β-lactámicos pueden administrarse con inhibidores de la β-lactamasa , como el ácido clavulánico . [6]
Uso médico
Los antibióticos β-lactámicos están indicados para la prevención y el tratamiento de infecciones bacterianas causadas por organismos susceptibles. Al principio, los antibióticos β-lactámicos eran principalmente activos sólo contra bacterias grampositivas , pero el desarrollo reciente de antibióticos β-lactámicos de amplio espectro activos contra varios organismos gramnegativos ha aumentado su utilidad. [ cita requerida ]
En las meninges cerebrales no inflamadas (normales), la penetración de los antibióticos betalactámicos es baja, con una relación AUC LCR /AUC S de 0,15 (la relación del área bajo la curva del líquido cefalorraquídeo frente al área bajo la curva del suero). [7]
Efectos adversos
Reacciones adversas a medicamentos
Las reacciones adversas más comunes a los antibióticos β-lactámicos incluyen diarrea, náuseas, sarpullido, urticaria y superinfección (incluida candidiasis ). [8]
Los efectos adversos poco frecuentes incluyen fiebre, vómitos, eritema , dermatitis, angioedema y colitis pseudomembranosa . [8]
El dolor y la inflamación en el lugar de la inyección también son comunes en el caso de los antibióticos β-lactámicos administrados por vía parenteral . [ cita requerida ]
Alergia/hipersensibilidad
Las reacciones adversas inmunológicamente mediadas a cualquier antibiótico β-lactámico pueden ocurrir en hasta el 10% de los pacientes que reciben ese agente (una pequeña fracción de las cuales son verdaderamente reacciones alérgicas mediadas por IgE , ver erupción por amoxicilina ). La anafilaxia ocurrirá en aproximadamente el 0,01% de los pacientes. [8] [9] Quizás haya una sensibilidad cruzada del 5 al 10% entre los derivados de la penicilina, las cefalosporinas y los carbapenémicos; [ cita requerida ] pero esta cifra ha sido cuestionada por varios investigadores. [ ¿quién? ] [ cita requerida ]
Sin embargo, el riesgo de reactividad cruzada es suficiente para justificar la contraindicación de todos los antibióticos β-lactámicos en pacientes con antecedentes de reacciones alérgicas graves ( urticaria , anafilaxia, nefritis intersticial ) a cualquier antibiótico β-lactámico. En raras ocasiones, las reacciones alérgicas se han desencadenado por la exposición a través de besos y contacto sexual con una pareja que esté tomando estos antibióticos. [10]
Puede producirse una reacción de Jarisch-Herxheimer después del tratamiento inicial de una infección por espiroquetas , como la sífilis, con un antibiótico β-lactámico. [ cita requerida ]
Mecanismo de acción
Inhibición de la síntesis de la pared celular

Los antibióticos β-lactámicos son bactericidas y actúan inhibiendo la síntesis de la capa de peptidoglicano de las paredes celulares bacterianas . La capa de peptidoglicano es importante para la integridad estructural de la pared celular, [6] especialmente en organismos grampositivos , siendo el componente más externo y primario de la pared. El paso final de transpeptidación en la síntesis del peptidoglicano es facilitado por las DD -transpeptidasas , también conocidas como proteínas de unión a penicilina (PBP). Las PBP varían en su afinidad por la penicilina y otros antibióticos β-lactámicos. El número de PBP varía entre las especies bacterianas. [11]
Los antibióticos β-lactámicos son análogos de d -alanil- d -alanina, los residuos de aminoácidos terminales en las subunidades precursoras del péptido NAM/NAG de la capa naciente de peptidoglicano. La similitud estructural entre los antibióticos β-lactámicos y d -alanil- d -alanina facilita su unión al sitio activo de las PBP. El núcleo β-lactámico de la molécula se une irreversiblemente al residuo Ser 403 del sitio activo de las PBP ( acila ) . Esta inhibición irreversible de las PBP impide la reticulación final (transpeptidación) de la capa naciente de peptidoglicano, lo que altera la síntesis de la pared celular. [13] Los antibióticos β-lactámicos bloquean no sólo la división de bacterias, incluidas las cianobacterias , sino también la división de las cianelas, los orgánulos fotosintéticos de las glaucófitas , y la división de los cloroplastos de las briofitas . Por el contrario, no tienen efecto sobre los plástidos de las plantas vasculares altamente desarrolladas . Esto apoya la teoría endosimbiótica e indica una evolución de la división de plástidos en plantas terrestres. [14]
En circunstancias normales, los precursores de peptidoglicanos indican una reorganización de la pared celular bacteriana y, como consecuencia, desencadenan la activación de las hidrolasas autolíticas de la pared celular . La inhibición de la reticulación por las β-lactámicas provoca una acumulación de precursores de peptidoglicanos, lo que desencadena la digestión del peptidoglicano existente por las hidrolasas autolíticas sin la producción de nuevo peptidoglicano. Como resultado, la acción bactericida de los antibióticos β-lactámicos se potencia aún más. [ cita requerida ]
Oxidación de guanina
Otra posibilidad que se ha propuesto para explicar gran parte de la citotoxicidad de las β-lactáminas se centra en la oxidación del nucleótido de guanina en el conjunto de nucleótidos bacterianos. [15] La incorporación del nucleótido de guanina oxidado al ADN podría causar citotoxicidad. La citotoxicidad bacteriana podría surgir de la reparación incompleta de lesiones de 8-oxo-2'-desoxiguanosina muy espaciadas en el ADN, lo que da lugar a roturas de doble cadena. [15]
Potencia
Dos características estructurales de los antibióticos β-lactámicos se han correlacionado con su potencia antibiótica. [16] La primera se conoce como "parámetro de Woodward", h , y es la altura (en angstroms ) de la pirámide formada por el átomo de nitrógeno de la β-lactama como vértice y los tres átomos de carbono adyacentes como base. [17] El segundo se llama "parámetro de Cohen", c , y es la distancia entre el átomo de carbono del carboxilato y el átomo de oxígeno del carbonilo de la β-lactama . [18] Se cree que esta distancia corresponde a la distancia entre el sitio de unión del carboxilato y el agujero de oxianión de la enzima PBP. Los mejores antibióticos son aquellos con valores h más altos (más reactivos a la hidrólisis) y valores c más bajos (mejor unión a las PBP). [16]
Modos de resistencia
Por definición, todos los antibióticos β-lactámicos tienen un anillo β-lactámico en su estructura. La eficacia de estos antibióticos depende de su capacidad para alcanzar la PBP intacta y de su capacidad para unirse a ella. Por lo tanto, existen dos modos principales de resistencia bacteriana a los β-lactámicos: la hidrólisis enzimática del anillo β-lactámico y la posesión de proteínas de unión a la penicilina alteradas. [ cita requerida ]
Hidrólisis enzimática del anillo β-lactámico
Si la bacteria produce la enzima β-lactamasa o la enzima penicilinasa , la enzima hidrolizará el anillo β-lactámico del antibiótico, volviéndolo ineficaz. [19] (Un ejemplo de dicha enzima es la metalo-beta-lactamasa 1 de Nueva Delhi , descubierta en 2009). Los genes que codifican estas enzimas pueden estar presentes de manera inherente en el cromosoma bacteriano o pueden adquirirse mediante transferencia de plásmidos ( resistencia mediada por plásmidos ), y la expresión del gen β-lactamasa puede ser inducida por la exposición a β-lactáminas. [ cita requerida ]


La producción de una β-lactamasa por una bacteria no descarta necesariamente todas las opciones de tratamiento con antibióticos β-lactámicos. En algunos casos, los antibióticos β-lactámicos pueden administrarse conjuntamente con un inhibidor de la β-lactamasa . Por ejemplo, Augmentin (FGP) está hecho de amoxicilina (un antibiótico β-lactámico) y ácido clavulánico (un inhibidor de la β-lactamasa). El ácido clavulánico está diseñado para abrumar a todas las enzimas β-lactamasa y servir eficazmente como antagonista para que la amoxicilina no se vea afectada por las enzimas β-lactamasa. Otra combinación de β-lactámico/inhibidor de la β-lactamasa es piperacilina/tazobactam con un amplio espectro de actividad antibacteriana que incluye bacterias aeróbicas y anaeróbicas grampositivas y gramnegativas. La adición de tazobactam a la piperacilina ha mejorado su estabilidad frente a una amplia gama de enzimas β-lactamasas, incluidas algunas β-lactamasas de espectro extendido. [20]
Se están estudiando otros inhibidores de las β-lactamasas, como los ácidos borónicos, que se unen de forma irreversible al sitio activo de las β-lactamasas. Esto supone una ventaja con respecto al ácido clavulánico y a otros β-lactámas competidores similares, ya que no se pueden hidrolizar y, por lo tanto, se vuelven inútiles. Actualmente se están realizando investigaciones exhaustivas para desarrollar ácidos borónicos personalizados que actúen sobre diferentes isoenzimas de las β-lactamasas. [21]
Sin embargo, en todos los casos en los que se sospecha una infección por bacterias productoras de β-lactamasa, se debe considerar cuidadosamente la elección de un antibiótico β-lactámico adecuado antes del tratamiento. En particular, la elección de la terapia antibiótica β-lactámica adecuada es de suma importancia contra los organismos que albergan algún nivel de expresión de β-lactamasa. En este caso, no utilizar la terapia antibiótica β-lactámica más adecuada al inicio del tratamiento podría dar como resultado la selección de bacterias con niveles más altos de expresión de β-lactamasa, lo que dificultaría los esfuerzos posteriores con otros antibióticos β-lactámicos. [22]
En el contexto de la farmacología médica, las penicilinas, las cefalosporinas y los carbapenémicos, si bien todos tienen el anillo β-lactámico que sirve como estructura fundamental, también tienen un anillo auxiliar que lleva un grupo carboxilato que está ubicado en el mismo lado que el grupo carbonilo dentro del anillo β-lactámico y, como tal, esta configuración estructural es fundamental para su actividad antimicrobiana. [23] La resistencia bacteriana a estos antibióticos ocurre principalmente a través de la producción de β-lactamasas, enzimas que hidrolizan el enlace amida del anillo β-lactámico, eliminando así la actividad antimicrobiana de estos antibióticos. Este mecanismo de resistencia subraya la importancia de la integridad estructural del anillo β-lactámico para la función del antibiótico. [24] El cambio de color de incoloro o amarillo claro a ámbar o incluso rojo en una solución acuosa de un antibiótico β-lactámico puede denotar la hidrólisis de los enlaces amida en el anillo β-lactámico por parte de la β-lactamasa. [25] [26] Esto se observa a menudo con un sustrato cromogénico de β-lactamasa como ceftriaxona, merapenem o nitrocefina, [27] que sufre un cambio de color distintivo de amarillo a rojo a medida que la β-lactamasa hidroliza el enlace amida en el anillo β-lactámico. [27] [28] Este cambio de color es un indicador visual de la presencia y actividad de las enzimas β-lactamasas, que son responsables de conferir resistencia a los antibióticos β-lactámicos en muchas especies bacterianas. La hidrólisis del anillo β-lactámico por las enzimas β-lactamasa hace que el antibiótico sea ineficaz, lo que permite que las bacterias sobrevivan en presencia del antibiótico. [28] Se sabe que algunos antibióticos β-lactámicos como la ceftriaxona y el meropenem son relativamente inestables en solución, especialmente cuando se almacenan durante períodos prolongados, y se degradan en una solución acuosa incluso sin la presencia de β-lactamasa. [29] En el caso de la ceftriaxona, el color de las soluciones puede variar de amarillo claro a ámbar, dependiendo del tiempo de almacenamiento, la concentración y el diluyente utilizado. [30] [31] Un estudio encontró que las concentraciones de meropenem cayeron al 90% de la concentración inicial a las 7,4 horas a 22 °C y a las 5,7 horas a 33 °C, lo que indica una degradación con el tiempo. [29]
Posesión de proteínas de unión a penicilina alteradas
Como respuesta al uso de β-lactáminas para controlar las infecciones bacterianas, algunas bacterias han desarrollado proteínas de unión a penicilina con estructuras novedosas. Los antibióticos β-lactáminas no pueden unirse de manera tan efectiva a estas PBP alteradas y, como resultado, las β-lactáminas son menos efectivas para alterar la síntesis de la pared celular. Ejemplos notables de este modo de resistencia incluyen Staphylococcus aureus resistente a la meticilina ( MRSA ) [32] y Streptococcus pneumoniae resistente a la penicilina . Las PBP alteradas no descartan necesariamente todas las opciones de tratamiento con antibióticos β-lactáminas. [ cita médica necesaria ]
Nomenclatura

Las β-lactamas se clasifican según sus estructuras de anillo central. [33]
- β-Lactamas fusionadas a anillos saturados de cinco miembros:
- Las β-lactamas que contienen anillos de tiazolidina se denominan penams .
- Las β-lactamas que contienen anillos de pirrolidina se denominan carbapenamas .
- Las β-lactamas fusionadas a anillos de oxazolidina se denominan oxapenams o clavams .
- β-Lactamas fusionadas a anillos insaturados de cinco miembros:
- Las β-lactamas que contienen anillos de 2,3-dihidrotiazol se denominan penemas .
- Las β-lactamas que contienen anillos de 2,3-dihidro-1H- pirrol se denominan carbapenémicos .
- β-Lactamas fusionadas a anillos insaturados de seis miembros:
- Las β-lactamas que contienen anillos de 3,6-dihidro-2H-1,3- tiazina se denominan cefemas .
- Las β-lactamas que contienen anillos de piridina 1,2,3,4-tetrahidro se denominan carbacefemos .
- Las β-lactamas que contienen anillos de 3,6-dihidro-2H-1,3- oxazina se denominan oxacefemas .
- Las β-lactamas que no están fusionadas a ningún otro anillo se denominan monobactamas .
Por convención, las β-lactámas bicíclicas se numeran comenzando con la posición que ocupa el azufre en las penamas y cefemas, independientemente de qué átomo se encuentre en una clase dada. Es decir, la posición 1 siempre está adyacente al carbono β del anillo de la β-lactáma. La numeración continúa en el sentido de las agujas del reloj desde la posición uno hasta que se alcanza el carbono β de la β-lactáma, momento en el que la numeración continúa en sentido contrario a las agujas del reloj alrededor del anillo de la lactama para numerar los carbonos restantes. Por ejemplo, el átomo de nitrógeno de todas las β-lactámas bicíclicas fusionadas a anillos de cinco miembros se etiqueta como la posición 4, como en las penamas, mientras que en las cefemas, el nitrógeno es la posición 5. [ cita médica necesaria ]
La numeración de las monobactamas sigue la de la IUPAC : el átomo de nitrógeno está en la posición 1, el carbono carbonílico en la 2, el carbono α en la 3 y el carbono β en la 4. [ cita médica necesaria ]
Biosíntesis
Hasta la fecha, se han descubierto dos métodos distintos de biosíntesis del núcleo β-lactámico de esta familia de antibióticos. La primera vía descubierta fue la de los penams y los cefems. Esta vía comienza con una sintetasa de péptidos no ribosómicos (NRPS), la sintetasa ACV (ACVS), que genera el tripéptido lineal δ-( L -α-aminoadipyl) -L -cisteína- D -valina (ACV). La isopenicilina N sintasa (IPNS) cicla oxidativamente el ACV (dos ciclaciones por una sola enzima) al intermediario bicíclico isopenicilina N para formar la estructura del núcleo del penam. [34] Varias transamidaciones conducen a las diferentes penicilinas naturales.
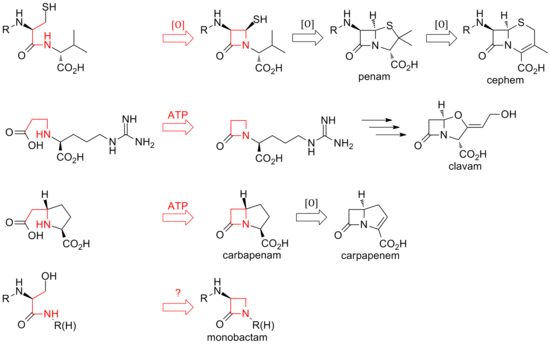
La biosíntesis de los cefemas se ramifica en la isopenicilina N mediante una expansión del anillo oxidativo hasta el núcleo del cefema. Al igual que con los penams, la variedad de cefalosporinas y cefamicinas proviene de diferentes transamidaciones, como es el caso de las penicilinas. [ cita requerida ]
Mientras que el cierre del anillo en los penams y cefems está entre las posiciones 1 y 4 de la β-lactama y es oxidativo, los clavams y carbapenems tienen sus anillos cerrados entre las posiciones 1 y 2 del anillo. Las β-lactamas sintetasas son responsables de estas ciclizaciones, y el carboxilato de los sustratos de anillo abierto es activado por ATP . [35] En los clavams, la β-lactama se forma antes del segundo anillo; en los carbapenems, el anillo de β-lactama se cierra en segundo lugar en secuencia. [ cita requerida ]
La biosíntesis del anillo β-lactámico de la tabtoxina refleja la de los clavams y los carbapenémicos. El cierre del anillo lactámico en los otros monobactámicos, como la sulfazecina y las nocardicinas, puede implicar un tercer mecanismo que implica la inversión de la configuración en el carbono β. [36]
Véase también
- Lista de antibióticos β-lactámicos
- Código ATC J01C Antibacterianos betalactámicos, penicilinas
- Código ATC J01D Otros antibacterianos betalactámicos
- Bacteria
- Pared celular
- Descubrimiento y desarrollo de las cefalosporinas
- Historia de la penicilina
- Nitrocefina
Referencias
- ^ Holten KB, Onusko EM (agosto de 2000). «Prescripción adecuada de antibióticos betalactámicos orales». American Family Physician . 62 (3): 611–20. PMID 10950216. Archivado desde el original el 6 de junio de 2011. Consultado el 8 de noviembre de 2008 .
- ^ Yao, JDC, Moellering, RC Jr. (2007). "Agentes antibacterianos". En Murray, PR, et al. (eds.). Manual de microbiología clínica (novena edición). Washington DC: ASM Press.Citado en Medicamentos betalactámicos no penicilina: un marco de buenas prácticas de fabricación para prevenir la contaminación cruzada (informe). Departamento de Salud y Servicios Humanos de los EE. UU.; Administración de Alimentos y Medicamentos; Centro de Evaluación e Investigación de Medicamentos (CDER). Abril de 2013. Archivado desde el original el 13 de diciembre de 2019. Consultado el 27 de mayo de 2019 a través del sitio web de la FDA de los EE. UU.
- ^ Elander RP (2003). "Producción industrial de antibióticos β-lactámicos". Applied Microbiology and Biotechnology . 61 (5–6): 385–392. doi :10.1007/s00253-003-1274-y. PMID 12679848. S2CID 43996071.
- ^ Houbraken J, Frisvad JC, Samson RA (2011). "La cepa productora de penicilina de Fleming no es Penicillium chrysogenum sino P. rubens". Hongo IMA . 2 (1): 87–95. doi :10.5598/imafungus.2011.02.01.12. PMC 3317369 . PMID 22679592.
- ^ Pathak A, Nowell RW, Wilson CG, Ryan MJ, Barraclough TG (septiembre de 2020). "La genómica comparativa del aislado original de Penicillium de Alexander Fleming (IMI 15378) revela divergencia de secuencias de genes de síntesis de penicilina". Scientific Reports . 10 (1): Artículo 15705. Bibcode :2020NatSR..1015705P. doi :10.1038/s41598-020-72584-5. PMC 7515868 . PMID 32973216.
- ^ ab Pandey N, Cascella M (2020). «Antibióticos betalactámicos». StatPearls . PMID 31424895. Archivado desde el original el 15 de diciembre de 2020. Consultado el 5 de mayo de 2020 .
- ^ Nau R, Sörgel F, Eiffert H (octubre de 2010). "Penetración de fármacos a través de la barrera hematoencefálica/hematoencefálica para el tratamiento de infecciones del sistema nervioso central". Clinical Microbiology Reviews . 23 (4): 858–83. doi :10.1128/CMR.00007-10. PMC 2952976 . PMID 20930076.
- ^ abc Rossi S (ed.) (2004). Manual de medicamentos australianos 2004. Adelaida: Manual de medicamentos australianos . ISBN 0-9578521-4-2 .
- ^ Pichichero ME (abril de 2005). "Una revisión de la evidencia que respalda la recomendación de la Academia Estadounidense de Pediatría para la prescripción de antibióticos de cefalosporina para pacientes alérgicos a la penicilina". Pediatría . 115 (4): 1048–57. doi :10.1542/peds.2004-1276. PMID 15805383. S2CID 21246804.
- ^ Liccardi G, Caminati M, Senna G, Calzetta L, Rogliani P (octubre de 2017). «Anafilaxia y comportamiento íntimo». Current Opinion in Allergy and Clinical Immunology . 17 (5): 350–355. doi :10.1097/ACI.0000000000000386. ISSN 1473-6322. PMID 28742538. S2CID 13925217. Archivado desde el original el 25 de abril de 2023. Consultado el 27 de febrero de 2021 .
- ^ ab Miyachiro MM, Contreras-Martel C, Dessen A (2019). "Proteínas de unión a penicilina (PBPS) y complejos de elongación de la pared celular bacteriana". Complejos proteicos macromoleculares II: estructura y función . Bioquímica subcelular. Vol. 93. págs. 273–289. doi :10.1007/978-3-030-28151-9_8. ISBN . 978-3-030-28150-2. Número de identificación personal 31939154. Número de identificación personal 210814189.
- ^ Cushnie TP, O'Driscoll NH, Lamb AJ (2016). "Cambios morfológicos y ultraestructurales en células bacterianas como indicador del mecanismo de acción antibacteriano". Ciencias de la vida celular y molecular . 73 (23): 4471–4492. doi :10.1007/s00018-016-2302-2. hdl : 10059/2129 . PMC: 11108400. PMID : 27392605. S2CID: 2065821. Archivado desde el original el 7 de octubre de 2017. Consultado el 5 de mayo de 2020 .
- ^ Fisher JF, Meroueh SO, Mobashery S (2005). "Resistencia bacteriana a los antibióticos β-lactámicos: oportunismo convincente, oportunidad convincente". Chemical Reviews . 105 (2): 395–424. doi :10.1021/cr030102i. PMID 15700950.
- ^ Kasten B, Reski R (1 de enero de 1997). "Los antibióticos β-lactámicos inhiben la división del cloroplasto en un musgo ( Physcomitrella patens ) pero no en el tomate ( Lycopersicon esculentum )". Revista de fisiología vegetal . 150 (1): 137-140. Código Bib : 1997JP Phy.150..137K. doi :10.1016/S0176-1617(97)80193-9.
- ^ ab Foti JJ, Devadoss B, Winkler JA, Collins JJ, Walker GC (20 de abril de 2012). "La oxidación del conjunto de nucleótidos de guanina subyace a la muerte celular por antibióticos bactericidas". Science . 336 (6079): 315–319. Bibcode :2012Sci...336..315F. doi :10.1126/science.1219192. PMC 3357493 . PMID 22517853.
- ^ ab Nangia A, Biradha K, Desiraju GR (1996). "Correlación de la actividad biológica en antibióticos β-lactámicos con parámetros estructurales de Woodward y Cohen: un estudio de la base de datos de Cambridge". Journal of the Chemical Society, Perkin Transactions 2 (5): 943–953. doi :10.1039/p29960000943. ISSN 1364-5471.
- ^ Woodward RB (16 de mayo de 1980). "Penemas y sustancias relacionadas". Philosophical Transactions of the Royal Society of London B: Biological Sciences . 289 (1036): 239–250. Bibcode :1980RSPTB.289..239W. doi :10.1098/rstb.1980.0042. ISSN 0962-8436. PMID 6109320.
- ^ Cohen NC (1 de febrero de 1983). "Antibióticos beta-lactámicos: requisitos geométricos para actividades antibacterianas". Journal of Medicinal Chemistry . 26 (2): 259–264. doi :10.1021/jm00356a027. ISSN 0022-2623. PMID 6827544.
- ^ Drawz SM, Bonomo RA (2010). "Tres décadas de inhibidores de la β-lactamasa". Clinical Microbiology Reviews . 23 (1): 160–201. doi :10.1128/CMR.00037-09. PMC 2806661 . PMID 20065329.
- ^ Gin A, Dilay L, Karlowsky JA, Walkty A, Rubinstein E, Zhanel GG (junio de 2007). "Piperacilina-tazobactam: una combinación de β-lactámicos e inhibidores de β-lactamasas" . Revisión experta de terapias antiinfecciosas . 5 (3): 365–383. doi :10.1586/14787210.5.3.365. ISSN 1478-7210. PMID 17547502. S2CID 68837323.
- ^ Leonard DA, Bonomo RA, Powers RA (19 de noviembre de 2013). "β-Lactamasas de clase D: una reevaluación después de cinco décadas". Accounts of Chemical Research . 46 (11): 2407–2415. doi :10.1021/ar300327a. ISSN 0001-4842. PMC 4018812 . PMID 23902256.
- ^ Macdougall C (2011). "Más allá de susceptibles y resistentes Parte I: tratamiento de infecciones debidas a organismos gramnegativos con β-lactamasas inducibles". Revista de farmacología y terapéutica pediátrica . 16 (1): 23–30. doi :10.5863/1551-6776-16.1.23. PMC 3136230 . PMID 22477821.
- ^ Kim D, Kim S, Kwon Y, Kim Y, Park H, Kwak K, Lee H, Lee JH, Jang KM, Kim D, Lee SH, Kang LW (marzo de 2023). "Información estructural sobre antibióticos β-lactámicos". Biomol Ther (Seúl) . 31 (2): 141–147. doi :10.4062/biomolther.2023.008. PMC 9970833. PMID 36788654 .
- ^ Ahmadvand P, Avillan JJ, Lewis JA, Call DR, Kang C (mayo de 2022). "Caracterización de las interacciones entre CTX-M-15 y ácido clavulánico, desfuroilceftiofur, ceftiofur, ampicilina y nitrocefina". Int J Mol Sci . 23 (9): 5229. doi : 10.3390/ijms23095229 . PMC 9100253 . PMID 35563620.
- ^ "Copia archivada" (PDF) . Archivado (PDF) del original el 16 de febrero de 2022. Consultado el 22 de febrero de 2024 .
{{cite web}}: CS1 maint: copia archivada como título ( enlace ) - ^ Christenson JC, Korgenski EK (2008). "Diagnóstico de laboratorio de infecciones causadas por bacterias, hongos, parásitos y rickettsias". Principios y práctica de las enfermedades infecciosas pediátricas . WB Saunders. págs. 1341–1352. doi :10.1016/B978-0-7020-3468-8.50292-3. ISBN 978-0-7020-3468-8.
- ^ ab «Copia archivada». Archivado desde el original el 22 de febrero de 2024. Consultado el 22 de febrero de 2024 .
{{cite web}}: CS1 maint: copia archivada como título ( enlace ) - ^ ab Palzkill T (enero de 2013). "Estructura y función de la metalo-β-lactamasa". Ann NY Acad Ciencias . 1277 (1): 91-104. Código bibliográfico : 2013NYASA1277...91P. doi :10.1111/j.1749-6632.2012.06796.x. PMC 3970115 . PMID 23163348.
- ^ ab Fawaz S, Barton S, Whitney L, Swinden J, Nabhani-Gebara S (2019). "Estabilidad de meropenem después de la reconstitución para administración por infusión prolongada". Farmacia hospitalaria . 54 (3): 190–196. doi :10.1177/0018578718779009. PMC 6535930. PMID 31205331. Archivado desde el original el 27 de febrero de 2024. Consultado el 22 de febrero de 2024 .
- ^ "Ceftriaxona: prospecto". Archivado desde el original el 2 de abril de 2023.
- ^ https://web.archive.org/web/20240222172948/https://www.accessdata.fda.gov/drugsatfda_docs/label/2009/0550585s063lbl.pdf [ URL básica PDF ]
- ^ Ubukata K, Nonoguchi R, Matsuhashi M, Konno M (1989). "Expresión e inducibilidad en Staphylococcus aureus del gen mecA, que codifica una proteína de unión a penicilina específica de S. aureus resistente a meticilina". Revista de Bacteriología . 171 (5): 2882–5. doi :10.1128/jb.171.5.2882-2885.1989. PMC 209980 . PMID 2708325.
- ^ Dalhoff A, Janjic N, Echols R (2006). "Redefiniendo los penemas". Farmacología bioquímica . 71 (7): 1085–1095. doi :10.1016/j.bcp.2005.12.003. PMID 16413506.
- ^ Lundberg M, Siegbahn PE, Morokuma K (2008). "El mecanismo de la isopenicilina N sintasa a partir del modelado funcional de la densidad destaca las similitudes con otras enzimas de la familia 2-His-1-carboxilato". Bioquímica . 47 (3): 1031–1042. doi :10.1021/bi701577q. PMID 18163649. Archivado desde el original el 22 de septiembre de 2017 . Consultado el 28 de octubre de 2017 .
- ^ Bachmann BO, Li R, Townsend CA (1998). "β-lactama sintetasa: una nueva enzima biosintética". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 95 (16): 9082–9086. Bibcode :1998PNAS...95.9082B. doi : 10.1073/pnas.95.16.9082 . PMC 21295 . PMID 9689037.
- ^ Townsend CA, Brown AM, Nguyen LT (1983). "Nocardicina A: estudios estereoquímicos y biomiméticos de la formación de β-lactamas monocíclicas". Revista de la Sociedad Química Americana . 105 (4): 919–927. doi :10.1021/ja00342a047.