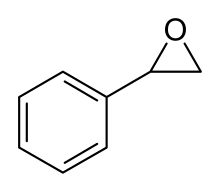
Óxido de estireno
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Feniloxirano | |
| Otros nombres Epoxiestireno; Óxido de estirilo; Óxido de feniletileno | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 108582 | |
| EBICh | |
| Araña química |
|
| Tarjeta informativa de la ECHA | 100.002.252 |
| Número CE |
|
| 50213 | |
| BARRIL | |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 2810 3082 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C8H8O | |
| Masa molar | 120,151 g·mol −1 |
| Apariencia | Líquido incoloro a amarillo claro. |
| Densidad | 1,052 g/ml |
| Punto de fusión | -37 °C (-35 °F; 236 K) |
| Punto de ebullición | 194 °C (381 °F; 467 K) |
| Peligros | |
| Etiquetado SGA : | |
  | |
| Peligro | |
| H312 , H319 , H350 | |
| P201 , P202 , P264 , P280 , P281 , P302+P352 , P305+P351+P338 , P308+P313 , P312 , P322 , P337+P313 , P363 , P405 , P501 | |
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad de la Universidad de Oxford |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El óxido de estireno es un epóxido derivado del estireno . Se puede preparar por epoxidación del estireno con ácido peroxibenzoico , en la reacción de Prilezhaev : [1]
El óxido de estireno es ligeramente soluble en agua. Una pequeña cantidad de ácido en el agua provoca la hidrólisis a feniletilenglicol racémico a través de un catión bencílico. Si la cantidad de agua no es suficiente, se producirá una isomerización catalizada por ácido para el fenilacetaldehído . [2]
El óxido de estireno en el cuerpo se metaboliza a ácido mandélico , ácido fenilglioxílico , ácido benzoico y ácido hipúrico .
La hidrogenación del óxido de estireno produce alcohol fenetílico . [3]
Reacciones estereoespecíficas
Como el óxido de estireno tiene un centro quiral en el átomo de carbono bencílico, existen óxido de estireno ( R ) y óxido de estireno ( S ). Si se utiliza un reactivo ópticamente puro, solo se obtendrá un compuesto ópticamente puro.
Toxicología
El óxido de estireno es un metabolito principal del estireno en humanos o animales, resultante de la oxidación por el citocromo P450 . Se considera que es posiblemente cancerígeno si se administran cantidades significativas por sonda a ratones y ratas. [4] El óxido de estireno se hidroliza posteriormente in vivo a estireno glicol por la epóxido hidrolasa . [5]
El óxido de estireno tiene un centro quiral y, por lo tanto, dos enantiómeros . Se ha informado que los dos enantiómeros tenían diferente toxicocinética y toxicidad [ cita requerida ] . Se informó que el óxido de ( R )-estireno se formó preferentemente en ratones, especialmente en el pulmón, mientras que el óxido de ( S )-estireno se generó preferentemente en ratas. En voluntarios humanos, la excreción acumulada del enantiómero ( S ) de estirenglicol y ácido mandélico fue mayor que la forma R después de la exposición al estireno. En microsomas hepáticos humanos, la oxidación del estireno mediada por el citocromo P450 mostró la producción de más enantiómero S en relación con el enantiómero R. También se encontró que el óxido de ( S )-estireno se hidrolizó preferentemente que el enantiómero R en microsomas hepáticos humanos. Estudios en animales han demostrado que el enantiómero ( R ) del óxido de estireno era más tóxico que el enantiómero ( S ) en ratones.
Referencias
- ^ Harold Hibbert y Pauline Burt (1941). "Óxido de estireno". Síntesis orgánicas; Volúmenes recopilados , vol. 1, pág. 494.
- ^ Verfahren zur Herstellung von Phenylacetaldehyde, patente BASF DE3546372A1 vom 2, julio de 1987
- ^ Fahlbusch, Karl-Georg; Hammerschmidt, Franz-Josef; Panten, Johannes; Pickenhagen, Wilhelm; Schatkowski, Dietmar; Bauer, Kurt; Garbe, Dorotea; Surburg, Horst (2003). "Sabores y Fragancias". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a11_141. ISBN 978-3-527-30673-2.
- ^ Evaluación de óxido de estireno de la EPA
- ^ Kenneth C. Liebman (1975). "Metabolismo y toxicidad del estireno" (PDF) . Environmental Health Perspectives . 11 : 115–119. doi :10.2307/3428333. JSTOR 3428333. PMC 1475194. PMID 809262 . [ enlace muerto permanente ]



