Ovocito
| Ovocito | |
|---|---|
| Identificadores | |
| Malla | D009865 |
| FMA | 18644 |
| Terminología anatómica [editar en Wikidata] | |
Un ovocito ( Reino Unido : / ˈoʊəsaɪt / , Estados Unidos : / ˈoʊoʊ- / ), oocito u ovocito es un gametocito femenino o célula germinal involucrada en la reproducción . En otras palabras , es un óvulo inmaduro . Un ovocito se produce en un feto femenino en el ovario durante la gametogénesis femenina . Las células germinales femeninas producen una célula germinal primordial (PGC), que luego experimenta mitosis , formando ovogonias . Durante la ovogénesis , las ovogonias se convierten en ovocitos primarios. Un ovocito es una forma de material genético que se puede recolectar para crioconservación .
Formación
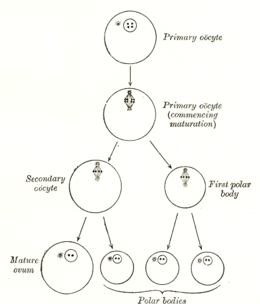
La formación de un ovocito se llama ovocitogénesis, que es una parte de la ovogénesis. [1] La ovogénesis da como resultado la formación de ovocitos primarios durante el período fetal y de ovocitos secundarios después de este como parte de la ovulación .
| Tipo de célula | ploidía / cromosomas | cromátidas | Proceso | Hora de finalización |
|---|---|---|---|---|
| Oogonio | diploide/46(2N) | 2C | Oocitogénesis ( mitosis ) | tercer trimestre |
| ovocito primario | diploide/46(2N) | 4C | Ootidogénesis ( meiosis I) ( foliculogénesis ) | Dictado en profase I hasta 50 años |
| ovocito secundario | haploide/23(1N) | 2C | Ootidogénesis ( meiosis II) | Detenido en metafase II hasta la fecundación |
| Ootídeo | haploide/23(1N) | 1C | Ootidogénesis ( meiosis II) | Minutos después de la fecundación |
| Óvulo | haploide/23(1N) | 1C |
Características
Citoplasma
Los ovocitos son ricos en citoplasma , que contiene gránulos de vitelo para nutrir la célula en las primeras etapas del desarrollo.
Núcleo
Durante la etapa primaria de ovocito de la ovogénesis, el núcleo se denomina vesícula germinal. [2]
El único tipo humano normal de ovocito secundario tiene el cromosoma 23 (sexual) como 23,X (determinante femenino), mientras que el espermatozoide puede tener 23,X (determinante femenino) o 23,Y (determinante masculino).
Nido
El espacio dentro de un óvulo o de un óvulo inmaduro se encuentra en el nido celular . [3]
Complejo cúmulo-ovocito
El complejo cúmulo-ovocito contiene capas de células del cúmulo muy compactas que rodean al ovocito en el folículo de De Graaf. El ovocito se detiene en la meiosis II en la etapa de metafase II y se considera un ovocito secundario. Antes de la ovulación, el complejo cúmulo pasa por un cambio estructural conocido como expansión del cúmulo. Las células de la granulosa se transforman de una matriz mucoide compacta a una expandida. Muchos estudios muestran que la expansión del cúmulo es fundamental para la maduración del ovocito porque el complejo cúmulo es la comunicación directa del ovocito con el entorno del folículo en desarrollo. También desempeña un papel importante en la fertilización, aunque los mecanismos no se conocen por completo y son específicos de cada especie. [4] [5] [6]
Contribuciones maternas

Para que un ovocito sea fecundado y, en última instancia, crezca hasta convertirse en un organismo completamente funcional, debe ser capaz de regular múltiples procesos celulares y de desarrollo. El ovocito, una célula grande y compleja, debe ser capaz de dirigir el crecimiento del embrión y controlar las actividades celulares. Como el ovocito es un producto de la gametogénesis femenina , la contribución materna al ovocito y, en consecuencia, al óvulo recién fecundado, es enorme. Hay muchos tipos de moléculas que se suministran maternamente al ovocito, que dirigirán varias actividades dentro del cigoto en crecimiento .
Prevención de daños al ADN de la línea germinal
El ADN de una célula es vulnerable al efecto dañino de los radicales libres oxidativos producidos como subproductos del metabolismo celular. El daño del ADN que ocurre en los ovocitos, si no se repara, puede ser letal y dar como resultado una fecundidad reducida y la pérdida de progenie potencial. Los ovocitos son sustancialmente más grandes que la célula somática promedio y, por lo tanto, es necesaria una actividad metabólica considerable para su abastecimiento. Si esta actividad metabólica fuera realizada por la maquinaria metabólica del ovocito, el genoma del ovocito estaría expuesto a los subproductos oxidativos reactivos generados. Por lo tanto, parece que se desarrolló un proceso para evitar esta vulnerabilidad del ADN de la línea germinal. Se propuso que, para evitar daños al genoma del ADN de los ovocitos, el metabolismo que contribuye a la síntesis de gran parte de los constituyentes del ovocito se desplazó a otras células maternas que luego transfirieron estos constituyentes a los ovocitos. [7] [8] Por lo tanto, los ovocitos de muchos organismos están protegidos del daño oxidativo del ADN mientras almacenan una gran masa de sustancias para nutrir al cigoto en su crecimiento embrionario inicial.
ARNm y proteínas
Durante el crecimiento del ovocito, las células maternas suministran una variedad de ARN mensajeros transcritos por vía materna, o ARNm . Estos ARNm se pueden almacenar en complejos de ARNm (ribonucleoproteína mensajera) y traducirse en puntos temporales específicos, se pueden localizar dentro de una región específica del citoplasma o se pueden dispersar de forma homogénea dentro del citoplasma de todo el ovocito. [9] Las proteínas cargadas por vía materna también pueden estar localizadas o ser ubicuas en todo el citoplasma. Los productos traducidos de los ARNm y las proteínas cargadas tienen múltiples funciones; desde la regulación del "mantenimiento" celular, como la progresión del ciclo celular y el metabolismo celular, hasta la regulación de procesos de desarrollo como la fertilización , la activación de la transcripción cigótica y la formación de ejes corporales. [9] A continuación, se presentan algunos ejemplos de ARNm y proteínas heredados por vía materna que se encuentran en los ovocitos de la rana africana con garras .
| Nombre | Tipo de molécula materna | Localización | Función |
|---|---|---|---|
| Vegetales [10] | ARNm | Hemisferio vegetal | Factor de transcripción |
| Vg1 [11] | ARNm | Hemisferio vegetal | Factor de transcripción |
| XXBP-1 [12] | ARNm | No se sabe | Factor de transcripción |
| CREB [13] | Proteína | Ubicuo | Factor de transcripción |
| FoxH1 [14] | ARNm | Ubicuo | Factor de transcripción |
| pág. 53 [15] | Proteína | Ubicuo | Factor de transcripción |
| Izquierda/Derecha [16] | ARNm | Ubicuo | Factor de transcripción |
| FGF2 [17] | Proteína | Núcleo | No se sabe |
| FGF2, 4, 9 FGFR1 [16] | ARNm | No se sabe | Señalización de FGF |
| Ectodermina [18] | Proteína | Hemisferio animal | Ligasa de ubiquitina |
| PACE4 [19] | ARNm | Hemisferio vegetal | Proproteína convertasa |
| Coco [20] | Proteína | No se sabe | Inhibidor de BMP |
| Gastrulación torcida [16] | Proteína | No se sabe | Proteína de unión a BMP/Chordin |
| gordo [21] | ARNm | Hemisferio vegetal | Formación de células germinales y rotación cortical |

Mitocondrias
El ovocito recibe mitocondrias de las células maternas, que controlarán el metabolismo embrionario y los eventos apoptóticos. [9] La partición de las mitocondrias se lleva a cabo por un sistema de microtúbulos que localizará las mitocondrias en todo el ovocito. En ciertos organismos, como los mamíferos, las mitocondrias paternas traídas al ovocito por el espermatozoide se degradan mediante la unión de proteínas ubiquitinadas. La destrucción de las mitocondrias paternas asegura la herencia estrictamente materna de las mitocondrias y el ADN mitocondrial (ADNmt). [9]
Nucleolo
En los mamíferos, el nucléolo del ovocito se deriva únicamente de células maternas. [22] El nucléolo, una estructura que se encuentra dentro del núcleo, es el lugar donde se transcribe el ARNr y se ensambla en ribosomas. Si bien el nucléolo es denso e inactivo en un ovocito maduro, es necesario para el desarrollo adecuado del embrión. [22]
Ribosomas
Las células maternas también sintetizan y aportan un depósito de ribosomas que son necesarios para la traducción de proteínas antes de que se active el genoma cigótico . En los ovocitos de mamíferos, los ribosomas de origen materno y algunos ARNm se almacenan en una estructura llamada redes citoplasmáticas. Se ha observado que estas redes citoplasmáticas, una red de fibrillas, proteínas y ARN, aumentan en densidad a medida que disminuye el número de ribosomas dentro de un ovocito en crecimiento [23] y las mutaciones en ellas se han relacionado con la infertilidad. [24] [25]
Profase I arresto
Los mamíferos y las aves hembras nacen con todos los ovocitos necesarios para futuras ovulaciones, y estos ovocitos se detienen en la etapa de profase I de la meiosis . [26] En los humanos, por ejemplo, los ovocitos se forman entre tres y cuatro meses de gestación dentro del feto y, por lo tanto, están presentes al nacer. Durante esta etapa de detención de la profase I ( dictado ), que puede durar muchos años, hay cuatro copias del genoma en los ovocitos. La detención de los ovocitos en la etapa de cuatro copias del genoma parece proporcionar la redundancia informativa necesaria para reparar el daño en el ADN de la línea germinal . [26] El proceso de reparación utilizado probablemente implica la reparación recombinacional homóloga . [26] [27] [28] Los ovocitos detenidos en profase tienen una alta capacidad para la reparación eficiente de los daños en el ADN . [27] En particular, las roturas de doble cadena de ADN se pueden reparar durante el período de detención de la profase mediante la reparación recombinacional homóloga y mediante la unión de extremos no homólogos . [29] La capacidad de reparación del ADN parece ser un mecanismo clave de control de calidad en la línea germinal femenina y un determinante crítico de la fertilidad . [27]
Contribuciones paternas
El espermatozoide que fecunda un ovocito aportará su pronúcleo , la otra mitad del genoma cigótico . En algunas especies, el espermatozoide también aportará un centriolo , que ayudará a formar el centrosoma cigótico necesario para la primera división. Sin embargo, en algunas especies, como en el ratón, el centrosoma entero se adquiere por vía materna. [30] Actualmente se está investigando la posibilidad de que el espermatozoide realice otras contribuciones citoplasmáticas al embrión.
Durante la fecundación, el espermatozoide aporta tres partes esenciales al ovocito: (1) un factor de señalización o activación, que hace que el ovocito metabólicamente inactivo se active; (2) el genoma paterno haploide; (3) el centrosoma, que es responsable de mantener el sistema de microtúbulos. Véase anatomía del espermatozoide
Anormalidades
- No disyunción : una falla en la separación adecuada de los homólogos en la meiosis I, o la separación de las cromátidas hermanas en la meiosis II puede provocar aneuploidía , en la que el ovocito tiene un número incorrecto de cromosomas, por ejemplo, 22, X o 24, X. Esta es la causa de afecciones como el síndrome de Down y el síndrome de Edwards en humanos. Es más probable en la edad materna avanzada .
- Algunos ovocitos tienen núcleos múltiples , aunque se cree que nunca maduran.
Véase también
- Gránulo cortical
- Crioconservación de recursos genéticos animales
- Foliculogénesis
- Inhibidor de la maduración de ovocitos
- Cuerpo polar
- Ruptura de simetría y rotación cortical
- Anormalidades de los ovocitos
- Lista de los distintos tipos de células del cuerpo humano adulto
Referencias
- ^ respuestas.com
- ^ "Vesícula germinal". Artículos de biología, tutoriales y diccionario en línea . 2019-10-07 . Consultado el 2022-04-09 .
- ^ Grier HJ, Uribe MC, Parenti LR (abril de 2007). "Epitelio germinal, foliculogénesis y folículos postovulatorios en ovarios de trucha arco iris, Oncorhynchus mykiss (Walbaum, 1792) (Teleostei, protacanthopterygii, salmoniformes)". Revista de morfología . 268 (4): 293–310. doi :10.1002/jmor.10518. PMID 17309079. S2CID 23482731.
- ^ Yokoo M, Sato E (2004). "Interacciones del complejo cúmulo-ovocito durante la maduración del ovocito". Revista Internacional de Citología . 235 : 251–91. doi :10.1016/S0074-7696(04)35006-0. ISBN 978-0-12-364639-2. Número de identificación personal 15219785.
- ^ Tanghe S, Van Soom A, Nauwynck H, Coryn M, de Kruif A (marzo de 2002). "Minirevisión: Funciones del cúmulo oóforo durante la maduración, ovulación y fertilización de los ovocitos". Reproducción molecular y desarrollo . 61 (3): 414–24. doi :10.1002/mrd.10102. PMID 11835587. S2CID 5728551.
- ^ Huang Z, Wells D (octubre de 2010). "La relación entre el ovocito humano y las células del cúmulo: nuevos conocimientos a partir del transcriptoma de las células del cúmulo". Reproducción humana molecular . 16 (10): 715–25. doi : 10.1093/molehr/gaq031 . PMID 20435609.
- ^ Bernstein C (1993). "El sexo como respuesta al daño oxidativo del ADN. Capítulo 10". En Halliwell B, Aruoma OI (eds.). ADN y radicales libres . Gran Bretaña: Ellis Horwood Limited. págs. 204-205. ISBN 978-0-13-222035-4.
- ^ Bernstein C (1998). "El sexo como respuesta al daño oxidativo del ADN. Capítulo 4". En Aruoma OI, Halliwell B (eds.). ADN y radicales libres: técnicas, mecanismos y aplicaciones . Santa Lucía y Londres: OICA International. pp. 112–113. ISBN 976-8056169.
- ^ abcd Mtango NR, Potireddy S, Latham KE (2008). "Calidad de los ovocitos y control materno del desarrollo". Revista Internacional de Biología Celular y Molecular . 268 : 223–90. doi :10.1016/S1937-6448(08)00807-1. PMID 18703408.
- ^ Zhang J, King ML (diciembre de 1996). "El ARN VegT de Xenopus se localiza en la corteza vegetal durante la ovogénesis y codifica un nuevo factor de transcripción T-box involucrado en la formación de patrones mesodérmicos". Desarrollo . 122 (12): 4119–29. doi :10.1242/dev.122.12.4119. PMID 9012531. S2CID 28462527.
- ^ Heasman J, Wessely O, Langland R, Craig EJ, Kessler DS (diciembre de 2001). "La localización vegetal de los ARNm maternos se ve alterada por el agotamiento de VegT". Biología del desarrollo . 240 (2): 377–86. doi : 10.1006/dbio.2001.0495 . PMID 11784070.
- ^ Zhao H, Cao Y, Grunz H (mayo de 2003). "La proteína de unión a X-box 1 de Xenopus, un factor de transcripción de cremallera de leucina, está involucrada en la vía de señalización de BMP". Biología del desarrollo . 257 (2): 278–91. doi : 10.1016/s0012-1606(03)00069-1 . PMID 12729558.
- ^ Sundaram N, Tao Q, Wylie C, Heasman J (septiembre de 2003). "El papel del CREB materno en la embriogénesis temprana de Xenopus laevis". Biología del desarrollo . 261 (2): 337–52. doi : 10.1016/s0012-1606(03)00303-8 . PMID 14499645.
- ^ Kofron M, Puck H, Standley H, Wylie C, Old R, Whitman M, Heasman J (octubre de 2004). "Nuevos roles para FoxH1 en la modelización del embrión temprano". Desarrollo . 131 (20): 5065–78. doi : 10.1242/dev.01396 . PMID 15459100.
- ^ Takebayashi-Suzuki K, Funami J, Tokumori D, Saito A, Watabe T, Miyazono K, et al. (septiembre de 2003). "La interacción entre el supresor tumoral p53 y la señalización de TGF beta configura los ejes corporales embrionarios en Xenopus". Desarrollo . 130 (17): 3929–39. doi : 10.1242/dev.00615 . PMID 12874116.
- ^ abc Heasman J (febrero de 2006). "Determinantes maternos del destino de las células embrionarias". Seminarios en biología celular y del desarrollo . 17 (1): 93–8. doi :10.1016/j.semcdb.2005.11.005. PMID 16426874.
- ^ Song J, Slack JM (diciembre de 1994). "Expresión espacial y temporal del ARNm y la proteína del factor de crecimiento de fibroblastos básico (FGF-2) en el desarrollo temprano de Xenopus". Mecanismos del desarrollo . 48 (3): 141–51. doi :10.1016/0925-4773(94)90055-8. PMID 7893598. S2CID 20281053.
- ^ Dupont S, Zacchigna L, Cordenonsi M, Soligo S, Adorno M, Rugge M, Piccolo S (abril de 2005). "Especificación de la capa germinal y control del crecimiento celular mediante Ectodermin, una ubiquitina ligasa Smad4". Celúla . 121 (1): 87–99. doi : 10.1016/j.cell.2005.01.033 . hdl : 11577/2439217 . PMID 15820681. S2CID 16628152.
- ^ Birsoy B, Berg L, Williams PH, Smith JC, Wylie CC, Christian JL, Heasman J (febrero de 2005). "XPACE4 es una proproteína convertasa localizada necesaria para la inducción del mesodermo y la escisión de proteínas TGFbeta específicas en el desarrollo de Xenopus". Desarrollo . 132 (3): 591–602. doi : 10.1242/dev.01599 . PMID 15634697.
- ^ Bell E, Muñoz-Sanjuán I, Altmann CR, Vonica A, Brivanlou AH (abril de 2003). "Especificación y competencia del destino celular por Coco, un inhibidor materno de BMP, TGFbeta y Wnt". Desarrollo . 130 (7): 1381–9. doi : 10.1242/dev.00344 . PMID 12588853.
- ^ Chan AP, Kloc M, Larabell CA, LeGros M, Etkin LD (mayo de 2007). "El ARN fatvg localizado en la madre es necesario para la rotación cortical y la formación de células germinales". Mecanismos del desarrollo . 124 (5): 350–63. doi :10.1016/j.mod.2007.02.001. PMC 2435194 . PMID 17376659.
- ^ ab Ogushi S, Palmieri C, Fulka H, Saitou M, Miyano T, Fulka J (febrero de 2008). "El nucléolo materno es esencial para el desarrollo embrionario temprano en los mamíferos". Science . 319 (5863): 613–6. doi :10.1126/science.1151276. PMID 18239124. S2CID 7799743.
- ^ Yurttas P, Vitale AM, Fitzhenry RJ, Cohen-Gould L, Wu W, Gossen JA, Coonrod SA (agosto de 2008). "El papel de PADI6 y las redes citoplasmáticas en el almacenamiento ribosómico en ovocitos y el control de la traducción en el embrión de ratón temprano". Desarrollo . 135 (15): 2627–36. doi :10.1242/dev.016329. PMC 2708103 . PMID 18599511.
- ^ Jentoft, Ida MA; Bäuerlein, Felix JB; Bien, Luisa M.; Cooper, Benjamín H.; Petrovic, Arsen; Entonces, Chun; Penir, Sarah Mae; Politi, Antonio Z.; Horokhovskyi, Yehor; Takala, Iina; Eckel, Heike; Moltrecht, Rüdiger; Lenárt, Peter; Cavazza, Tommaso; Liepe, Juliane (noviembre de 2023). "Los ovocitos de mamíferos almacenan proteínas para el embrión temprano en redes citoplasmáticas". Celúla . 186 (24): 5308–5327.e25. doi : 10.1016/j.cell.2023.10.003 . PMID 37922900.
- ^ Vaidyanathan, Gayathri (2 de noviembre de 2023). "Nueva explicación de la infertilidad: los óvulos carecen de un misterioso 'enrejado'". Nature . doi :10.1038/d41586-023-03415-6. PMID 37919411. S2CID 264972543.
- ^ abc Mira A (septiembre de 1998). "¿Por qué se detiene la meiosis?". Journal of Theoretical Biology . 194 (2): 275–87. Bibcode :1998JThBi.194..275M. doi :10.1006/jtbi.1998.0761. PMID 9778439.
- ^ abc Stringer JM, Winship A, Zerafa N, Wakefield M, Hutt K (mayo de 2020). "Los ovocitos pueden reparar eficazmente las roturas de doble cadena del ADN para restaurar la integridad genética y proteger la salud de la descendencia". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 117 (21): 11513–11522. Bibcode :2020PNAS..11711513S. doi : 10.1073/pnas.2001124117 . PMC 7260990 . PMID 32381741.
- ^ He, Da-Jian; Wang, Lin; Zhang, Zhi-Bi; Guo, Kun; Li, Jing-Zheng; He, Xie-Chao; Cui, Qing-Hua; Zheng, Ping (18 de noviembre de 2018). "El gen materno Ooep puede participar en la reparación de roturas de doble cadena de ADN mediada por recombinación homóloga en ovocitos de ratón". Investigación zoológica . 39 (6): 387–395. doi :10.24272/j.issn.2095-8137.2018.067. PMC 6085769 . PMID 29955025.
- ^ Leem J, Lee C, Choi DY, Oh JS. Características distintivas de la respuesta al daño del ADN en ovocitos de mamíferos. Exp Mol Med. 14 de febrero de 2024. doi :10.1038/s12276-024-01178-2. Publicación electrónica antes de su impresión. PMID 38355825
- ^ Sutovsky P, Schatten G (2000). "Contribuciones paternas al cigoto de los mamíferos: fertilización después de la fusión espermatozoide-óvulo". Revista Internacional de Citología . 195 : 1–65. doi :10.1016/s0074-7696(08)62703-5. ISBN 978-0-12-364599-9. Número de identificación personal 10603574.
Fuentes
- Purves WK, Orians GH, Sadava D, Heller HC (2004). La vida: la ciencia de la biología (7.ª ed.). Freeman, WH & Company. Págs. 823–824. ISBN 978-0-7167-9856-9.
Enlaces externos
- Micrografía de un ovocito primario y un folículo de un mono.