Ovogénesis
| Ovogénesis | |
|---|---|
 La ovogénesis es el proceso de producción de óvulos que tiene lugar en los ovarios. | |
| Identificadores | |
| Malla | D009866 |
| ESO | E1.0.2.2.0.0.2 |
| Terminología anatómica [editar en Wikidata] | |
La ovogénesis ( /ˌoʊ.əˈdʒɛnɪsɪs/ ) u ovogénesis es la diferenciación del óvulo (célula huevo ) en una célula competente para desarrollarse aún más cuando es fecundada. [ 1] Se desarrolla a partir del ovocito primario por maduración. La ovogénesis se inicia en la etapa embrionaria .
Ovogénesis en mamíferos no humanos
En los mamíferos , la primera parte de la ovogénesis comienza en el epitelio germinal , lo que da lugar al desarrollo de los folículos ováricos , la unidad funcional del ovario .
La ovogénesis consta de varios subprocesos: ovocitogénesis , ootidogénesis y, por último, maduración para formar un óvulo (ovogénesis propiamente dicha). La foliculogénesis es un subproceso independiente que acompaña y respalda a los tres subprocesos ovogénicos.
| Tipo de célula | ploidía / cromosomas | cromátidas | Proceso | Hora de finalización |
|---|---|---|---|---|
| Oogonio | diploide/46(2N) | 2C | Oocitogénesis ( mitosis ) | Tercer trimestre |
| ovocito primario | diploide/46(2N) | 4C | Ootidogénesis ( meiosis I) ( foliculogénesis ) | Dictado en profase I por hasta 50 años |
| ovocito secundario | haploide/23(1N) | 2C | Ootidogénesis ( meiosis II) | Detenido en metafase II hasta la fecundación |
| Ootídeo | haploide/23(1N) | 1C | Ootidogénesis ( meiosis II) | Minutos después de la fecundación |
| Óvulo | haploide/23(1N) | 1C |
Oogonio —(Oocitogénesis)—> Ovocito primario —(Meiosis I)—> Primer cuerpo polar (desechado posteriormente) + Ovocito secundario —(Meiosis II)—> Segundo cuerpo polar (desechado posteriormente) + Óvulo
La meiosis de los ovocitos, importante para todos los ciclos de vida de los animales pero a diferencia de todos los demás casos de división celular animal, ocurre completamente sin la ayuda de los centrosomas coordinadores del huso . [2] [3]
La creación de oogonias
La creación de ovogonias tradicionalmente no pertenece a la ovogénesis propiamente dicha, sino, en cambio, al proceso común de gametogénesis , que, en el ser humano femenino, comienza con los procesos de foliculogénesis , ovocitogénesis y ootidogénesis . Las ovogonias entran en meiosis durante el desarrollo embrionario, convirtiéndose en ovocitos. La meiosis comienza con la replicación del ADN y el entrecruzamiento meiótico. Luego se detiene en la profase temprana.
Mantenimiento del arresto meiótico
Los ovocitos de mamíferos se mantienen en detención de la profase meiótica durante un tiempo muy prolongado: meses en ratones, años en humanos. Inicialmente, la detención se debe a la falta de suficientes proteínas del ciclo celular para permitir la progresión meiótica. Sin embargo, a medida que el ovocito crece, se sintetizan estas proteínas y la detención meiótica pasa a depender del AMP cíclico . [4] El ovocito genera el AMP cíclico mediante la adenilil ciclasa en la membrana del ovocito. La adenilil ciclasa se mantiene activa mediante un receptor acoplado a proteína G constitutivamente activo conocido como GPR3 y una proteína G, Gs, también presente en la membrana del ovocito. [5]
El mantenimiento del paro meiótico también depende de la presencia de un complejo multicapa de células, conocido como folículo, que rodea al ovocito. La extracción del ovocito del folículo hace que la meiosis progrese en el ovocito. [6] Las células que componen el folículo, conocidas como células de la granulosa, están conectadas entre sí por proteínas conocidas como uniones en hendidura, que permiten que pequeñas moléculas pasen entre las células. Las células de la granulosa producen una pequeña molécula, GMP cíclico , que se difunde en el ovocito a través de las uniones en hendidura. En el ovocito, el GMP cíclico evita la degradación del AMP cíclico por la fosfodiesterasa PDE3 y, por lo tanto, mantiene el paro meiótico. [7] El GMP cíclico es producido por la guanilil ciclasa NPR2. [8]
Reinicio de la meiosis y estimulación de la ovulación por la hormona luteinizante
A medida que los folículos crecen, adquieren receptores para la hormona luteinizante, una hormona hipofisaria que reinicia la meiosis en el ovocito y provoca la ovulación de un óvulo fertilizable. La hormona luteinizante actúa sobre los receptores en las capas externas de las células de la granulosa del folículo, lo que provoca una disminución del GMP cíclico en las células de la granulosa. [4] Debido a que las células de la granulosa y el ovocito están conectados por uniones en hendidura, el GMP cíclico también disminuye en el ovocito, lo que hace que se reanude la meiosis. [9] Luego, la meiosis pasa a la segunda metafase, donde se detiene nuevamente hasta la fertilización. La hormona luteinizante también estimula la expresión genética que conduce a la ovulación. [10]


Ovogénesis humana

Ovogénesis
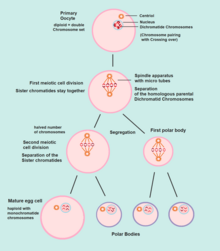
La ovogénesis comienza con el proceso de desarrollo de ovocitos primarios, que ocurre a través de la transformación de ovogonias en [ovocitos] primarios, un proceso llamado ovocitogénesis . [11] De una sola ovogonia, solo surgirá un ovocito maduro, junto con otras tres células llamadas cuerpos polares. La ovocitogénesis se completa antes o poco después del nacimiento.
Número de ovocitos primarios
Se cree comúnmente que, cuando se completa la ovocitogénesis, no se crean ovocitos primarios adicionales, en contraste con el proceso masculino de espermatogénesis, donde los gametocitos se crean continuamente. En otras palabras, los ovocitos primarios alcanzan su desarrollo máximo a las ~20 semanas de edad gestacional, cuando se han creado aproximadamente siete millones de ovocitos primarios; sin embargo, al nacer, este número ya se ha reducido a aproximadamente 1-2 millones por ovario. En la pubertad, el número de ovocitos disminuye aún más para alcanzar alrededor de 60.000 a 80.000 por ovario, y solo se producirán alrededor de 500 ovocitos maduros durante la vida de una mujer, los demás sufrirán atresia (degeneración). [12] Dos publicaciones han desafiado la creencia de que un número finito de ovocitos se establece alrededor del momento de la generación del nacimiento en los ovarios de mamíferos adultos por supuestas células germinales en la médula ósea y la sangre periférica. [13] [14] Se ha informado de la renovación de folículos ováricos a partir de células madre de la línea germinal (que se originan en la médula ósea y la sangre periférica) en el ovario de ratón posnatal. En cambio, las mediciones del reloj de ADN no indican que haya ovogénesis en curso durante la vida de las hembras humanas. [15] Por lo tanto, se requieren más experimentos para determinar la verdadera dinámica de la formación de folículos pequeños.
Ootidogénesis
La siguiente fase de la ootidogénesis ocurre cuando el ovocito primario se convierte en un ootido . Esto se logra mediante el proceso de meiosis. De hecho, un ovocito primario es, por definición biológica, una célula cuya función principal es dividirse mediante el proceso de meiosis. [16]
Sin embargo, aunque este proceso comienza en la edad prenatal, se detiene en la profase I. En la etapa final de la vida fetal, todos los ovocitos, aún los ovocitos primarios, se han detenido en esta etapa del desarrollo, llamada dictiato . Después de la menarquia , estas células continúan desarrollándose, aunque solo unas pocas lo hacen en cada ciclo menstrual .
Meiosis I
La meiosis I de la ootidogénesis comienza durante el desarrollo embrionario, pero se detiene en la etapa de diploteno de la profase I hasta la pubertad. El ovocito de ratón en la etapa de dictiato (diploteno prolongado) repara activamente el daño del ADN, mientras que la reparación del ADN no es detectable en las etapas de predictato ( leptoteno , zigoteno y paquiteno ) de la meiosis. [17] Sin embargo, para aquellos ovocitos primarios que continúan desarrollándose en cada ciclo menstrual, se produce sinapsis y se forman tétradas , lo que permite que se produzca el cruce cromosómico . Como resultado de la meiosis I, el ovocito primario ahora se ha desarrollado en el ovocito secundario .
Meiosis II
Inmediatamente después de la meiosis I, el ovocito secundario haploide inicia la meiosis II . Sin embargo, este proceso también se detiene en la etapa de metafase II hasta la fecundación , si es que alguna vez ocurre. Si el óvulo no es fecundado, se desintegra y se libera ( menstruación ) y el ovocito secundario no completa la meiosis II (y no se convierte en óvulo ). Cuando la meiosis II se ha completado, se han creado un oocito y otro cuerpo polar. El cuerpo polar es de tamaño pequeño.
Ciclo ovárico
El ciclo ovárico se divide en varias fases:
- Folículoogénesis : Sincrónicamente con la ootidogénesis, el folículo ovárico que rodea a la ootido se ha desarrollado de folículo primordial a preovulatorio. El folículo primario tarda cuatro meses en convertirse en preantral, dos meses en convertirse en antral y luego pasa a folículo maduro (Graaf). El folículo primario tiene células de revestimiento del ovocito que pasan de piso a cúbico y comienzan a proliferar, aumentando la actividad metabólica del ovocito y las células foliculares, que liberan glucoproteínas y ácidos proteoglicanos que formarán la zona pelúcida , que acompañan la instalación. En el folículo secundario preantral comienzan a formarse células de la teca interna y externa. La aromatasa , producida por las células foliculares, transforma los andrógenos producidos por la teca interna en estrógenos bajo la estimulación de la FSH. La LH estimula las células de la teca para que produzcan andrógenos. En el folículo antral existe un antro que contiene un líquido folicular, que contiene estrógenos, para permitir el paso del folículo antral al folículo de Graaf. El antro folicular desplaza al ovocito y se vuelve excéntrico; el ovocito está siempre rodeado por la zona pelúcida y por células foliculares que forman el cúmulo del oóforo. Las más internas se denominan células coronales radiadas. En esta etapa, el ovocito produce gránulos corticales que contienen glucoproteínas ácidas. [18]
- Selección de folículos dominantes: El folículo con más receptores de FSH será el más favorecido, induciendo simultáneamente la muerte de los demás folículos (3-10 folículos antrales que entran en esta fase cada mes). La baja concentración de estrógenos inhibirá la producción de FSH por parte de la glándula pituitaria con retroalimentación negativa, por lo que los folículos que queden atrás se acumularán en el antro folicular en lugar de los andrógenos.
- Folículo de Graaf: El estrógeno en otras concentraciones induce la liberación de LH, y el pico de LH se denomina pico de LH, que induce las etapas que conducirán a la explosión del folículo. Los receptores de LH también aparecen en las células foliculares, que estimulan al ovocito para que se convierta en un ovocito secundario, bloqueado en metafase, a la espera de la fertilización. La LH también estimula a las células del cúmulo oóforo para que liberen progesterona.
- Ovulación : ruptura del folículo, salida del ovocito con zona pelúcida y células coronales radiadas. La membrana que recubre el ovario se adelgaza en el lugar donde se rompe el folículo y las células adheridas a él emergen del estigma. El ovario se extrae de la trompa uterina, donde puede tener lugar la fecundación en la zona ampulada.
- Formación del cuerpo lúteo : A partir de las estructuras restantes del folículo se forma el cuerpo lúteo. Al principio se forma un coágulo, que luego es sustituido por tejido conectivo laxo; las células que forman cordones sólidos son las células foliculares y las células de la teca externa (células luteínicas de la teca) e interna ( células de la granulosa ). El cuerpo lúteo aumenta la concentración de progesterona, que la LH estimula constantemente. Si el óvulo no es fecundado, el cuerpo lúteo degenera (cuerpo albicans); si se implanta, permanece hasta los tres meses de embarazo, donde su función es sustituida por la placenta (producción de progesterona y estrógenos). El nivel de LH (necesario para mantener vivo el cuerpo lúteo) es sustituido por la gonadotropina coriónica humana . [19]
Ciclo uterino
El ciclo uterino [20] transcurre en paralelo al ciclo ovárico y es inducido por los estrógenos y la progesterona. El endometrio , formado por un epitelio cilíndrico monoestratificado, con glándulas uterinas (tubulares simples), conectivo con una capa superficial funcional (dividida en una capa esponjosa, una capa compacta y una capa basal más profunda, que siempre se mantiene), presenta cuatro fases:
- Fase proliferativa: Del día 5 al 14 del ciclo ovárico , está condicionada por los estrógenos . Se restaura la capa funcional del útero, con división mitótica de la capa basal.
- Fase secretora: del día 14 al 27 del ciclo ovárico, influida por la progesterona producida por el cuerpo lúteo . Las células se hipertrofian y las glándulas tubulares comienzan a producir glucógeno.
- Fase isquémica: inicio de la fase menstrual del día 27 al 28
- Fase regresiva o descamativa de 1 a 5 días, las arterias espiraladas sufren isquemia y se desprende la capa funcional.
Si, por el contrario, hay fecundación, la mucosa uterina se modifica para acomodar el óvulo fecundado y se mantiene la fase secreta.
Maduración hasta convertirse en óvulo
Ambos cuerpos polares se desintegran al final de la Meiosis II, dejando sólo el oótido, que luego eventualmente experimenta una maduración hasta convertirse en un óvulo maduro.
La función de formar cuerpos polares es descartar los conjuntos de cromosomas haploides adicionales que han resultado como consecuencia de la meiosis.
Maduración in vitro
La maduración in vitro ( MIV ) es una técnica que permite que los folículos ováricos maduren in vitro . Puede realizarse antes de una FIV . En estos casos, la hiperestimulación ovárica no es esencial. En cambio, los ovocitos pueden madurar fuera del cuerpo antes de la FIV. Por lo tanto, no es necesario inyectar gonadotropinas (o al menos una dosis menor de ellas) en el cuerpo. [21] Se han cultivado óvulos inmaduros hasta la maduración in vitro con una tasa de supervivencia del 10%, pero la técnica aún no está disponible clínicamente. [22] Con esta técnica, el tejido ovárico criopreservado podría usarse para producir ovocitos que puedan someterse directamente a la fertilización in vitro . [22]
Ovogénesis in vitro
Por definición, significa recapitular la ovogénesis de los mamíferos y producir ovocitos fertilizables in vitro. Es un proceso complejo que involucra varios tipos de células diferentes, interacciones recíprocas precisas entre células foliculares y ovocito, una variedad de nutrientes y combinaciones de citocinas, y factores de crecimiento y hormonas precisos según la etapa de desarrollo. [23] En 2016, dos artículos publicados por Morohaku et al. y Hikabe et al. informaron procedimientos in vitro que parecen reproducir de manera eficiente estas condiciones, lo que permite la producción, completamente en un plato, de una cantidad relativamente grande de ovocitos que son fertilizables y capaces de dar lugar a crías viables en el ratón. Esta técnica puede beneficiarse principalmente en pacientes con cáncer, donde en la condición actual su tejido ovárico se criopreserva para la preservación de la fertilidad. Como alternativa al trasplante autólogo, el desarrollo de sistemas de cultivo que apoyan el desarrollo de ovocitos desde la etapa de folículo primordial representa una estrategia válida para restaurar la fertilidad. A lo largo del tiempo, se han realizado muchos estudios con el objetivo de optimizar las características de los sistemas de cultivo de tejido ovárico y para apoyar mejor las tres fases principales: 1) activación de los folículos primordiales; 2) aislamiento y cultivo de folículos preantrales en crecimiento; 3) extracción del entorno folicular y maduración de los complejos cumulus ovocito. Si bien se ha logrado el desarrollo completo in vitro de ovocitos en ratones, con la producción de crías vivas, el objetivo de obtener ovocitos de calidad suficiente para apoyar el desarrollo del embrión no se ha alcanzado por completo en mamíferos superiores a pesar de décadas de esfuerzo. [24]
Envejecimiento ovárico
Las proteínas BRCA1 y ATM se emplean en la reparación de la rotura de doble cadena de ADN durante la meiosis . Estas proteínas parecen tener un papel crítico en la resistencia al envejecimiento ovárico . [25] Sin embargo, la reparación recombinacional homóloga de las roturas de doble cadena de ADN mediada por BRCA1 y ATM se debilita con la edad en ovocitos de humanos y otras especies. [25] Las mujeres con mutaciones BRCA1 tienen menores reservas ováricas y experimentan una menopausia más temprana que las mujeres sin estas mutaciones. Incluso en mujeres sin mutaciones BRCA1 específicas, el envejecimiento ovárico está asociado con el agotamiento de las reservas ováricas que conducen a la menopausia, pero a un ritmo más lento que en aquellas con tales mutaciones. Dado que las mujeres premenopáusicas mayores normalmente tienen progenie normal, su capacidad para la reparación recombinacional meiótica parece ser suficiente para prevenir el deterioro de su línea germinal a pesar de la reducción de la reserva ovárica. En los seres humanos, los daños en el ADN pueden surgir en la línea germinal durante el período de décadas que va desde la ovocitogénesis temprana hasta la etapa de la meiosis en la que los cromosomas homólogos se aparean de manera efectiva ( etapa de dictiato ). Se ha sugerido que dichos daños en el ADN pueden eliminarse, en gran parte, mediante mecanismos que dependen del apareamiento de cromosomas, como la recombinación homóloga. [26]
Ovogénesis en no mamíferos

Algunas algas y oomicetos producen huevos en oogonias . En el alga parda Fucus , los cuatro óvulos sobreviven a la ovogénesis, lo que es una excepción a la regla de que, por lo general, solo un producto de la meiosis femenina sobrevive hasta la madurez.
En las plantas , la ovogénesis ocurre dentro del gametofito femenino a través de la mitosis . En muchas plantas, como las briofitas , los helechos y las gimnospermas , los óvulos se forman en los arquegonios . En las plantas con flores , el gametofito femenino se ha reducido a un saco embrionario de ocho células dentro del óvulo dentro del ovario de la flor. La ovogénesis ocurre dentro del saco embrionario y conduce a la formación de un solo óvulo por óvulo.
En los áscaris , el ovocito ni siquiera comienza la meiosis hasta que el espermatozoide lo toca, a diferencia de los mamíferos, donde la meiosis se completa en el ciclo estral .
En las moscas Drosophila hembra , la recombinación genética ocurre durante la meiosis . Esta recombinación está asociada con la formación de roturas de doble cadena de ADN y la reparación de estas roturas. [27] El proceso de reparación conduce a recombinantes cruzados , así como al menos tres veces más recombinantes no cruzados (por ejemplo, que surgen por conversión génica sin cruce). [27]
Véase también
- Anisogamia
- Arquegonio
- Evolución de la reproducción sexual
- Infertilidad femenina
- Sistema reproductor femenino
- Mitosis
- Oncofertilidad
- Oogonio
- Ovocito
- Origen y función de la meiosis
- Reproducción sexual
- Espermatogénesis
Referencias
Cho WK, Stern S, Biggers JD. 1974. Efecto inhibidor del AMPc dibutirílico en la maduración de ovocitos de ratón in vitro. J Exp Zool.187:383-386
- ^ Gilbert, Scott F. (1 de enero de 2000). "Ovogénesis". Sinauer Associates.
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ Szollosi D, Calarco P, Donahue RP (1972). "Ausencia de centriolos en el primer y segundo huso meiótico de ovocitos de ratón". J Cell Sci . 11 (2): 521–541. doi :10.1242/jcs.11.2.521. PMID 5076360.
- ^ Manandhar G, Schatten H, Sutovsky P (enero de 2005). "Reducción del centrosoma durante la gametogénesis y su importancia". Biol. Reprod . 72 (1): 2–13. doi : 10.1095/biolreprod.104.031245 . PMID: 15385423. S2CID : 37305534.
- ^ ab Jaffe, Laurinda A.; Egbert, Jeremy R. (10 de febrero de 2017). "Regulación de la meiosis de los ovocitos de mamíferos mediante comunicación intercelular dentro del folículo ovárico". Revisión anual de fisiología . 79 (1): 237–260. doi :10.1146/annurev-physiol-022516-034102. PMC 5305431 . PMID 27860834.
- ^ Mehlmann, Lisa M.; Saeki, Yoshinaga; Tanaka, Shigeru; Brennan, Thomas J.; Evsikov, Alexei V.; Péndola, Frank L.; Knowles, Bárbara B.; Eppig, John J.; Jaffe, Laurinda A. (10 de diciembre de 2004). "El receptor GPR3 ligado a G s mantiene la detención meiótica en ovocitos de mamíferos". Ciencia . 306 (5703): 1947-1950. Código Bib : 2004 Ciencia... 306.1947M. doi : 10.1126/ciencia.1103974. PMID 15591206. S2CID 37342089.
- ^ Edwards, RG (octubre de 1965). "Maduración in vitro de ovocitos de ratón, oveja, vaca, cerdo, mono Rhesus y humanos". Nature . 208 (5008): 349–351. Bibcode :1965Natur.208..349E. doi :10.1038/208349a0. PMID 4957259. S2CID 4285338.
- ^ Norris, Rachael P.; Ratzan, William J.; Freudzon, Marina; Mehlmann, Lisa M.; Krall, Judith; Movsesian, Matthew A.; Wang, Huanchen; Ke, Hengming; Nikolaev, Viacheslav O.; Jaffe, Laurinda A. (junio de 2009). "El GMP cíclico de las células somáticas circundantes regula el AMP cíclico y la meiosis en el ovocito de ratón". Desarrollo . 136 (11): 1869–1878. doi :10.1242/dev.035238. PMC 2680110 . PMID 19429786.
- ^ Zhang, Meijia; Su, You-Qiang; Sugiura, Koji; Xia, Guoliang; Eppig, John J. (15 de octubre de 2010). "El ligando de células de la granulosa NPPC y su receptor NPR2 mantienen la detención meiótica en ovocitos de ratón". Ciencia . 330 (6002): 366–369. Código Bib : 2010 Ciencia... 330.. 366Z. doi : 10.1126/ciencia.1193573. PMC 3056542 . PMID 20947764.
- ^ Shuhaibar, Leia C.; Egbert, Jeremy R.; Norris, Rachael P.; Lampe, Paul D.; Nikolaev, Viacheslav O.; Thunemann, Martín; Wen, Lai; Feil, Robert; Jaffe, Laurinda A. (16 de marzo de 2015). "La señalización intercelular mediante difusión cíclica de GMP a través de uniones comunicantes reinicia la meiosis en los folículos ováricos de ratón". Actas de la Academia Nacional de Ciencias . 112 (17): 5527–5532. Código Bib : 2015PNAS..112.5527S. doi : 10.1073/pnas.1423598112 . PMC 4418852 . PMID 25775542.
- ^ Richards, JoAnne S.; Ascoli, Mario (mayo de 2018). "Vías de señalización endocrina, paracrina y autocrina que regulan la ovulación". Tendencias en endocrinología y metabolismo . 29 (5): 313–325. doi :10.1016/j.tem.2018.02.012. PMID 29602523. S2CID 4491304.
- ^ NCBI - La saga de la línea germinal
- ^ Lobo RA (septiembre de 2003). "Envejecimiento ovárico temprano: una hipótesis. ¿Qué es el envejecimiento ovárico temprano?". Hum. Reprod . 18 (9): 1762–4. CiteSeerX 10.1.1.611.1482 . doi : 10.1093/humrep/deg377 . PMID 12923124.
- ^ Johnson J, Bagley J, Skaznik-Wikiel M, Lee HJ, Adams GB, Niikura Y, Tschudy KS, Tilly JC, Cortes ML, Forkert R, Spitzer T, Iacomini J, Scadden DT, Tilly JL (julio de 2005). "Generación de ovocitos en ovarios de mamíferos adultos por células germinales putativas en médula ósea y sangre periférica". Cell . 122 (2): 303–15. doi : 10.1016/j.cell.2005.06.031 . PMID 16051153.
- ^ Johnson J, Canning J, Kaneko T, Pru J, Tilly J (2004). "Células madre de la línea germinal y renovación folicular en el ovario de mamíferos postnatal". Nature . 428 (6979): 145–50. Bibcode :2004Natur.428..145J. doi :10.1038/nature02316. PMID 15014492. S2CID 1124530.
- ^ Forster P, Hohoff C, Dunkelmann B, Schürenkamp M, Pfeiffer H, Neuhuber F, Brinkmann B (2015). "Tasa elevada de mutación de la línea germinal en padres adolescentes". Proc R Soc B . 282 (1803): 20142898. doi :10.1098/rspb.2014.2898. PMC 4345458 . PMID 25694621.
- ^ "Biochem". Archivado desde el original el 15 de junio de 2010. Consultado el 18 de julio de 2007 .
- ^ Guli CL, Smyth DR (1988). "La reparación del ADN inducida por rayos UV no es detectable en ovocitos predispuestos del ratón". Mutat Res . 208 (2): 115–119. doi :10.1016/s0165-7992(98)90010-0. PMID 3380109.
- ^ Rimon-Dahari, Nitzan; Yerushalmi-Heinemann, Lia; Alyagor, Liat; Dekel, Nava (2016). "Foliculogénesis ovárica". Resultados y problemas en la diferenciación celular . 58 : 167-190. doi :10.1007/978-3-319-31973-5_7. ISBN 978-3-319-31971-1. ISSN 0080-1844. PMID 27300179.
- ^ Betz, Danielle; Fane, Kathleen (2024), "Gonadotropina coriónica humana", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 30422545 , consultado el 6 de abril de 2024
- ^ Thiyagarajan, Dhanalakshmi K.; Basit, Hajira; Jeanmonod, Rebecca (2024), "Fisiología, ciclo menstrual", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 29763196 , consultado el 6 de abril de 2024
- ^ "Vejledning om kunstig befrugtning 2006 (danés)" (PDF) . Archivado desde el original (PDF) el 9 de marzo de 2012 . Consultado el 29 de enero de 2011 .
- ^ desde
- McLaughlin, M; Albertini, DF; Wallace, WHB; Anderson, RA; Telfer, EE (2018). "Oocitos en metafase II de folículos unilaminares humanos cultivados en un sistema de cultivo de múltiples pasos". MHR: Ciencia básica de la medicina reproductiva . 24 (3): 135–142. doi : 10.1093/molehr/gay002 . hdl : 20.500.11820/55cbb793-3401-4172-80a9-44412ecdf216 . ISSN 1360-9947. PMID 29390119.
- Más comentarios en el artículo de BBC News : James Gallagher (9 de febrero de 2018). "Primeros óvulos humanos cultivados en laboratorio". BBC News .
- ^ Wang, Jun-Jie; Ge, Wei; Liu, Jing-Cai; Klinger, Francesca Gioia; Dyce, Paul W.; De Felici, Massimo; Shen, Wei (2017). "Ovogénesis completa in vitro: retrospectivas y perspectivas". Cell Death Differ . 24 (11): 1845–1852. doi :10.1038/cdd.2017.134. PMC 5635224 . PMID 28841213.
- ^ Fabbri, Raffaella; Zamboni, Chiara; Vicenti, Rossella; MacCiocca, María; Paradisi, Roberto; Seracchioli, Renato (2018). "Actualización sobre oogénesis in vitro". Minerva Ginecol . 70 (5): 588–608. doi :10.23736/S0026-4784.18.04273-9. PMID 29999288. S2CID 51622568.
- ^ ab Turan, Volkan; Oktay, Kutluk (2020). "Reparación de roturas de doble cadena de ADN mediada por ATM relacionadas con BRCA y envejecimiento ovárico". Actualización sobre reproducción humana . 26 (1): 43–57. doi :10.1093/humupd/dmz043. PMC 6935693 . PMID 31822904.
- ^ Bernstein, C. (1979). "¿Por qué los bebés son jóvenes? La meiosis puede prevenir el envejecimiento de la línea germinal". Perspectivas en biología y medicina . 22 (4): 539–544. doi :10.1353/pbm.1979.0041. PMID 573881. S2CID 38550472.
- ^ ab Mehrotra, S.; McKim, KS (24 de noviembre de 2006). "Análisis temporal de la formación y reparación de roturas de doble cadena de ADN meiótico en hembras de Drosophila". PLOS Genetics . 2 (11): e200. doi : 10.1371/journal.pgen.0020200 . PMC 1657055 . PMID 17166055.
- Bibliografía
- Manandhar G, Schatten H y Sutovsky P (2005). Reducción del centrosoma durante la gametogénesis y su importancia. Biol Reprod, 72(1)2-13.
Enlaces externos
- Fisiología reproductiva