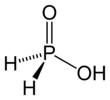
Ácido hipofosforoso
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Ácido fosfínico | |||
| Otros nombres Hidroxi(oxo) -λ 5 -fosfano Hidroxi- λ 5 -fosfanona | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.026.001 | ||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | ONU 3264 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| H3PO2 | |||
| Masa molar | 66,00 g/mol | ||
| Apariencia | cristales delicuescentes incoloros o líquido aceitoso | ||
| Densidad | 1,493 g/cm3 [ 2] 1,22 g/cm 3 (solución acuosa al 50 % en peso) | ||
| Punto de fusión | 26,5 °C (79,7 °F; 299,6 K) | ||
| Punto de ebullición | 130 °C (266 °F; 403 K) se descompone | ||
| miscible | |||
| Solubilidad | muy soluble en alcohol , éter | ||
| Acidez (p K a ) | 1.2 | ||
| Base conjugada | Fosfinato | ||
| Estructura | |||
| pseudotetraédrico | |||
| Peligros | |||
| punto de inflamabilidad | Ininflamable | ||
| Ficha de datos de seguridad (FDS) | J. T. Baker | ||
| Compuestos relacionados | |||
| Ácido fosforoso Ácido fosfórico | |||
Compuestos relacionados | Hipofosfito de sodio Hipofosfito de bario | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El ácido hipofosforoso ( HPA ), o ácido fosfínico , es un oxiácido de fósforo y un potente agente reductor con fórmula molecular H 3 PO 2 . Es un compuesto incoloro de bajo punto de fusión, que es soluble en agua, dioxano y alcoholes. La fórmula de este ácido se escribe generalmente H 3 PO 2 , pero una presentación más descriptiva es HOP(O)H 2 , lo que resalta su carácter monoprótico . Las sales derivadas de este ácido se denominan hipofosfitos . [3]
HOP(O)H 2 existe en equilibrio con el tautómero menor HP(OH) 2 . A veces, el tautómero menor se denomina ácido hipofosforoso y el tautómero mayor se denomina ácido fosfínico.
Preparación y disponibilidad
El ácido hipofosforoso fue preparado por primera vez en 1816 por el químico francés Pierre Louis Dulong (1785-1838). [4]
El ácido se prepara industrialmente mediante un proceso de dos pasos: en primer lugar, el fósforo blanco elemental reacciona con hidróxidos alcalinos y alcalinotérreos para dar una solución acuosa de hipofosfitos:
- P4 + 4OH− + 4H2O → 4H
2correos−
2+ 2H2
Los fosfitos producidos en este paso se pueden precipitar selectivamente mediante un tratamiento con sales de calcio . El material purificado se trata luego con un ácido fuerte no oxidante (a menudo ácido sulfúrico ) para dar el ácido hipofosforoso libre:
- yo
2correos−
2+ H + → H3PO2
El HPA se suministra generalmente como una solución acuosa al 50%. El ácido anhidro no se puede obtener por simple evaporación del agua, ya que el ácido se oxida fácilmente a ácido fosforoso y ácido fosfórico y también se desproporciona a ácido fosforoso y fosfina . El ácido hipofosforoso anhidro puro se puede formar mediante la extracción continua de soluciones acuosas con éter dietílico . [5]
Propiedades
La molécula muestra un tautomería P(═O)H a P–OH similar al del ácido fosforoso ; la forma P(═O) es fuertemente favorecida. [6]
El HPA generalmente se suministra como una solución acuosa al 50% y el calentamiento a bajas temperaturas (hasta aproximadamente 90 °C) hace que reaccione con agua para formar ácido fosforoso y gas hidrógeno.
- H 3 PO 2 + H 2 O → H 3 PO 3 + H 2
El calentamiento por encima de 110 °C hace que el ácido hipofosforoso sufra una desproporción para dar ácido fosforoso y fosfina . [7]
- 3 H 3 PO 2 → 2 H 3 PO 3 + PH 3
Reacciones
Inorgánico
El ácido hipofosforoso puede reducir el óxido de cromo (III) a óxido de cromo (II):
- H3PO2 + 2Cr2O3 → 4CrO + H3PO4
Derivados inorgánicos
La mayoría de los complejos de hipofosfito-metal son inestables debido a la tendencia de los hipofosfitos a reducir los cationes metálicos y convertirlos en metal a granel. Se han caracterizado algunos ejemplos, [8] [9] incluida la importante sal de níquel [Ni(H 2 O) 6 ](H 2 PO 2 ) 2 . [10]
Estado químico de la Lista I de la DEA
Debido a que el ácido hipofosforoso puede reducir el yodo elemental para formar ácido yodhídrico , que es un reactivo eficaz para reducir la efedrina o pseudoefedrina a metanfetamina , [11] la Administración de Control de Drogas de los Estados Unidos designó al ácido hipofosforoso (y sus sales) como un precursor químico de la Lista I a partir del 16 de noviembre de 2001. [12] En consecuencia, los manipuladores de ácido hipofosforoso o sus sales en los Estados Unidos están sujetos a estrictos controles regulatorios que incluyen registro, mantenimiento de registros, informes y requisitos de importación/exportación de conformidad con la Ley de Sustancias Controladas y 21 CFR §§ 1309 y 1310. [12] [13] [14]
Orgánico
En química orgánica, el H 3 PO 2 se puede utilizar para la reducción de sales de arenediazonio , convirtiendo ArN+
2a Ar–H. [15] [16] [17] Cuando se diazota en una solución concentrada de ácido hipofosforoso, se puede eliminar un sustituyente amina de los arenos.
Debido a su capacidad de funcionar como agente reductor suave y eliminador de oxígeno, a veces se utiliza como aditivo en reacciones de esterificación de Fischer , donde evita la formación de impurezas coloreadas.
Se utiliza para preparar derivados del ácido fosfínico. [18]
Aplicaciones
El ácido hipofosforoso (y sus sales) se utilizan para reducir las sales metálicas a metales a granel. Es eficaz para varios iones de metales de transición (es decir, los de: Co, Cu, Ag, Mn, Pt) pero se utiliza más comúnmente para reducir el níquel . [19] Esto forma la base del niquelado electrolítico (Ni–P), que es la aplicación industrial más grande de los hipofosfitos. Para esta aplicación se utiliza principalmente como sal ( hipofosfito de sodio ). [20]
Fuentes
- Algodón, F. Albert ; Wilkinson, Geoffrey ; Murillo, Carlos A.; Bochmann, Manfred (1999), Química inorgánica avanzada (6.ª ed.), Nueva York: Wiley-Interscience, ISBN 0-471-19957-5
- Listado de ChemicalLand21
- Corbridge, DEC (1995). Fósforo: un resumen de su química, bioquímica y tecnología (5.ª ed.). Ámsterdam: Elsevier. ISBN 0-444-89307-5.
- Popik, VV; Wright, AG; Khan, TA; Murphy, JA (2004). "Ácido hipofosforoso". En Paquette, L. (ed.). Enciclopedia de reactivos para síntesis orgánica . Nueva York: J. Wiley & Sons. doi :10.1002/047084289X. hdl :10261/236866. ISBN . 978-0-471-93623-7.
- Rich, DW; Smith, MC (1971). Deposición electrolítica de níquel, cobalto y hierro . Poughkeepsie, NY: IBM Corporation.
Referencias
- ^ Petrucci, Ralph H. (2007). Química general (9.ª ed.). pág. 946.
- ^ Pradyot Patnaik. Manual de productos químicos inorgánicos . McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ Dulong preparó ácido hipofosforoso añadiendo fosfuro de bario (Ba 3 P 2 ) al agua, lo que produjo gas fosfina (PH 3 ), fosfato de bario e hipofosfito de bario. Como el gas fosfina abandonó la solución y el fosfato de bario precipitó, solo el hipofosfito de bario permaneció en solución. El ácido hipofosforoso se pudo obtener a partir del filtrado añadiendo ácido sulfúrico, que precipitó el sulfato de bario, dejando el ácido hipofosforoso en solución. Véase:
- Dulong (1816) "Extrait d'un mémoire sur les combinaisons du phosphore avec l'oxigène" (Extracto de una memoria sobre los compuestos del fósforo con oxígeno), Annales de Chimie et de Physique , 2 : 141-150. [en francés]
- Graham, Thomas, Elementos de química inorgánica , 2.ª ed. (Filadelfia, Pensilvania: Blanchard y Lea, 1858), pág. 316.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 513. ISBN 978-0-08-037941-8.
- ^ Janesko, Benjamin G.; Fisher, Henry C.; Bridle, Mark J.; Montchamp, Jean-Luc (29 de septiembre de 2015). "Tautomería de P(═O)H a P–OH: un estudio teórico y experimental". Revista de química orgánica . 80 (20). Sociedad Química Estadounidense (ACS): 10025–10032. doi :10.1021/acs.joc.5b01618. ISSN 0022-3263.
- ^ Shechkov, GT; Pevneva, IA; Meshkova, OA (agosto de 2003). "Desproporción térmica del ácido hipofosforoso". Revista rusa de química aplicada . 76 (8): 1354–1355. doi :10.1023/B:RJAC.0000008318.22178.07. S2CID 96861842.
- ^ Kuratieva, Natalia V.; Naumova, Marina I.; Podberezskaya, Nina V.; Naumov, Dmitry Yu. (15 de febrero de 2005). "Los hipofosfitos metálicos bivalentes Sr(H 2 PO 2 ) 2 , Pb(H 2 PO 2 ) 2 y Ba(H 2 PO 2 ) 2". Acta Crystallographica Sección C Crystal Structure Communications . 61 (2): i14–i16. doi :10.1107/S010827010403166X. PMID 15695880.
- ^ Naumova, Marina I.; Kuratieva, Natalia V.; Podberezskaya, Nina V.; Naumov, Dmitri Yu. (15 de mayo de 2004). "Los hipofosfitos alcalinos KH 2 PO 2, RbH 2 PO 2 y CsH 2 PO 2". Acta Crystallographica Sección C Comunicaciones de estructuras cristalinas . 60 (5): i53-i55. doi :10.1107/S0108270104002409. PMID 15131359.
- ^ Kuratieva, Natalia V.; Naumova, Marina I.; Naumov, Dmitri Yu.; Podberezskaya, Nina V. (15 de enero de 2003). "Hexaaquanickel (II) bis (hipofosfito)". Acta Crystallographica Sección C Comunicaciones de estructuras cristalinas . 59 (1): i1-i3. doi :10.1107/S0108270102018541. PMID 12506208.
- ^ Gordon, PE; Fry, AJ; Hicks, LD (23 de agosto de 2005). "Estudios adicionales sobre la reducción de alcoholes bencílicos mediante ácido hipofosforoso/yodo" (PDF) . Arkivoc . 2005 (vi): 393–400. ISSN 1424-6376.
- ^ ab 66 FR 52670—52675. 17 de octubre de 2001.
- ^ "21 CFR 1309". Archivado desde el original el 3 de mayo de 2009. Consultado el 2 de mayo de 2007 .
- ^ 21 USC, Capítulo 13 (Ley de Sustancias Controladas)
- ^ William H. Brown; Brent L. Iverson; Eric Anslyn; Christopher S. Foote (2013). Química orgánica . Cengage Learning. pág. 1003. ISBN 978-1-133-95284-8.
- ^ Robison, MM; Robison, BL "Ácido 2,4,6-tribromobenzoico". Síntesis orgánicas . 36 : 94; Volúmenes recopilados , vol. 4.
- ^ Kornblum, N. (1941). "3,3′-Dimetoxibifenilo y 3,3′-Dimetilbifenilo". Organic Syntheses . 21 : 30. doi :10.15227/orgsyn.021.0030.
- ^ Karla Bravo-Altamirano; Jean-Luc Montchamp (2008). "Alilación deshidratativa catalizada por paladio del ácido hipofosforoso con alcoholes alílicos". Org. Synth . 85 : 96. doi : 10.15227/orgsyn.085.0096 .
- ^ Guyon, Carole; Métay, Estelle; Popowycz, Florence; Lemaire, Marc (2015). "Aplicaciones sintéticas de derivados de hipofosfito en la reducción". Química orgánica y biomolecular . 13 (29): 7879–7906. doi :10.1039/C5OB01032B. PMID 26083977.
- ^ Abrantes, LM (1994). "Sobre el mecanismo de recubrimiento sin corriente de Ni-P". Journal of the Electrochemical Society . 141 (9): 2356–2360. Bibcode :1994JElS..141.2356A. doi :10.1149/1.2055125.