Ácido bórico
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Ácido bórico [1] | |||
| Otros nombres Ácido ortobórico, Ácido bórico, Sassolite, Borofax, Trihidroxiborano, Boranetriol, Borato de hidrógeno, Acidum boricum | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.030.114 | ||
| Número CE |
| ||
| Número E | E284 (conservantes) | ||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| BH3O3 | |||
| Masa molar | 61,83 g·mol −1 | ||
| Apariencia | Sólido cristalino blanco | ||
| Densidad | 1,435 g/ cm3 | ||
| Punto de fusión | 170,9 °C (339,6 °F; 444,0 K) | ||
| Punto de ebullición | 300 °C (572 °F; 573 K) | ||
| 2,52 g/100 ml (0 °C) 4,72 g/100 ml (20 °C) 5,7 g/100 ml (25 °C) 19,10 g/100 ml (80 °C) 27,53 g/100 ml (100 °C) | |||
| Solubilidad en otros disolventes | Soluble en alcoholes inferiores , moderadamente soluble en piridina, muy ligeramente soluble en acetona. | ||
| registro P | -0,29 [2] | ||
| Acidez (p K a ) | 9.24 ( primer protón ), 12.4 (segundo), 13.3 (completo) | ||
| Base conjugada | Borato | ||
| -34,1·10 −6 cm3 / mol | |||
| Estructura | |||
| Trigonal plana | |||
| 0 D | |||
| Farmacología | |||
| S02AA03 ( OMS ) D08AD ( OMS ) | |||
| Peligros | |||
| Etiquetado SGA : | |||
 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | Ininflamable | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 2660 mg/kg, oral (rata) | ||
| Compuestos relacionados | |||
Compuestos relacionados | Trióxido de boro Borax | ||
| Página de datos complementarios | |||
| Ácido bórico (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El ácido bórico , más específicamente el ácido ortobórico , es un compuesto de boro , oxígeno e hidrógeno con la fórmula B(OH) 3 . También se le puede llamar ortoborato de hidrógeno , trihidroxiboro o ácido bórico . [3] Generalmente se encuentra como cristales incoloros o un polvo blanco, que se disuelve en agua , y se presenta en la naturaleza como el mineral sassolita . Es un ácido débil que produce varios aniones y sales de borato , y puede reaccionar con alcoholes para formar ésteres de borato .
El ácido bórico se utiliza a menudo como antiséptico , insecticida , retardante de llama , absorbente de neutrones o precursor de otros compuestos de boro.
El término "ácido bórico" también se utiliza genéricamente para cualquier oxoácido de boro, como el ácido metabórico HBO 2 y el ácido tetrabórico H 2 B 4 O 7 .
Historia
El ácido ortobórico fue preparado por primera vez por Wilhelm Homberg (1652-1715) a partir del bórax , mediante la acción de ácidos minerales, y recibió el nombre de sal sedativum Hombergi ("sal sedante de Homberg"). Sin embargo, el ácido bórico y los boratos se han utilizado desde la época de los antiguos griegos para limpiar, conservar alimentos y otras actividades. [4]
Estructura molecular y cristalina
Los tres átomos de oxígeno forman una geometría plana trigonal alrededor del boro. La longitud del enlace BO es de 136 pm y la del OH es de 97 pm. El grupo puntual molecular es C 3h . [5]
Se conocen dos formas cristalinas del ácido ortobórico: la triclínica con grupo espacial P 1 y la trigonal con grupo espacial P3 2 . La primera es la más común; la segunda, que es un poco más estable termodinámicamente, se puede obtener con un método de preparación especial. [6]
La forma triclínica del ácido bórico consiste en capas de moléculas de B(OH) 3 unidas por enlaces de hidrógeno con una separación O...O de 272 pm. La distancia entre dos capas adyacentes es de 318 pm. [7] Mientras que las capas de la fase triclínica son casi trigonales con γ = 119,76° , a = 701,87 pm y b = 703,5 pm (en comparación con a = 704,53(4) pm para la forma trigonal), el apilamiento de las capas está algo desfasado en la fase triclínica, con α = 92,49° y β = 101,46° . La fase triclínica tiene c = 634,72 pm y la trigonal tiene a = 956,08(7) pm . [8] [9]
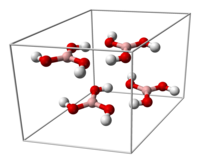 | 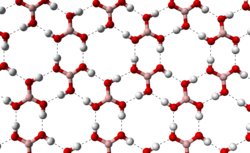 |
La celda unitaria del ácido bórico | Los enlaces de hidrógeno (líneas discontinuas) permiten que las moléculas de ácido bórico formen capas paralelas en estado sólido. |
Preparación
El ácido bórico se puede preparar haciendo reaccionar bórax (tetraborato de sodio decahidratado) con un ácido mineral , como el ácido clorhídrico :
- Na2B4O7 · 10H2O + 2HCl → 4B ( OH ) 3 + 2NaCl + 5H2O
También se forma como subproducto de la hidrólisis de trihaluros de boro y diborano : [10]
- B2H6 + 6H2O → 2B ( OH ) 3 + 6H2
- B (OH ) 3 + 3 H2O → B(OH) 3 + 3 HX ( X = Cl, Br, I)
Reacciones
Pirólisis
Cuando se calienta, el ácido ortobórico sufre una deshidratación en tres etapas. Las temperaturas de transición informadas varían sustancialmente de una fuente a otra. [ cita requerida ]
Cuando se calienta por encima de 140 °C, el ácido ortobórico produce ácido metabórico ( HBO 2 ) con pérdida de una molécula de agua: [11] [12]
- B ( OH ) 3 → HBO2 + H2O
Calentar el ácido metabórico por encima de unos 180 °C elimina otra molécula de agua formando ácido tetrabórico , también llamado ácido pirobórico ( H 2 B 4 O 7 ): [11] [12]
- 4HBO2 → H2B4O7 + H2O
Un calentamiento adicional (hasta aproximadamente 530 °C) produce trióxido de boro : [13] [11] [12]
- H2B4O7 → 2B2O3 + H2O
Solución acuosa
Cuando el ácido ortobórico se disuelve en agua, se disocia parcialmente para dar ácido metabórico :
- B ( OH ) 3 ⇌ HBO2 + H2O
La solución es ligeramente ácida debido a la ionización de los ácidos:
- B ( OH ) 3 + H2O⇌ [BO( OH ) 2 ] − + H3O +
- HBO2 + H2O ⇌ [ BO2 ] − + H3O +
Sin embargo, la espectroscopia Raman de soluciones fuertemente alcalinas ha mostrado la presencia de iones [B(OH) 4 ] − , [14] lo que lleva a algunos a concluir que la acidez se debe exclusivamente a la abstracción de OH − del agua: [14]
- B(OH) 3 + HO − ⇌B (OH)−4
De manera equivalente,
O, más propiamente,
- B (OH) 3 + 2H2O⇌B ( OH )−4+ H3O +
Esta reacción ocurre en dos pasos, con el complejo neutro aquatrihidroxiboro B(OH) 3 (OH 2 ) como intermedio: [15]
- B(OH) 3 + H2O → B ( OH ) 3 ( OH2 )
- B (OH) 3 (OH2 ) + H2O → [ B ( OH ) 4 ] − + H3O +
Esta reacción puede caracterizarse como acidez de Lewis del boro hacia HO − , en lugar de acidez de Brønsted . [16] [17] [18] Sin embargo, parte de su comportamiento hacia algunas reacciones químicas sugiere que también es un ácido tribásico en el sentido de Brønsted-Lowry.
El ácido bórico, mezclado con bórax Na 2 B 4 O 7 ·10H 2 O (más propiamente Na 2 B 4 O 5 (OH) 4 ·8H 2 O ) en una proporción de peso de 4:5, es muy soluble en agua, aunque no son tan solubles por separado. [19]
Solución de ácido sulfúrico
El ácido bórico también se disuelve en ácido sulfúrico anhidro según la ecuación: [7]
- B ( OH ) 3 + 6H2SO4 → [ B ( SO4H ) 4 ] − + 2 [ HSO4 ] − + 3H3O +
El producto es un ácido extremadamente fuerte, incluso más fuerte que el ácido sulfúrico original. [7]
Esterificación
El ácido bórico reacciona con alcoholes para formar ésteres de borato , B(OR) 3 donde R es alquilo o arilo . La reacción suele estar impulsada por un agente deshidratante, como el ácido sulfúrico concentrado : [20]
- B(OH) 3 + 3 ROH → B(OR ) 3 + 3 H2O
Con dioles vecinales
La acidez de las soluciones de ácido bórico aumenta considerablemente en presencia de dioles cis - vicinales ( compuestos orgánicos que contienen grupos hidroxilo orientados de manera similar en átomos de carbono adyacentes, (R 1 ,R 2 )=C(OH)−C(OH)=(R 3 ,R 4 ) ) como el glicerol y el manitol . [21] [7] [22]
El anión tetrahidroxiborato formado en la disolución reacciona espontáneamente con estos dioles para formar ésteres aniónicos relativamente estables que contienen uno o dos anillos −B−O−C−C−O− de cinco miembros. Por ejemplo, la reacción con manitol H(HCOH) 6 H , cuyos dos hidroxilos centrales están en orientación cis , se puede escribir como
- B ( OH) 3 + H2O⇌ [ B( OH ) 4 ] − + H +
- [B(OH) 4 ] − + H(HCOH) 6H ⇌ [B(OH) 2 ( H(HCOH) 2 ( HCO−) 2 (HCOH) 2H )] − + 2 H2O
- [B(OH) 2 (H(HCOH) 2 (HCO−) 2 (HCOH) 2H )] − + H (HCOH) 6H ⇌ [B( H (HCOH) 2 (HCO−) 2 (HCOH) 2H ) 2 ] − + 2 H2O
Dando la reacción general
- B(OH) 3 + 2H(HCOH) 6H ⇌ [ B(H(HCOH) 2 ( HCO− ) 2 (HCOH) 2H ) 2 ] − + 3H2O + H +
La estabilidad de estos aniones éster de manitoborato desplaza el equilibrio de la derecha y, por lo tanto, aumenta la acidez de la solución en 5 órdenes de magnitud en comparación con la del óxido bórico puro, reduciendo el p K a de 9 a menos de 4 para una concentración suficiente de manitol. [21] [7] [22] La solución resultante se ha denominado ácido manitobórico .
La adición de manitol a una solución inicialmente neutra que contiene ácido bórico o boratos simples reduce su pH lo suficiente como para que pueda ser titulada por una base fuerte como NaOH, incluso con un titulador potenciométrico automatizado . Esta propiedad se utiliza en química analítica para determinar el contenido de borato de soluciones acuosas, por ejemplo para monitorear el agotamiento de ácido bórico por neutrones en el agua del circuito primario del reactor de agua ligera cuando el compuesto se agrega como veneno neutrónico durante las operaciones de reabastecimiento de combustible. [7]
Toxicología
Según la dosis letal media (LD50 ) para mamíferos de 2660 mg/kg de masa corporal, el ácido bórico solo es venenoso si se ingiere o se inhala en grandes cantidades. La decimocuarta edición del índice Merck indica que la LD50 del ácido bórico es de 5,14 g/kg para dosis orales administradas a ratas, y que de 5 a 20 g/kg han producido la muerte en humanos adultos. Para un adulto de 70 kg, en el límite inferior de 5 g/kg, 350 g podrían producir la muerte en humanos. A modo de comparación, se informa que la LD50 de la sal es de 3,75 g/kg en ratas según el índice Merck . Según la Agencia para Sustancias Tóxicas y Registro de Enfermedades , "se informó que la dosis letal mínima de boro ingerido (como ácido bórico) era de 2 a 3 g en bebés, 5 a 6 g en niños y 15 a 20 g en adultos. [...] Sin embargo, una revisión de 784 envenenamientos humanos con ácido bórico (10 a 88 g) no informó muertes, y el 88% de los casos fueron asintomáticos". [23]
La exposición prolongada al ácido bórico puede ser más preocupante, ya que causa daño renal y, finalmente, insuficiencia renal (ver los enlaces a continuación). Aunque no parece ser cancerígeno , estudios en perros han informado de atrofia testicular después de la exposición a 32 mg/(kg⋅día) durante 90 días. Este nivel, si fuera aplicable a los seres humanos en dosis similares, equivaldría a una dosis acumulada de 202 g durante 90 días para un adulto de 70 kg, no mucho menor que la DL 50 anterior . [24]
Según el informe CLH sobre el ácido bórico publicado por la Oficina de Sustancias Químicas de Lodz, Polonia, el ácido bórico en dosis altas muestra una toxicidad significativa para el desarrollo y teratogenicidad en fetos de conejos, ratas y ratones, así como defectos cardiovasculares, variaciones esqueléticas y lesiones renales leves. [25] Como consecuencia de ello, en la 30.ª ATP de la directiva de la UE 67/548/CEE de agosto de 2008, la Comisión Europea decidió modificar su clasificación como categoría 2 de toxicidad para la reproducción y aplicar las frases de riesgo R60 (puede perjudicar la fertilidad) y R61 (puede causar daños al feto). [26] [27] [28] [29] [30]
En una reunión de la Asociación Europea de Fabricantes de Diagnósticos (EDMA) de 2010, se debatieron varias nuevas incorporaciones a la lista de sustancias candidatas de muy alta preocupación (SVHC) en relación con el Reglamento de Registro, Evaluación, Autorización y Restricción de Sustancias Químicas de 2007 (REACH). Tras el registro y la revisión realizados como parte de REACH, la clasificación del ácido bórico CAS 10043-35-3 / 11113-50-1 figura a partir del 1 de diciembre de 2010 como H360FD (puede perjudicar la fertilidad. Puede dañar al feto) . [31] [32]
Usos
Industrial
El principal uso industrial del ácido bórico es la fabricación de monofilamentos de fibra de vidrio, generalmente denominados fibras de vidrio textiles. Las fibras de vidrio textiles se utilizan para reforzar plásticos en aplicaciones que van desde embarcaciones hasta tuberías industriales y placas de circuitos informáticos. [33]
En la industria de la joyería, el ácido bórico se utiliza a menudo en combinación con alcohol desnaturalizado para reducir la oxidación de la superficie y la formación de incrustaciones en los metales durante las operaciones de recocido y soldadura . [34] [35]
El ácido bórico se utiliza en la producción del vidrio de las pantallas planas LCD . [36] [37]
En la galvanoplastia , el ácido bórico se utiliza como parte de algunas fórmulas patentadas. Una fórmula conocida utiliza una proporción de H de aproximadamente 1 a 10.
3BIENVENIDOS
3Para NiSO
4, una porción muy pequeña de lauril sulfato de sodio y una pequeña porción de H
2ENTONCES
4.
La solución de ácido ortobórico y bórax en proporción 4:5 se utiliza como agente retardante del fuego de la madera mediante impregnación. [38]
También se utiliza en la fabricación de masa apisonadora, un polvo fino que contiene sílice y que se utiliza para producir revestimientos de hornos de inducción y cerámicas .
Los herreros añaden ácido bórico al bórax para que lo utilicen como fundente de soldadura . [39]
El ácido bórico, en combinación con alcohol polivinílico (PVA) o aceite de silicona , se utiliza para fabricar Silly Putty . [40]
El ácido bórico también está presente en la lista de aditivos químicos utilizados para la fracturación hidráulica (fracking) en Marcellus Shale en Pensilvania. [41] A menudo se utiliza junto con la goma guar como agente reticulante y gelificante para controlar la viscosidad y la reología del fluido de fracturación inyectado a alta presión en el pozo. Es importante controlar la viscosidad del fluido para mantener en suspensión en largas distancias de transporte los granos de los agentes de apuntalamiento destinados a mantener las grietas en las pizarras suficientemente abiertas para facilitar la extracción de gas después de que se alivie la presión hidráulica. [42] [43] [44] Las propiedades reológicas del hidrogel de goma guar reticulado con borato dependen principalmente del valor de pH . [45]
El ácido bórico se utiliza en algunos fusibles eléctricos de tipo expulsión como agente de desionización/extinción. [46] Durante una falla eléctrica en un fusible de tipo expulsión, se genera un arco de plasma por la desintegración y la rápida separación accionada por resorte del elemento fusible, que normalmente es una varilla metálica especializada que pasa a través de una masa comprimida de ácido bórico dentro del conjunto del fusible. El plasma de alta temperatura hace que el ácido bórico se descomponga rápidamente en vapor de agua y anhídrido bórico y, a su vez, los productos de vaporización desionizan el plasma, lo que ayuda a interrumpir la falla eléctrica. [47]
Médico
El ácido bórico se puede utilizar como antiséptico para quemaduras o cortaduras menores y, a veces, se utiliza en ungüentos y apósitos , como la pelusa bórica . El ácido bórico se aplica en una solución muy diluida como lavado de ojos. Los óvulos vaginales de ácido bórico se pueden utilizar para la candidiasis recurrente debido a Candida no albicans como tratamiento de segunda línea cuando el tratamiento convencional ha fallado. [48] [49] Es menos eficaz que el tratamiento convencional en general. [48] El ácido bórico preserva en gran medida los lactobacilos dentro de la vagina. [50] Como TOL-463 , se está desarrollando como un medicamento intravaginal para el tratamiento de la candidiasis vulvovaginal . [51] [52] [53]
Como compuesto antibacteriano , el ácido bórico también se puede utilizar para tratar el acné . También se utiliza para prevenir el pie de atleta , introduciendo polvos en los calcetines o medias. Se pueden utilizar diversas preparaciones para tratar algunos tipos de otitis externa (infección del oído) tanto en humanos como en animales. [54] El conservante de los frascos de muestras de orina en el Reino Unido es el ácido bórico. [55]
Se sabe que las soluciones de ácido bórico utilizadas para lavar los ojos o sobre la piel lastimada son tóxicas, en particular para los bebés, especialmente después de un uso repetido; esto se debe a su lenta tasa de eliminación. [56]
El ácido bórico es una de las sustancias más utilizadas para contrarrestar los efectos nocivos del ácido fluorhídrico reactivo (HF) tras un contacto accidental con la piel. Funciona forzando a los aniones F − libres a convertirse en el anión tetrafluoroborato inerte . Este proceso anula la extrema toxicidad del ácido fluorhídrico, en particular su capacidad de secuestrar calcio iónico del suero sanguíneo , lo que puede provocar un paro cardíaco y la descomposición ósea; un evento de este tipo puede ocurrir con un simple contacto leve de la piel con HF. [57] [ verificación fallida ]
Insecticida
El ácido bórico se registró por primera vez en los EE. UU. como insecticida en 1948 para el control de cucarachas , termitas , hormigas rojas , pulgas , pececillos de plata y muchos otros insectos . En general, se considera que el producto es seguro para usar en las cocinas domésticas para controlar cucarachas y hormigas. Actúa como un veneno estomacal que afecta el metabolismo de los insectos , y el polvo seco es abrasivo para los exoesqueletos de los insectos . [58] [59] [60] El ácido bórico también tiene la reputación de ser "el regalo que sigue matando" en el sentido de que las cucarachas que cruzan sobre áreas ligeramente espolvoreadas no mueren inmediatamente, sino que el efecto es como fragmentos de vidrio que las cortan en pedazos. Esto a menudo permite que una cucaracha regrese al nido donde pronto muere. Las cucarachas, al ser caníbales , se comen a otras que mueren por contacto o consumo de ácido bórico, consumiendo el polvo atrapado en la cucaracha muerta y matándolas también. [ cita requerida ]
El ácido bórico también se ha utilizado ampliamente en el tratamiento de la madera para protegerla de las termitas. No se conoce por completo la complejidad de su mecanismo, pero además de causar una mortalidad dependiente de la dosis, el ácido bórico causa disbiosis en las termitas subterráneas del este , lo que conduce al aumento oportunista de patógenos de insectos que podrían contribuir a la mortalidad. [61]
Preservación
En combinación con su uso como insecticida, el ácido bórico también previene y destruye la podredumbre húmeda y seca existente en la madera. Se puede utilizar en combinación con un portador de etilenglicol para tratar la madera externa contra el ataque de hongos e insectos. Es posible comprar varillas impregnadas de borato para insertarlas en la madera a través de orificios perforados donde se sabe que la humedad se acumula y se asienta. Está disponible en forma de gel y en forma de pasta inyectable para tratar la madera afectada por la podredumbre sin necesidad de reemplazar la madera. Se pueden utilizar concentrados de tratamientos a base de borato para prevenir el crecimiento de limo, micelio y algas, incluso en entornos marinos. [ cita requerida ]
El ácido bórico se añade a la sal para curar pieles de ganado, pieles de ternera y pieles de oveja . Esto ayuda a controlar el desarrollo bacteriano y a controlar los insectos. [ cita requerida ]
Tampón de pH


El ácido bórico en equilibrio con su base conjugada, el ion borato, se utiliza ampliamente (en el rango de concentración de 50 a 100 ppm de equivalentes de boro) como un sistema amortiguador de pH primario o adjunto en piscinas . El ácido bórico es un ácido débil, con un p K a (el pH en el que el amortiguamiento es más fuerte porque el ácido libre y el ion borato están en concentraciones iguales) de 9,24 en agua pura a 25 °C. Pero el p K a aparente es sustancialmente menor en piscinas o aguas oceánicas debido a las interacciones con varias otras moléculas en solución. Será alrededor de 9,0 en una piscina de agua salada. Sin importar qué forma de boro soluble se agregue, dentro del rango aceptable de pH y concentración de boro para piscinas, el ácido bórico es la forma predominante en solución acuosa, como se muestra en la figura adjunta. El sistema de ácido bórico-borato puede ser útil como un sistema amortiguador primario (en sustitución del sistema de bicarbonato con p K a 1 = 6,0 y p K a 2 = 9,4 en condiciones típicas de piscinas de agua salada) en piscinas con generadores de cloro de agua salada que tienden a mostrar una deriva ascendente en el pH desde un rango de trabajo de pH 7,5-8,2. La capacidad amortiguadora es mayor frente al aumento del pH (hacia el pKa alrededor de 9,0), como se ilustra en el gráfico adjunto. El uso de ácido bórico en este rango de concentración no permite ninguna reducción en la concentración de HOCl libre necesaria para el saneamiento de la piscina, pero puede aumentar marginalmente los efectos fotoprotectores del ácido cianúrico y conferir otros beneficios a través de la actividad anticorrosiva o la suavidad percibida del agua, dependiendo de la composición general de solutos de la piscina. [62]
Lubricación
Las suspensiones coloidales de nanopartículas de ácido bórico disueltas en petróleo o aceite vegetal pueden formar un lubricante notable sobre superficies de cerámica o metal [63] con un coeficiente de fricción deslizante que disminuye con el aumento de la presión hasta un valor que varía de 0,10 a 0,02. Las películas autolubricantes de B(OH) 3 resultan de una reacción química espontánea entre las moléculas de agua y los recubrimientos de B2O3 en un entorno húmedo. A gran escala, existe una relación inversa entre el coeficiente de fricción y la presión de contacto hertziana inducida por la carga aplicada. [ cita requerida ]
El ácido bórico se utiliza para lubricar los tableros de carrom y novuss , lo que permite un juego más rápido. [64]
Energía nuclear
El ácido bórico se utiliza en algunas centrales nucleares como veneno para neutrones . El boro del ácido bórico reduce la probabilidad de fisión térmica al absorber algunos neutrones térmicos . Las reacciones en cadena de fisión generalmente están impulsadas por la probabilidad de que los neutrones libres resulten en fisión y están determinadas por las propiedades geométricas y materiales del reactor. El boro natural consta de aproximadamente un 20% de isótopos de boro-10 y un 80% de boro-11. El boro-10 tiene una sección transversal alta para la absorción de neutrones de baja energía (térmicos). Al aumentar la concentración de ácido bórico en el refrigerante del reactor, se reduce la probabilidad de que un neutrón cause fisión. Los cambios en la concentración de ácido bórico pueden regular eficazmente la tasa de fisión que tiene lugar en el reactor. Durante el funcionamiento normal a alta potencia, el ácido bórico se utiliza únicamente en reactores de agua a presión (PWR), mientras que los reactores de agua en ebullición (BWR) emplean un patrón de barras de control y un flujo de refrigerante para el control de la potencia, aunque los BWR pueden utilizar una solución acuosa de ácido bórico y bórax o pentaborato de sodio para un sistema de apagado de emergencia si las barras de control no se insertan. El ácido bórico se puede disolver en piscinas de combustible gastado que se utilizan para almacenar elementos de combustible gastado . La concentración es lo suficientemente alta como para mantener la multiplicación de neutrones al mínimo. Se vertió ácido bórico sobre el reactor 4 de la planta de energía nuclear de Chernóbil después de su fusión para evitar que ocurriera otra reacción. [ cita requerida ]
Pirotécnica
El boro se utiliza en pirotecnia para evitar la reacción de formación de amidas entre el aluminio y los nitratos . Se añade una pequeña cantidad de ácido bórico a la composición para neutralizar las amidas alcalinas que pueden reaccionar con el aluminio.
El ácido bórico se puede utilizar como colorante para hacer que el fuego sea verde. Por ejemplo, cuando se disuelve en metanol, los malabaristas y los hilanderos de fuego lo utilizan popularmente para crear una llama de color verde intenso mucho más fuerte que el sulfato de cobre. [65]
Agricultura
El ácido bórico se utiliza para tratar o prevenir las deficiencias de boro en las plantas. También se utiliza para la conservación de cereales como el arroz y el trigo. [66]
Referencias
- ^ "Ácido bórico".
- ^ "msds bórico".
- ^ Entrada "ácido bórico" en el diccionario en línea Merriamm-Webster . Se menciona el primer uso en 1790. Consultado el 24 de junio de 2022.
- ^ Ronald Eisler (2007). Enciclopedia de sustancias químicas prioritarias peligrosas para el medio ambiente de Eisler. Elsevier. pág. 59. ISBN 978-0-08-054707-7.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . p. 1291. ISBN 978-0-08-037941-8.
- ^ Andrei Rotaru (2017): "Estudio térmico y cinético del ácido bórico hexagonal frente al ácido bórico triclínico en el flujo de aire". Journal of Thermal Analysis and Calorimetry , volumen 127, páginas 755–763. doi :10.1007/s10973-016-5583-7
- ^ abcdef Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ Gajhede, M.; Larsen, S.; Rettrup, S. (1 de diciembre de 1986). "Densidad electrónica del ácido ortobórico determinada por difracción de rayos X a 105 K y cálculos ab initio". Acta Crystallographica Sección B Ciencia estructural . 42 (6): 545–552. Código Bibliográfico :1986AcCrB..42..545G. doi :10.1107/S0108768186097720.
- ^ Shuvalov, Robert R.; Burns, Peter C. (15 de junio de 2003). "Un nuevo politipo de ácido ortobórico, H 3 BO 3 -3 T". Acta Crystallographica Sección C Estructura cristalina Comunicaciones . 59 (6): i47–i49. Bibcode :2003AcCrC..59I..47S. doi :10.1107/S0108270103009685. PMID 12794317.
- ^ Housecroft, CE; Sharpe, AG (2008). "Capítulo 13: Los elementos del grupo 13". Química inorgánica (3.ª ed.). Pearson. pág. 340. ISBN 978-0-13-175553-6.
- ^ abc Gurwinder Kaur, Shagun Kainth, Rohit Kumar, Piyush Sharma y OP Pandey (2021): "Cinética de reacción durante la síntesis no isotérmica en estado sólido de trióxido de boro mediante deshidratación con ácido bórico". Cinética de reacción, mecanismos y catálisis , volumen 134, páginas 347–359. doi :10.1007/s11144-021-02084-8
- ^ abc Siavash Aghili, Masoud Panjepour y Mahmood Meratian (2018): "Análisis cinético de la formación de trióxido de boro a partir de la descomposición térmica del ácido bórico en condiciones no isotérmicas". Journal of Thermal Analysis and Calorimetry , volumen 131, páginas 2443–2455. doi :10.1007/s10973-017-6740-3
- ^ Balci, Suna; Sezgi, Naime; Eren, Esin (2012). "Cinética de producción de óxido de boro utilizando ácido bórico como materia prima". Investigación en química industrial e ingeniería . 51 (34): 11091–11096. doi :10.1021/ie300685x.
- ^ ab Jolly, WL (1984). Química inorgánica moderna . McGraw-Hill. pág. 198.
- ^ Masanori Tachikawa (2004): "Un estudio funcional de la densidad en grupos hidratados de ácido ortobórico, B(OH) 3 (H 2 O) n ( n =1–5)". Journal of Molecular Structure: THEOCHEM , volumen 710, números 1–3, páginas 139-150. doi :10.1016/j.theochem.2004.09.008
- ^ Housecroft, CE; Sharpe, AG (2005). Química inorgánica (2.ª ed.). Pearson Prentice-Hall. págs. 314-5.
- ^ MHE. Química integral para JEE Advanced 2014. Tata McGraw-Hill Education. pág. 15.5. ISBN 978-1-259-06426-5– a través de Google Books.
- ^ Darpan, Pratiyogita (1 de mayo de 2000). Visión de la ciencia de la competencia. Pratiyogita Darpan - vía Internet Archive.
- ^ Tsuyumoto, I.; Oshio, T.; Katayama, K. (2007). "Preparación de una solución acuosa altamente concentrada de borato de sodio". Inorganic Chemistry Communications . 10 (1): 20–22. doi :10.1016/j.inoche.2006.08.019.
- ^ Brown, Herbert C.; Mead, Edward J.; Shoaf, Charles J. (1956). "Procedimientos convenientes para la preparación de ésteres de borato de alquilo". J. Am. Chem. Soc . 78 (15): 3613–3614. doi :10.1021/ja01596a015.
- ^ ab Mendham, J.; Denney, RC; Barnes, JD; Thomas, MJK (2000), Vogel's Quantitative Chemical Analysis (6.ª ed.), Nueva York: Prentice Hall, pág. 357, ISBN 0-582-22628-7
- ^ ab Publicación especial del NIST . Imprenta del Gobierno de los EE. UU., 1969.
- ^ "Perfil toxicológico del boro" (PDF) . Centros para el Control y la Prevención de Enfermedades . Noviembre de 2010. pág. 11.
- ^ "Informe de la decisión de elegibilidad para la reevaluación de tolerancias (TRED) de la Ley de protección de la calidad de los alimentos (FQPA) para las sales de ácido bórico y borato de sodio" (PDF) . Agencia de Protección Ambiental de los Estados Unidos . 2006. Archivado desde el original (PDF) el 6 de octubre de 2006 . Consultado el 21 de abril de 2008 .
- ^ "Informe CLH sobre el ácido bórico: propuesta de clasificación y etiquetado armonizados". Lodz (Polonia): Oficina de Sustancias Químicas. 23 de abril de 2018. Consultado el 18 de octubre de 2018 .
- ^ "Ácido bórico, ACC# 03260 MSDS" (PDF) . 11 de febrero de 2008. Archivado desde el original (PDF) el 16 de diciembre de 2011 . Consultado el 24 de septiembre de 2009 .
- ^ Ishii, Y.; Fujizuka, N.; Takahashi, T.; et al. (1993). "Un caso fatal de intoxicación aguda por ácido bórico". Toxicología clínica . 31 (2): 345–352. doi :10.3109/15563659309000402. PMID 8492348.
- ^ Restuccio, A.; Mortensen, ME; Kelley, MT (1992). "Ingestión fatal de ácido bórico en un adulto". American Journal of Emergency Medicine . 10 (6): 545–547. doi :10.1016/0735-6757(92)90180-6. PMID 1388380.
- ^ Duldner, JE (30 de enero de 2009). "Intoxicación por ácido bórico". Enciclopedia médica ADAM . MedLine Plus.
- ^ Autoridad Alimentaria de Nueva Gales del Sur. «Bórax y ácido bórico». Australia: Gobierno de Nueva Gales del Sur. Archivado desde el original el 15 de octubre de 2009. Consultado el 24 de septiembre de 2009 .
- ^ "El ácido bórico es una sustancia muy preocupante debido a sus propiedades CMR" (PDF) . Biblioteca de documentos de la ECHA. Archivado desde el original (PDF) el 18 de mayo de 2016 . Consultado el 28 de mayo de 2017 .
- ^ Reglamento (CE) n.º 1272/2008 del Parlamento Europeo y del Consejo, de 16 de diciembre de 2008
- ^ Kistler, RB; Helvaci, C. (1994). "Boro y boratos". En Carr, DD (ed.). Minerales y rocas industriales (6.ª ed.). Littleton, CO: SME. págs. 171–186.
- ^ Hettmansperger, Mary (2008). Envolver, coser, doblar y remachar: cómo hacer joyas de metal de diseño. Lark Books. ISBN 978-1-60059-125-9.
- ^ Lewton-Brain, Charles. "Cómo lidiar con la escala de fuego". Recursos para la fabricación de joyas de Ganoksin . Consultado el 20 de junio de 2024 .
- ^ "Boletín Técnico: Boratos en vidrios" (PDF) . Borax . 2021.
- ^ "Pantallas planas de boro". Borates Today . 9 de febrero de 2022.
- ^ Tsuyumoto, I.; Oshio, T. (2009). "Desarrollo de madera laminada resistente al fuego utilizando una solución acuosa concentrada de poliborato de sodio". Journal of Wood Chemistry and Technology . 29 (4): 277–285. doi :10.1080/02773810903033721. S2CID 98730912.
- ^ Dempsey, Jock (2009) [1998]. "Bórax". La fragua de Dempsey . Consultado el 23 de julio de 2010 .
- ^ Prager, Felice. "La ciencia se convierte en un juguete: plastilina". Loti.com . Rewind the Fifites. Archivado desde el original el 12 de mayo de 2013. Consultado el 7 de junio de 2013 .
- ^ "Productos químicos utilizados por las empresas de fracturación hidráulica en Pensilvania para actividades de fracturación hidráulica y de superficie" (PDF) . Departamento de Protección Ambiental de Pensilvania, Oficina de Gestión de Petróleo y Gas. 30 de junio de 2010.
- ^ Fink, Johannes (2015). "Fluidos de fracturación". Guía del ingeniero petrolero sobre productos químicos y fluidos para yacimientos petrolíferos . págs. 567–651. doi :10.1016/B978-0-12-803734-8.00017-5. ISBN 978-0-12-803734-8.
- ^ Bishop, Maximilienne; Shahid, Naureen; Yang, Jianzhong; Barron, Andrew R. (2004). "Determinación del modo y la eficacia de la reticulación de guar por borato utilizando MAS 11 B RMN de guar reticulado con borato en combinación con solución 11 B RMN de sistemas modelo". Dalton Trans. (17): 2621–2634. doi :10.1039/B406952H. ISSN 1477-9226. PMID 15514744.
- ^ "Patente Europea EP3004279A1. Soluciones concentradas de reticulación de borato para su uso en operaciones de fracturación hidráulica". Oficina Europea de Patentes . Consultado el 27 de octubre de 2019 .
- ^ Wang, Shibin; Tang, Hongbiao; Guo, Jianchun; Wang, Kunjie (2016). "Efecto del pH en las propiedades reológicas del hidrogel de goma guar de hidroxipropilo reticulado con borato y la goma guar de hidroxipropilo". Carbohydrate Polymers . 147 : 455–463. doi :10.1016/j.carbpol.2016.04.029. ISSN 0144-8617. PMID 27178952.
- ^ Descripción general del producto de soluciones para el sector eléctrico (PDF) . Vol. 14: Fusibles. Eaton Corporation . 2011.
- ^ Strom, AP; Rawlins, HL (diciembre de 1932). "El fusible de ácido bórico". Transacciones del Instituto Americano de Ingenieros Eléctricos . 51 (4): 1020–1025. doi :10.1109/T-AIEE.1932.5056215. ISSN 0096-3860. S2CID 51650608.
- ^ ab Iavazzo C, Gkegkes ID, Zarkada IM, Falagas ME (agosto de 2011). "Ácido bórico para la candidiasis vulvovaginal recurrente: evidencia clínica". J Womens Health (Larchmt) . 20 (8): 1245–55. doi :10.1089/jwh.2010.2708. PMID 21774671.
- ^ Abercrombie, P. (2010). "Vaginitis". En Maizes, V.; Low Dog, T. (eds.). Salud integral de la mujer . Nueva York, NY: Oxford University Press. p. 192. doi :10.1093/med/9780190214791.003.0013. ISBN 978-0-19-537881-8.
- ^ Sobel JD, Sobel R (agosto de 2021). "Farmacoterapia actual y emergente para la vaginosis bacteriana recurrente". Expert Opin Pharmacother . 22 (12): 1593–1600. doi :10.1080/14656566.2021.1904890. PMID 33750246. S2CID 232325625.
- ^ "TOL 463 – AdisInsight".
- ^ Nyirjesy P, Brookhart C, Lazenby G, Schwebke J, Sobel JD (abril de 2022). "Candidiasis vulvovaginal: una revisión de la evidencia de las pautas de tratamiento de las infecciones de transmisión sexual de los Centros para el Control y la Prevención de Enfermedades de 2021". Clin Infect Dis . 74 (Suppl_2): S162–S168. doi :10.1093/cid/ciab1057. PMID 35416967.
- ^ Marrazzo JM, Dombrowski JC, Wierzbicki MR, Perlowski C, Pontius A, Dithmer D, Schwebke J (febrero de 2019). "Seguridad y eficacia de un nuevo antiinfeccioso vaginal, TOL-463, en el tratamiento de la vaginosis bacteriana y la candidiasis vulvovaginal: un ensayo controlado, aleatorizado y simple ciego de fase 2". Clin Infect Dis . 68 (5): 803–809. doi :10.1093/cid/ciy554. PMC 6376090 . PMID 30184181.
- ^ Adriztina, I.; Adenin, LI; Lubis, YM (enero de 2018). "Eficacia del ácido bórico como tratamiento de elección para la otitis media supurativa crónica y su ototoxicidad". Korean J Fam Med . 39 (1): 2–9. doi :10.4082/kjfm.2018.39.1.2. PMC 5788841 . PMID 29383205.
- ^ Normas del Reino Unido para las investigaciones microbiológicas (PDF) . Public Health England . 7 de agosto de 2017.
- ^ Harvey, SC (1980). "Antisépticos y desinfectantes; fungicidas; ectoparasiticidas". En Gilman, AG ; Goodman, LS ; Gilman, A. (eds.). Goodman & Gillman's The Pharmacological Basis of Therapeutics (6.ª ed.). Macmillan. pág. 971. ISBN 978-0-02-344720-4.
- ^ "Método 3052 de digestión ácida asistida por microondas de matrices de base orgánica y silícea" (PDF) . EPA de EE. UU. 22 de junio de 2015.
- ^ "Boratos en pesticidas | AMERICAN BORATE COMPANY".
- ^ Boone, C.; Bond, C.; Stone, D. (2012). "Hoja informativa general sobre el ácido bórico". Centro Nacional de Información sobre Pesticidas , Servicios de Extensión de la Universidad Estatal de Oregón.
- ^ "Datos sobre RED: ácido bórico" (PDF) . Agencia de Protección Ambiental de los Estados Unidos. Archivado (PDF) del original el 23 de diciembre de 2021 . Consultado el 2 de abril de 2022 .
- ^ Ashbrook, Aaron R.; Schwarz, Melbert; Schal, Coby; Mikaelyan, Aram (2024). "Alteración letal de la comunidad intestinal bacteriana en termitas subterráneas orientales causada por ácido bórico". Journal of Economic Entomology . doi : 10.1093/jee/toae221 . PMID 39401329 . Consultado el 21 de octubre de 2024 .
- ^ Birch, Robert G (2013). "El ácido bórico como amortiguador de piscinas" (PDF) . The University of Queensland . Consultado el 30 de noviembre de 2013 .
- ^ Düzcükoğlu, H.; Acaroğlu, M. (2009). "Propiedades de lubricación de aceites vegetales combinados con ácido bórico y determinación de sus efectos sobre el desgaste". Fuentes de energía, parte A: recuperación, utilización y efectos ambientales . 32 (3): 275–285. doi :10.1080/15567030802606053. S2CID 97537085.
- ^ Singh, Harpreet. "Equipamiento estándar". Asociación de Carrom del Estado de Punjab. Archivado desde el original el 14 de marzo de 2007. Consultado el 24 de septiembre de 2009 .
- ^ Weingart, George (1947). Pirotecnia . Chemical Publishing Company. ISBN 978-0-8206-0112-0.
- ^ "Uso de ácido bórico y bórax en los alimentos". cfs.gov.hk . Consultado el 22 de mayo de 2019 .
Lectura adicional
- Jolly, WL (1991). Química inorgánica moderna (2.ª ed.). Nueva York: McGraw-Hill. ISBN 978-0-07-112651-9.
- Goodman, L.; Gilman, A.; Brunton, L.; Lazo, J.; Parker, K. (2006). Goodman & Gilman's The Pharmacological Basis of Therapeutics . Nueva York: McGraw Hill.
- Cordia JA, Bal EA, Mak WA y Wils ERJ (2003), Determinación de algunas propiedades físico-químicas de Optibor EP. Rijswijk, Países Bajos: TNO Prins Maurits Laboratory, informe PML 2002-C42rr, GLP, datos confidenciales no publicados proporcionados por Bor ax Europe Limited
Enlaces externos
 Medios relacionados con Ácido bórico en Wikimedia Commons
Medios relacionados con Ácido bórico en Wikimedia Commons- Hoja de datos técnicos sobre el ácido bórico – Centro Nacional de Información sobre Pesticidas
- Hoja informativa general sobre el ácido bórico – Centro Nacional de Información sobre Pesticidas
- Ficha internacional de seguridad química 0991
- Decisión de la EPA de EE. UU. sobre elegibilidad para el nuevo registro de pesticidas
- Inventario Nacional de Contaminantes – Boro y compuestos
- Ácido bórico en ChemicalLand21
- Agencia Europea de Sustancias y Mezclas Químicas (ECHA) "Nueva consulta pública sobre ocho sustancias potencialmente extremadamente preocupantes", entre ellas el ácido bórico. Fecha de cierre: 22 de abril de 2010
- ChemSub Online: Ácido bórico






