Catástrofe mitótica
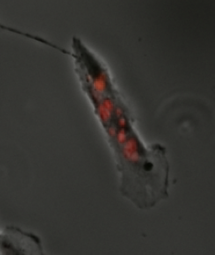
La catástrofe mitótica se ha definido como un mecanismo celular para evitar que las células potencialmente cancerosas proliferen o como un modo de muerte celular que ocurre después de una progresión o entrada inadecuada al ciclo celular . [1] [2] La catástrofe mitótica puede ser inducida por la activación prolongada del punto de control de ensamblaje del huso , errores en la mitosis o daño del ADN y opera para prevenir la inestabilidad genómica. [3] Es un mecanismo que se está investigando como un objetivo terapéutico potencial en los cánceres , y numerosas terapias aprobadas inducen la catástrofe mitótica. [4]
Uso del término
Se han realizado múltiples intentos de definir específicamente la catástrofe mitótica desde que el término se utilizó por primera vez para describir una letalidad dependiente de la temperatura en la levadura, Schizosaccharomyces pombe , que demostró una segregación anormal de cromosomas. [2] [3] El término se ha utilizado para definir un mecanismo de muerte celular que ocurre mientras una célula está en mitosis o como un método de oncosupresión que evita que las células potencialmente tumorígenas se dividan. [3] Esta oncosupresión se logra iniciando una forma de muerte celular como la apoptosis o la necrosis o induciendo la senescencia celular . [3]
Mecanismo para prevenir el desarrollo del cáncer

Un uso del término catástrofe mitótica es describir un mecanismo oncosupresor (es decir, un mecanismo para prevenir la proliferación de células cancerosas y el desarrollo de tumores) que ocurre cuando las células experimentan y detectan que se ha producido una mitosis defectuosa . [5] Esta definición de este mecanismo ha sido descrita por el Comité Internacional de Nomenclatura sobre Muerte Celular. [6] [5] Según esta definición, las células que experimentan una catástrofe mitótica envejecen y dejan de dividirse o experimentan una forma regulada de muerte celular durante la mitosis u otra forma de muerte celular en la siguiente fase G 1 del ciclo celular. [5] [3] La función de este mecanismo es evitar que las células acumulen inestabilidad genómica que puede conducir a la tumorigénesis. [3] [6]
Cuando la célula sufre una muerte celular durante la mitosis, esto se conoce como muerte mitótica. [3] Esto se caracteriza por altos niveles de ciclina B1 todavía presentes en la célula en el momento de la muerte celular, lo que indica que la célula nunca terminó la mitosis. [3] La catástrofe mitótica también puede llevar a que la célula esté destinada a la muerte celular por apoptosis o necrosis después de la interfase del ciclo celular. [3] Sin embargo, el momento de la muerte celular puede variar desde horas después de que se complete la mitosis hasta años después, lo que se ha observado en tejidos humanos tratados con radioterapia. [3] El resultado menos común de la catástrofe mitótica es la senescencia en la que la célula deja de dividirse y entra en un arresto permanente del ciclo celular que evita que la célula prolifere más. [3]
Mecanismo de muerte celular
Otro uso del término catástrofe mitótica es describir un modo de muerte celular que ocurre durante la mitosis. [2] Esta muerte celular puede ocurrir debido a una acumulación de daño en el ADN en presencia de puntos de control de la estructura del ADN que funcionan incorrectamente o un punto de control de ensamblaje del huso que funciona incorrectamente. [2] Las células que experimentan muerte por catástrofe mitótica pueden carecer de activación de vías de las vías de muerte tradicionales, como la apoptosis. [7] Si bien las definiciones más recientes de catástrofe mitótica no la utilizan para describir un mecanismo de muerte celular genuino, algunas publicaciones la describen como un mecanismo de muerte celular. [5] [7]
Causas
Activación prolongada del punto de control del conjunto del husillo

Las células tienen un mecanismo para prevenir la segregación inadecuada de los cromosomas conocido como punto de control del ensamblaje del huso o punto de control mitótico. [3] El punto de control del ensamblaje del huso verifica que los husos mitóticos se hayan unido correctamente a los cinetocoros de cada par de cromosomas antes de que los cromosomas se segreguen durante la división celular. [6] Si los husos mitóticos no están unidos correctamente a los cinetocoros , entonces el punto de control del ensamblaje del huso evitará la transición de la metafase a la anafase . [6] Este mecanismo es importante para asegurar que el ADN dentro de la célula se divida equitativamente entre las dos células hijas. [3] Cuando se activa el punto de control del ensamblaje del huso, detiene la célula en mitosis hasta que todos los cromosomas estén unidos y alineados correctamente. [3] Si el punto de control se activa durante un período prolongado, puede provocar una catástrofe mitótica. [3]
La activación prolongada del punto de control del ensamblaje del huso inhibe el complejo promotor de la anafase. [8] Normalmente, la activación del complejo promotor de la anafase conduce a la separación de las cromátidas hermanas y a la salida de la mitosis de la célula. [9] El complejo del punto de control mitótico actúa como un regulador negativo del complejo promotor de la anafase. [9] Los cinetocoros no unidos promueven la formación del complejo del punto de control mitótico que se compone de cuatro proteínas diferentes conocidas como Mad2 , Cdc20 , BubR1 y Bub3 en humanos. [9] Cuando se forma el complejo del punto de control mitótico, se une al complejo promotor de la anafase y evita su capacidad de promover la progresión del ciclo celular. [9]
Errores en la mitosis

Algunas células pueden tener una mitosis errónea y aun así sobrevivir y someterse a otra división celular, lo que aumenta la probabilidad de que la célula sufra una catástrofe mitótica. [3] Por ejemplo, las células pueden sufrir un proceso llamado deslizamiento mitótico, en el que las células salen de la mitosis demasiado pronto, antes de que finalice el proceso de mitosis. [10] En este caso, la célula termina la mitosis en presencia de la señalización del punto de control del ensamblaje del huso, que normalmente evitaría que la célula salga de la mitosis. [3] Este fenómeno es causado por la degradación inadecuada de la ciclina B1 y puede dar lugar a eventos de segregación incorrecta de cromosomas. [3] La ciclina B1 es un importante regulador del ciclo celular y guía la progresión de las células de la fase G2 a la M. [11] La ciclina B1 trabaja con su socio de unión CDK1 para controlar esta progresión y el complejo se conoce como factor promotor mitótico. [11] Si bien el factor promotor mitótico se utiliza para guiar la entrada de las células a la mitosis, su destrucción también guía la salida de las células de la mitosis. [11] Normalmente, la degradación de ciclina B1 es iniciada por el complejo promotor de anafase después de que todos los cinetocoros han sido unidos apropiadamente por las fibras del huso mitótico. [11] Sin embargo, cuando los niveles de ciclina B1 se degradan demasiado rápido esto puede resultar en que la célula salga de la mitosis prematuramente dando como resultado posibles errores mitóticos incluyendo la segregación incorrecta de cromosomas. [11]

Las células tetraploides o aneuploides tienen un mayor riesgo de catástrofe mitótica. [4] Las células tetraploides son células que han duplicado su material genético, pero no han experimentado citocinesis para dividirse en dos células hijas y, por lo tanto, permanecen como una sola célula. [12] Las células aneuploides son células que tienen un número incorrecto de cromosomas, incluidas adiciones completas de cromosomas o pérdidas completas de cromosomas. [13] Las células con un número anormal de cromosomas tienen más probabilidades de tener errores de segregación cromosómica que resultan en catástrofe mitótica. [4] Las células que se vuelven aneuploides a menudo se ven impedidas de un mayor crecimiento y división celular por la activación de vías supresoras de tumores como p53, que lleva a la célula a un estado de no proliferación conocido como senescencia celular. [4] Dado que las células aneuploides a menudo pueden volverse tumorígenas, este mecanismo evita la propagación de estas células y, por lo tanto, previene el desarrollo de cánceres en el organismo. [3]
Las células que experimentan divisiones multipolares, o en otras palabras, se dividen en más de 2 células hijas, también tienen un mayor riesgo de catástrofe mitótica. [3] Si bien muchas de las progenies de las divisiones multipolares no sobreviven debido a números de cromosomas altamente desequilibrados, la mayoría de las células que sobreviven y experimentan una mitosis posterior probablemente experimenten una catástrofe mitótica. [3] Estas divisiones multipolares ocurren debido a la presencia de más de dos centrosomas. [14] Los centrosomas son orgánulos celulares que actúan para organizar el ensamblaje del huso mitótico en la célula durante la mitosis y, por lo tanto, guían la segregación de cromosomas durante la mitosis. [15] Normalmente, las células tendrán dos centrosomas que guían a las cromátidas hermanas a los polos opuestos de la célula en división. [16] Sin embargo, cuando hay más de dos centrosomas presentes en la mitosis, pueden tirar de los cromosomas en direcciones incorrectas, lo que resulta en células hijas que son inviables. [12] Muchos cánceres tienen un número excesivo de centrosomas, pero para evitar que las células hijas sean inviables, las células cancerosas han desarrollado mecanismos para agrupar sus centrosomas. [12] Cuando los centrosomas se agrupan en dos polos de la célula en división, los cromosomas se segregan adecuadamente y se forman dos células hijas. [12] Por lo tanto, los cánceres que pueden adaptarse a un mayor número de centrosomas pueden prevenir la catástrofe mitótica y propagarse en presencia de sus centrosomas adicionales. [3]
Daño del ADN
Los altos niveles de daño del ADN que no se reparan antes de que la célula entre en mitosis pueden dar lugar a una catástrofe mitótica. [3] Las células que tienen un punto de control G2 comprometido no tienen la capacidad de impedir la progresión a través del ciclo celular incluso cuando hay daño del ADN presente en el genoma de la célula. [3] El punto de control G2 normalmente funciona para impedir que las células que tienen el ADN dañado progresen a la mitosis. [17] El punto de control G2 puede verse comprometido si el supresor tumoral p53 ya no está presente en la célula. [3] La respuesta al daño del ADN presente durante la mitosis es diferente de la respuesta al daño del ADN detectado durante el resto del ciclo celular. [3] Las células pueden detectar defectos del ADN durante el resto del ciclo celular y repararlos si es posible o sufrir apoptosis de senescencia. [3] Dado que cuando esto sucede la célula no progresa a la mitosis, no se considera una catástrofe mitótica. [3]
La catástrofe mitótica en el cáncer
Prevención de la inestabilidad genómica
La inestabilidad genómica es una de las características de las células cancerosas y promueve cambios genéticos (tanto grandes cambios cromosómicos como cambios de nucleótidos individuales) en las células cancerosas que pueden conducir a mayores niveles de progresión tumoral a través de la variación genética en la célula tumoral. [18] Se ha demostrado que los cánceres con un mayor nivel de inestabilidad genómica tienen peores resultados para los pacientes que aquellos cánceres que tienen niveles más bajos de inestabilidad genómica. [19] Las células han adquirido mecanismos que resisten el aumento de la inestabilidad genómica en las células. [3] La catástrofe mitótica es una forma en que las células evitan la propagación de células genómicamente inestables. [3] Si la catástrofe mitótica falla para las células cuyo genoma se ha vuelto inestable, pueden propagarse sin control y potencialmente volverse tumorígenas. [6]
El nivel de inestabilidad genómica es diferente según el tipo de cáncer, siendo los cánceres epiteliales más inestables genómicamente que los cánceres de origen hematológico o mesenquimal. [20] El mesotelioma , el cáncer de pulmón de células pequeñas , el cáncer de mama , de ovario , el cáncer de pulmón de células no pequeñas y el cáncer de hígado presentan niveles elevados de inestabilidad genómica, mientras que la leucemia linfoblástica aguda , la mielodisplasia y el trastorno mieloproliferativo tienen niveles más bajos de inestabilidad. [20]
Terapéutica contra el cáncer
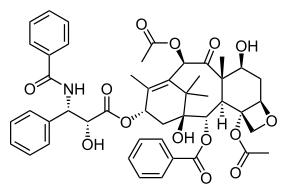
La promoción de la catástrofe mitótica en células cancerosas es un área de investigación terapéutica del cáncer que ha ganado interés y se considera un objetivo potencial para superar la resistencia desarrollada a las quimioterapias actuales. [4] Se ha descubierto que las células cancerosas son más sensibles a la inducción de la catástrofe mitótica que las células no cancerosas del cuerpo. [3] Las células tumorales a menudo han inactivado la maquinaria necesaria para la apoptosis, como la proteína p53. [4] Esto generalmente se logra mediante mutaciones en la proteína p53 o por la pérdida de la región cromosómica que contiene el código genético para ella. [21] p53 actúa para prevenir la propagación de células tumorales y se considera una proteína supresora de tumores importante. [21] p53 funciona deteniendo la progresión a través del ciclo celular cuando se detecta una división celular descontrolada o puede promover la muerte celular a través de la apoptosis en presencia de daño irreparable del ADN. [21] La catástrofe mitótica puede ocurrir de manera independiente de p53 y, por lo tanto, presenta una vía terapéutica de interés. [4] Además, se ha demostrado que dosis de fármacos que dañan el ADN inferiores a los niveles letales inducen una catástrofe mitótica. [4] Esto permitiría la administración de un fármaco mientras el paciente tiene menos efectos secundarios. [3]
Las terapias contra el cáncer pueden inducir una catástrofe mitótica ya sea dañando el ADN de las células o inhibiendo el ensamblaje del huso. [4] Los medicamentos, conocidos como venenos para el huso, afectan la polimerización o despolimerización de los husos de microtúbulos y, por lo tanto, interfieren con la formación correcta de los husos mitóticos. [4] Cuando esto sucede, se activa el punto de control del ensamblaje del huso y se inhibe la transición de la metafase a la anafase. [4]
| Droga | Usos aprobados / fase de ensayo clínico / uso en investigación | Mecanismo de acción |
|---|---|---|
| Paclitaxel [4] | Uso aprobado: sarcoma de Kaposi relacionado con el SIDA , cáncer de mama , cáncer de pulmón de células no pequeñas y cáncer de ovario [22] | Promueve el ensamblaje del huso de microtúbulos y previene el desprendimiento de microtúbulos impidiendo que la célula entre o salga adecuadamente de la mitosis. [23] |
| Docetaxel [4] | Uso aprobado: cáncer de mama, cáncer de pulmón de células no pequeñas, cáncer de próstata , carcinoma de células escamosas de cabeza y cuello , adenocarcinoma de estómago y adenocarcinoma de la unión gastroesofágica [24] | |
| Vinblastina [4] | Uso aprobado: Cáncer de mama, coriocarcinoma , linfoma de Hodgkin , sarcoma de Kaposi, micosis fungoide , linfoma no Hodgkin , tumores de células germinales testiculares [25] | Despolimeriza los microtúbulos [4] |
| Vinkristina [4] | Uso aprobado: Leucemia linfoblástica aguda , linfomas , neuroblastoma , sarcomas y tumores del sistema nervioso central [26] | |
| Monastrol [3] | Uso de la investigación | Inhibidor de EG5 que altera el movimiento de los cromosomas durante la mitosis. [3] Esta perturbación provoca la muerte de células durante la mitosis o en la interfase posterior. [27] |
| ARRY-520 (Filanesib) [3] | Ensayo clínico de fase III : mieloma múltiple [27] | |
| VX-680 [3] | Investigación preclínica [28] | Inhibidor de AURKA / AURKB que altera el movimiento de los cromosomas y el citoesqueleto durante la mitosis |
| MLN8237 [4] | Ensayo clínico de fase I: tumores rabdoides teratoideos atípicos recurrentes pediátricos y tumores sólidos avanzados pediátricos Ensayo clínico fallido para linfomas y cáncer de pulmón en adultos [29] |
Véase también
Referencias
- ^ Galluzzi, Lorenzo; Vitale, Ilio; Aaronson, Stuart A.; Abrams, John M.; Adán, Dieter; Agostinis, Patrizia; Alnemri, Emad S.; Altucci, Lucía; Amelio, Ivano; Andrews, David W.; Annicchiarico-Petruzzelli, Margherita; Antonov, Alexey V.; Arama, Elí; Baehrecke, Eric H.; Barlev, Nickolai A. (marzo de 2018). "Mecanismos moleculares de muerte celular: recomendaciones del Comité de Nomenclatura sobre Muerte Celular 2018". Muerte y diferenciación celular . 25 (3): 486–541. doi :10.1038/s41418-017-0012-4. ISSN 1476-5403. PMC 5864239 . PMID 29362479.
- ^ abcd Castedo, María; Perfettini, Jean-Luc; Roumier, Thomas; Andreau, Karine; Medema, René; Kroemer, Guido (abril de 2004). "Muerte celular por catástrofe mitótica: una definición molecular". Oncogén . 23 (16): 2825–2837. doi : 10.1038/sj.onc.1207528 . ISSN 1476-5594. PMID 15077146. S2CID 28061417.
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae af ag ah ai aj Vitale, Ilio; Galluzzi, Lorenzo; Castedo, Maria; Kroemer, Guido (junio de 2011). "Catástrofe mitótica: un mecanismo para evitar la inestabilidad genómica". Nature Reviews Molecular Cell Biology . 12 (6): 385–392. doi :10.1038/nrm3115. ISSN 1471-0080. PMID 21527953. S2CID 22483746.
- ^ abcdefghijklmnopq Denisenko, Tatiana V.; Sorokina, Irina V.; Gogvadze, Vladimir; Zhivotovsky, Boris (enero de 2016). "Catástrofe mitótica y resistencia a los fármacos contra el cáncer: un vínculo que debe romperse". Actualizaciones sobre resistencia a los fármacos: revisiones y comentarios sobre quimioterapia antimicrobiana y anticancerígena . 24 : 1–12. doi :10.1016/j.drup.2015.11.002. ISSN 1532-2084. PMID 26830311.
- ^ abcd Galluzzi, Lorenzo; Vitale, Ilio; Aaronson, Stuart A.; Abrams, John M.; Adán, Dieter; Agostinis, Patrizia; Alnemri, Emad S.; Altucci, Lucía; Amelio, Ivano; Andrews, David W.; Annicchiarico-Petruzzelli, Margherita; Antonov, Alexey V.; Arama, Elí; Baehrecke, Eric H.; Barlev, Nickolai A. (marzo de 2018). "Mecanismos moleculares de muerte celular: recomendaciones del Comité de Nomenclatura sobre Muerte Celular 2018". Muerte y diferenciación celular . 25 (3): 486–541. doi :10.1038/s41418-017-0012-4. ISSN 1476-5403. PMC 5864239 . Número de modelo: PMID29362479.
- ^ abcde Mc Gee, Margaret M. (2015). "Apuntando a la vía de señalización de catástrofe mitótica en el cáncer". Mediadores de la inflamación . 2015 : 146282. doi : 10.1155/2015/146282 . ISSN 1466-1861. PMC 4600505 . PMID 26491220.
- ^ ab Fu, Xiao; Li, Mu; Tang, Cuilian; Huang, Zezhi; Najafi, Masoud (diciembre de 2021). "Dirección a los mecanismos de muerte de las células cancerosas por parte del resveratrol: una revisión". Apoptosis . 26 (11–12): 561–573. doi :10.1007/s10495-021-01689-7. ISSN 1573-675X. PMID 34561763. S2CID 237627882.
- ^ Sazonova, Elena V.; Petrichuk, Svetlana V.; Kopeina, Gelina S.; Zhivotovsky, Boris (9 de diciembre de 2021). "Un vínculo entre los defectos mitóticos y la catástrofe mitótica: detección y destino celular". Biology Direct . 16 (1): 25. doi : 10.1186/s13062-021-00313-7 . ISSN 1745-6150. PMC 8656038 . PMID 34886882.
- ^ abcd Lara-Gonzalez, Pablo; Pines, Jonathon; Desai, Arshad (septiembre de 2021). "Activación y silenciamiento del punto de control del ensamblaje del huso en los cinetocoros". Seminarios en biología celular y del desarrollo . 117 : 86–98. doi :10.1016/j.semcdb.2021.06.009. ISSN 1096-3634. PMC 8406419 . PMID 34210579.
- ^ Sinha, Debottam; Duijf, Pascal HG; Khanna, Kum Kum (2019-01-02). "Deslizamiento mitótico: una vieja historia con un nuevo giro". Ciclo celular . 18 (1): 7–15. doi :10.1080/15384101.2018.1559557. ISSN 1538-4101. PMC 6343733 . PMID 30601084.
- ^ abcde Ghelli Luserna di Rorà, Andrea; Martinelli, Giovanni; Simonetti, Giorgia (26 de noviembre de 2019). "El equilibrio entre muerte mitótica y deslizamiento mitótico en la leucemia aguda: ¿una nueva ventana terapéutica?". Revista de Hematología y Oncología . 12 (1): 123. doi : 10.1186/s13045-019-0808-4 . ISSN 1756-8722. PMC 6880427 . PMID 31771633.
- ^ abcd Ganem, Neil J; Storchova, Zuzana; Pellman, David (1 de abril de 2007). "Tetraploidía, aneuploidía y cáncer". Current Opinion in Genetics & Development . Cromosomas y mecanismos de expresión. 17 (2): 157–162. doi :10.1016/j.gde.2007.02.011. ISSN 0959-437X. PMID 17324569.
- ^ Ben-David, Uri; Amon, Angelika (enero de 2020). "El contexto lo es todo: aneuploidía en el cáncer". Nature Reviews. Genética . 21 (1): 44–62. doi :10.1038/s41576-019-0171-x. hdl : 1721.1/126231 . ISSN 1471-0064. PMID: 31548659. S2CID : 202746570.
- ^ Ogden, A; Rida, PCG; Aneja, R (agosto de 2012). "Reunámonos para evitar un embrollo: la desagrupación del centrosoma como una estrategia anticancerígena atractiva". Muerte celular y diferenciación . 19 (8): 1255–1267. doi :10.1038/cdd.2012.61. ISSN 1350-9047. PMC 3392635 . PMID 22653338.
- ^ Bornens, Michel (1 de febrero de 2021). "Organización y funciones del centrosoma". Current Opinion in Structural Biology . Organización y ensamblajes del centrosoma ● Plegado y unión. 66 : 199–206. doi : 10.1016/j.sbi.2020.11.002 . ISSN 0959-440X. PMID 33338884. S2CID 229324538.
- ^ Doxsey, Stephen; Zimmerman, Wendy; Mikule, Keith (junio de 2005). "Control del ciclo celular por el centrosoma". Tendencias en biología celular . 15 (6): 303–311. doi :10.1016/j.tcb.2005.04.008. ISSN 0962-8924. PMID 15953548.
- ^ Stark, George R.; Taylor, William R. (2004), Schönthal, Axel H. (ed.), "Análisis del puesto de control G2/M", Controles de puestos de control y cáncer: Volumen 1: Reseñas y sistemas modelo , vol. 280, Totowa, NJ: Humana Press, págs. 51–82, doi :10.1385/1-59259-788-2:051, ISBN 978-1-59259-788-8, PMID 15187249 , consultado el 26 de noviembre de 2022
- ^ Hanahan, Douglas (enero de 2022). «Características del cáncer: nuevas dimensiones». Cancer Discovery . 12 (1): 31–46. doi : 10.1158/2159-8290.CD-21-1059 . ISSN 2159-8290. PMID 35022204. S2CID 245916132.
- ^ Andor, Noemi; Maley, Carlo C.; Ji, Hanlee P. (1 de mayo de 2017). "Inestabilidad genómica en el cáncer: al borde de la tolerancia". Cancer Research . 77 (9): 2179–2185. doi :10.1158/0008-5472.CAN-16-1553. ISSN 0008-5472. PMC 5413432 . PMID 28432052.
- ^ ab Pikor, Larissa; Thu, Kelsie; Vucic, Emily; Lam, Wan (2013). "La detección y la implicación de la inestabilidad del genoma en el cáncer". Cancer and Metastasis Reviews . 32 (3): 341–352. doi :10.1007/s10555-013-9429-5. ISSN 0167-7659. PMC 3843371 . PMID 23633034.
- ^ abc Kanapathipillai, Mathumai (23 de mayo de 2018). "Tratamiento del cáncer asociado a la agregación de mutantes p53". Cánceres . 10 (6): 154. doi : 10.3390/cancers10060154 . ISSN 2072-6694. PMC 6025594 . PMID 29789497.
- ^ "Paclitaxel". Instituto Nacional del Cáncer . 5 de octubre de 2006. Consultado el 29 de noviembre de 2022 .
- ^ Zhu, Linyan; Chen, Liqun (13 de junio de 2019). "Progreso en la investigación sobre paclitaxel e inmunoterapia tumoral". Cellular & Molecular Biology Letters . 24 : 40. doi : 10.1186/s11658-019-0164-y . ISSN 1425-8153. PMC 6567594 . PMID 31223315.
- ^ "Docetaxel - NCI". www.cancer.gov . 2006-10-05 . Consultado el 2022-11-29 .
- ^ "Sulfato de vinblastina - NCI". www.cancer.gov . 2011-02-03 . Consultado el 2022-11-29 .
- ^ Triarico, Silvia; Romano, Alberto; Attinà, Giorgio; Capozza, Michele Antonio; Maurizi, Palma; Mastrangelo, Stefano; Ruggiero, Antonio (16 de abril de 2021). "Neuropatía periférica inducida por vincristina (VIPN) en tumores pediátricos: mecanismos, factores de riesgo, estrategias de prevención y tratamiento". Revista Internacional de Ciencias Moleculares . 22 (8): 4112. doi : 10.3390/ijms22084112 . ISSN 1422-0067. PMC 8073828 . PMID 33923421.
- ^ ab Garcia-Saez, Isabel; Skoufias, Dimitrios A. (1 de febrero de 2021). "Agentes dirigidos a Eg5: desde el descubrimiento de nuevos inhibidores basados en antimitóticos hasta la terapia y la resistencia al cáncer". Farmacología bioquímica . 184 : 114364. doi : 10.1016/j.bcp.2020.114364 . ISSN 0006-2952. PMID 33310050. S2CID 229180081.
- ^ Rossari, Federico; Minutolo, Filippo; Orciuolo, Enrico (2018-06-20). "Pasado, presente y futuro de los inhibidores de Bcr-Abl: desde el desarrollo químico hasta la eficacia clínica". Journal of Hematology & Oncology . 11 (1): 84. doi : 10.1186/s13045-018-0624-2 . ISSN 1756-8722. PMC 6011351 . PMID 29925402.
- ^ Mills, Christopher C.; Kolb, EA.; Sampson, Valerie B. (1 de diciembre de 2017). "Revisión: avances recientes de las terapias con inhibidores del ciclo celular para el cáncer pediátrico". Investigación sobre el cáncer . 77 (23): 6489–6498. doi :10.1158/0008-5472.CAN-17-2066. ISSN 0008-5472. PMC 5712276 . PMID 29097609.