Leghemoglobin
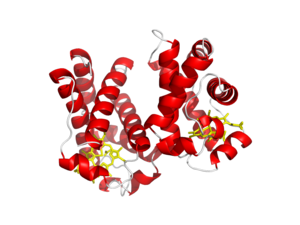
| Leghemoglobina, sitio de unión del hierro | |
|---|---|
| Identificadores | |
| Símbolo | Leghemoglobina_Fe_BS |
| Interprofesional | IPR019824 |
| PROSITIO | PS00208 |
La leghemoglobina (también llamada leghemoglobina o legoglobina ) es una fitoglobina transportadora de oxígeno que se encuentra en los nódulos de las raíces fijadoras de nitrógeno de las plantas leguminosas . Estas plantas la producen en respuesta a la colonización de las raíces por bacterias fijadoras de nitrógeno, llamadas rizobios , como parte de la interacción simbiótica entre la planta y la bacteria: las raíces no colonizadas por Rhizobium no sintetizan leghemoglobina. La leghemoglobina tiene similitudes químicas y estructurales cercanas a la hemoglobina y, al igual que la hemoglobina, es de color rojo. Originalmente se pensó que el grupo prostético hemo para la leghemoglobina de la planta lo proporcionaba el simbionte bacteriano dentro de los nódulos de la raíz simbiótica. [1] [2] Sin embargo, trabajos posteriores muestran que la planta huésped expresa fuertemente los genes de biosíntesis del hemo dentro de los nódulos, y que la activación de esos genes se correlaciona con la expresión del gen de la leghemoglobina en los nódulos en desarrollo. [3] [4] [5] [6] [7] [8] [9] [10]
En plantas colonizadas por Rhizobium , como la alfalfa o la soja , la presencia de oxígeno en los nódulos de la raíz reduciría la actividad de la nitrogenasa sensible al oxígeno , que es una enzima responsable de la fijación del nitrógeno atmosférico. Se ha demostrado que la leghemoglobina amortigua la concentración de oxígeno libre en el citoplasma de las células vegetales infectadas para garantizar el funcionamiento adecuado de los nódulos de la raíz. Dicho esto, la fijación de nitrógeno es un proceso extremadamente costoso desde el punto de vista energético, por lo que la respiración aeróbica , que necesita una alta concentración de oxígeno, es necesaria en las células del nódulo de la raíz. [11] La leghemoglobina mantiene una concentración de oxígeno libre lo suficientemente baja como para permitir que funcione la nitrogenasa, pero una concentración de oxígeno total lo suficientemente alta (libre y unido a la leghemoglobina) para la respiración aeróbica.
La leghemoglobina pertenece a la clase de globinas simbióticas , que también incluyen las globinas de los nódulos de las raíces de plantas actinorícicas como la casuarina . La globina simbiótica de la casuarina es intermedia entre la leghemoglobina y la fitoglobina-2 no simbiótica. [12] [13]
Estructura
Las leghemoglobinas son proteínas monoméricas con una masa de alrededor de 16 kDa, y son estructuralmente similares a la mioglobina . [14] Una proteína leghemoglobina consiste en un hemo unido a un hierro, y una cadena polipeptídica (la globina). [14] Similar a la mioglobina y la hemoglobina, el hierro del hemo se encuentra en su estado ferroso in vivo, y es la fracción que se une al oxígeno. [14] A pesar de las similitudes en el mecanismo de unión del oxígeno entre la leghemoglobina y la hemoglobina animal, y el hecho de que la leghemoglobina y la hemoglobina animal evolucionaron a partir de un ancestro común, existe una disimilitud en la secuencia de aminoácidos entre estas proteínas en aproximadamente el 80% de las posiciones. [14]

Las afinidades de unión al oxígeno de las leghemoglobinas son entre 11 y 24 veces mayores que las afinidades de unión al oxígeno de la mioglobina del cachalote. [15] Las diferencias en las afinidades se deben a las tasas diferenciales de asociación entre los dos tipos de proteínas. [15] Una explicación de este fenómeno es que en la mioglobina, una molécula de agua unida se estabiliza en un bolsillo que rodea al grupo hemo. Este grupo de agua debe ser desplazado para que el oxígeno se una. No hay tal agua unida en el bolsillo análogo de la leghemoglobina, por lo que es más fácil para una molécula de oxígeno acercarse al hemo de la leghemoglobina. [14] La leghemoglobina tiene una tasa de disociación de oxígeno lenta, similar a la mioglobina. [16] Al igual que la mioglobina y la hemoglobina, la leghemoglobina tiene una alta afinidad por el monóxido de carbono. [16]
En la estructura primaria de la leghemoglobina A de la soja, se encuentra una valina (F7) en el lugar donde hay una serina (F7) en la mioglobina. Sin un enlace de hidrógeno que fije la orientación de la cadena lateral de histidina proximal, el anillo de imidazol puede ocupar una conformación escalonada entre los átomos de nitrógeno del pirrol y puede moverse fácilmente hacia arriba hasta el plano del hemo. Esto aumenta en gran medida la reactividad del átomo de hierro y la afinidad por el oxígeno. En la leghemoglobina A, la cadena lateral de histidina distal también se gira alejándose del ligando unido mediante la formación de un enlace de hidrógeno con la tirosina. [17]
Los grupos hemo son los mismos en todas las leghemoglobinas conocidas, pero la secuencia de aminoácidos de la globina difiere ligeramente según la cepa bacteriana y la especie de legumbre. [14] Incluso dentro de una planta leguminosa, pueden existir múltiples isoformas de leghemoglobinas. Estas a menudo difieren en su afinidad por el oxígeno y ayudan a satisfacer las necesidades de una célula en un entorno particular dentro del nódulo. [18]
Debate sobre la función principal
Los resultados de un estudio de 1995 sugirieron que la baja concentración de oxígeno libre en las células de los nódulos de la raíz se debe en realidad a la baja permeabilidad al oxígeno de las células de los nódulos de la raíz. [19] De ello se deduce que el principal propósito de la leghemoglobina es recolectar el oxígeno libre limitado en la célula y entregarlo a las mitocondrias para la respiración. Pero, los científicos de un artículo posterior de 2005 sugieren que la leghemoglobina es responsable tanto de amortiguar la concentración de oxígeno como de la entrega de oxígeno a las mitocondrias. [20] Sus estudios de eliminación de leghemoglobina mostraron que la leghemoglobina en realidad disminuye significativamente la concentración de oxígeno libre en las células de los nódulos de la raíz, y que la expresión de nitrogenasa se eliminó en mutantes knockout de leghemoglobina, presumiblemente debido a la degradación de la nitrogenasa con alta concentración de oxígeno libre. Su estudio también mostró una mayor relación ATP / ADP en células de nódulos de la raíz de tipo salvaje con leghemoglobina activa, lo que sugiere que la leghemoglobina también ayuda con la entrega de oxígeno para la respiración.
Las plantas contienen hemoglobinas simbióticas y no simbióticas. Se cree que las hemoglobinas simbióticas son importantes para la fijación simbiótica de nitrógeno (SNF). En las leguminosas, la SNF tiene lugar en órganos especializados llamados nódulos que contienen bacteroides o rizobios fijadores de nitrógeno. La inducción de genes vegetales específicos de los nódulos, que incluyen aquellos que codifican leghemoglobinas simbióticas (Lb), acompaña el desarrollo de los nódulos. Las leghemoglobinas se acumulan en concentraciones milimolares en el citoplasma de las células vegetales infectadas antes de la fijación de nitrógeno para amortiguar el oxígeno libre en el rango nanomolar, lo que puede evitar la inactivación de la nitrogenasa lábil al oxígeno mientras se mantiene un flujo de oxígeno lo suficientemente alto para la respiración en la célula. Las leghemoglobinas son necesarias para la SNF, pero no son necesarias para el crecimiento y desarrollo de las plantas en presencia de una fuente externa de nitrógeno fijado. Las leghemoglobinas hacen la contribución esencial de establecer bajas concentraciones de oxígeno libre mientras mantienen un alto estado de energía en las células. Estas son las condiciones necesarias para una SNF eficaz. [20]
Otras hemoglobinas vegetales
Desde entonces, se ha identificado a las globinas como una proteína común a muchos taxones de plantas, no restringida a los simbióticos. A la luz de este descubrimiento, se ha propuesto que el término fitoglobinas se utilice para referirse a las globinas de las plantas en general. [12]
Las fitoglobinas se pueden dividir en dos clados. El tipo 3/3-fold contiene las clases I y II de fitoglobinas de angiospermas, y es el común a todos los eucariotas ( HGT de una flavohemoglobina bacteriana). La leghemoglobina sensu stricto es una fitoglobina de clase II. El tipo 2/2-fold "TrHb2" contiene la clase III en la nomenclatura de las angiospermas, y parece haber sido adquirido de Chloroflexota (anteriormente Chloroflexi) por el ancestro de las plantas terrestres. [12]
Uso comercial
Impossible Foods solicitó a la FDA estadounidense su aprobación para utilizar leghemoglobina de soja recombinante en alimentos como análogo de la hemoglobina derivada de la carne . [21] [22] La aprobación de la FDA llegó en julio de 2019, [23] fue impugnada, [a] y luego confirmada, el 3 de mayo de 2021, por un tribunal federal de apelaciones de San Francisco. [24] [25] Actualmente se está utilizando en sus productos para imitar el color, el sabor y la textura de la carne. [26]
Véase también
Referencias
- ^ Nadler KD, Avissar YJ (septiembre de 1977). "Síntesis de hemo en nódulos de raíces de soja: I. Sobre el papel de la sintetasa del ácido delta-aminolevulínico y la deshidrasa del ácido delta-aminolevulínico en la síntesis del hemo de la leghemoglobina". Fisiología vegetal . 60 (3): 433–6. doi :10.1104/pp.60.3.433. PMC 542631 . PMID 16660108.
- ^ O'Brian MR, Kirshbom PM, Maier RJ (diciembre de 1987). "La síntesis de hemo bacteriano es necesaria para la expresión de la holoproteína de la leghemoglobina pero no de la apoproteína en los nódulos de la raíz de la soja". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 84 (23): 8390–3. Bibcode :1987PNAS...84.8390O. doi : 10.1073/pnas.84.23.8390 . PMC 299548 . PMID 3479799.
- ^ Sangwan I, O'Brian MR (marzo de 1991). "Evidencia de una vía biosintética del hemo interorganismos en nódulos de raíces de soja simbióticas". Science . 251 (4998): 1220–2. Bibcode :1991Sci...251.1220S. doi :10.1126/science.251.4998.1220. PMID 17799282. S2CID 11471787.
- ^ Sangwan I, O'Brian MR (marzo de 1992). "Caracterización de la formación de ácido delta-aminolevulínico en nódulos de raíces de soja". Fisiología vegetal . 98 (3): 1074–9. doi :10.1104/pp.98.3.1074. PMC 1080310 . PMID 16668729.
- ^ Sangwan I, O'Brian MR (julio de 1993). "Expresión del gen de glutamato 1-semialdehído aminotransferasa de soja (Glycine max) en nódulos radiculares simbióticos". Fisiología vegetal . 102 (3): 829–34. doi :10.1104/pp.102.3.829. PMC 158853 . PMID 8278535.
- ^ Madsen O, Sandal L, Sandal NN, Marcker KA (octubre de 1993). "Un gen de la coproporfirinógeno oxidasa de la soja se expresa en gran medida en los nódulos de la raíz". Biología molecular de las plantas . 23 (1): 35–43. doi :10.1007/BF00021417. PMID 8219054. S2CID 23011457.
- ^ Kaczor CM, Smith MW, Sangwan I, O'Brian MR (abril de 1994). "Ácido delta-aminolevulínico deshidratasa vegetal. Expresión en nódulos de raíces de soja y evidencia de un linaje bacteriano del gen Alad". Fisiología vegetal . 104 (4): 1411–7. doi :10.1104/pp.104.4.1411. PMC 159307 . PMID 8016269.
- ^ Frustaci JM, Sangwan I, O'Brian MR (marzo de 1995). "gsa1 es un gen universal de síntesis de tetrapirrol en la soja y está regulado por un elemento GAGA". The Journal of Biological Chemistry . 270 (13): 7387–93. doi : 10.1074/jbc.270.13.7387 . PMID 7706283.
- ^ Santana MA, Pihakaski-Maunsbach K, Sandal N, Marcker KA, Smith AG (abril de 1998). "Evidencia de que la planta huésped sintetiza la fracción hemo de la leghemoglobina en los nódulos de la raíz". Fisiología vegetal . 116 (4): 1259–69. doi :10.1104/pp.116.4.1259. PMC 35032 . PMID 9536042.
- ^ Sangwan I, O'Brian MR (febrero de 1999). "Expresión de un gen de soja que codifica la enzima de síntesis de tetrapirrol glutamil-ARNt reductasa en nódulos radiculares simbióticos". Fisiología vegetal . 119 (2): 593–8. doi :10.1104/pp.119.2.593. PMC 32136 . PMID 9952455.
- ^ Berg, J.; Tymoczko, J.; Gatto Jr., G.; Stryer, L. (2015). Bioquímica (8.ª ed.). WH & Freeman Company.
- ^ abc Becana, Manuel; Yruela, Inmaculada; Sarath, Gautam; Catalán, Pilar; Hargrove, Mark S. (septiembre de 2020). "Hemoglobinas vegetales: un viaje desde las algas verdes unicelulares hasta las plantas vasculares". New Phytologist . 227 (6): 1618–1635. doi : 10.1111/nph.16444 . hdl : 10261/219101 . PMID 31960995.
- ^ Hill R, Hargrove MS, Arredondo-Peter R (2016). "Fitoglobina: una novedosa nomenclatura para las globinas vegetales aceptada por la comunidad de globinas en la XVIII conferencia de 2014 sobre proteínas de unión y detección de oxígeno". F1000Research . 5 : 212. doi : 10.12688/f1000research.8133.1 . PMC 4792203 . PMID 26998237.
- ^ abcdef Singh S., Varma A. (2017) Estructura, función y estimación de la leghemoglobina. En: Hansen A., Choudhary D., Agrawal P., Varma A. (eds) Biología y biotecnología del rizobio. Soil Biology, vol. 50. Springer, Cham
- ^ ab Harutyunyan EH, Safonova TN, Kuranova IP, Popov AN, Teplyakov AV, Obmolova GV, Rusakov AA, Vainshtein BK, Dodson GG, Wilson JC. "La estructura de la desoxi y oxileghemoglobina del altramuz".
{{cite journal}}: Requiere citar revista|journal=( ayuda ) [ se necesita cita completa ] - ^ ab Wittenberg JB, Appleby CA, Wittenberg BA (enero de 1972). "La cinética de las reacciones de la leghemoglobina con oxígeno y monóxido de carbono". Journal of Biological Chemistry . 247 (2): 527–531. doi : 10.1016/S0021-9258(19)45734-7 . PMID 4333266.
- ^ Smagghe, Benoit J.; Hoy, Julie A.; Percifield, Ryan; Kundu, Suman; Hargrove, Mark S.; Sarath, Gautam; Hilbert, Jean-Louis; Watts, Richard A.; Dennis, Elizabeth S.; Peacock, W. James; Dewilde, Sylvia; Moens, Luc; Blouin, George C.; Olson, John S.; Appleby, Cyril A. (diciembre de 2009). "Revisión: correlaciones entre la afinidad por el oxígeno y las clasificaciones de secuencias de hemoglobinas vegetales". Biopolímeros . 91 (12): 1083–1096. doi :10.1002/bip.21256. ISSN 0006-3525. PMID 19441024. S2CID 1891302.
- ^ Kawashima K, Suganuma N, Tamaoki M, Kouchi H (2001). "Dos tipos de genes de leghemoglobina del guisante que muestran diferentes afinidades de unión al O2 y patrones distintos de expresión espacial en nódulos". Plant Physiol . 125 (2): 641–651. doi :10.1104/pp.125.2.641. PMC 64866 . PMID 11161022.
- ^ Ludwig RA, de Vries GE (1986). "Fisiología bioquímica de la fijación de dinitrógeno de Rhizobium". En Broughton WJ, Pühler S (eds.). Nitrogen Fixation, Vol. 4: Molecular Biology . Oxford, Reino Unido: Clarendon University Press. págs. 50–69. ISBN 978-0-19-854575-0.
- ^ ab Ott, Thomas; van Dongen, Joost T.; Günther, Catrin; Krusell, Lene; Desbrosses, Guilhem; Vigeolas, Helene; Bock, Vivien; Czechowski, Tomasz; Geigenberger, Peter; Udvardi, Michael K. (29 de marzo de 2005). "Las leghemoglobinas simbióticas son cruciales para la fijación de nitrógeno en los nódulos de las raíces de las leguminosas, pero no para el crecimiento y desarrollo general de las plantas". Current Biology . 15 (6): 531–535. Bibcode :2005CBio...15..531O. doi : 10.1016/j.cub.2005.01.042 . ISSN 0960-9822. PMID 15797021.
- ^ "Aviso GRAS 540". www.accessdata.fda.gov . Archivado desde el original el 30 de junio de 2017. Consultado el 21 de enero de 2018 .
- ^ "Aviso GRAS 737". www.accessdata.fda.gov . Consultado el 22 de agosto de 2018 .[ enlace muerto permanente ]
- ^ "El competidor de Beyond Meat, Impossible Foods, planea lanzarlo en las tiendas de comestibles en septiembre después de obtener la aprobación de la FDA". CNBC . 31 de julio de 2019 . Consultado el 31 de julio de 2019 .
- ^ Justine Calma (3 de mayo de 2021). "Impossible Foods supera la batalla legal sobre el ingrediente que hace que su carne 'sangre'". theverge.com . Archivado desde el original el 7 de mayo de 2021.
- ^ Sally Ho (6 de mayo de 2021). "Impossible Foods gana la batalla legal por el ingrediente hemo que alimenta la hamburguesa vegetal 'sangrante'". greenqueen.com.hk . Archivado desde el original el 6 de mayo de 2021.
- ^ Bandoim, L. (20 de diciembre de 2019). "Qué significa la decisión de la FDA sobre la leghemoglobina de soja para Impossible Burger". Forbes . Consultado el 4 de marzo de 2020 .
Notas
- ^ Presentado por la organización de defensa sin fines de lucro Center for Food Safety
Lectura adicional
- Virtanen AI (1948). "Fijación biológica del nitrógeno". Revista anual de microbiología . 2 (1): 485–506. doi :10.1146/annurev.mi.02.100148.002413. PMID 18122253.
- Taiz, L.; Zeiger, E. (2006). Fisiología vegetal en línea (3ª ed.). Sunderland, MA: Sinauwr Associates, Inc. pág. 269.ISBN 978-0-87893-856-8Archivado desde el original el 9 de mayo de 2008. Consultado el 3 de mayo de 2008 .
- La “salsa secreta” de Impossible Burger destaca los desafíos de la tecnología alimentaria
- Actualizaciones La FDA anuncia la fecha de entrada en vigor de la norma final que añade la leghemoglobina de soja a la lista de colorantes exentos de certificación
